微生物复合菌剂法污泥原位减量群落动态研究
赵鑫,刘一威,李晓东,包震宇,胡筱敏,全燮
(1.东北大学资源与土木工程学院,辽宁沈阳110004;2.辽宁省环境科学研究院,辽宁 沈阳110161;3.大连理工大学工业生态与环境工程教育部重点实验室,辽宁大连116024)
活性污泥法是现有应用最为广泛的污水生物处理技术,具有技术成熟、工艺灵活多样和污水处理效果好等诸多优点。但是,产生的剩余污泥中不单含有大量的有机物质,还存在重金属和致病性细菌等环境危险物,容易引发环境的二次污染[1]。随着城市的发展和人口的不断膨胀,工业废水与生活污水的排放量日益增多,剩余污泥的大量产生成为污水处理厂正常运行的巨大负担。2006年,欧洲4万多家污水处理厂每年产生大约7亿吨的干污泥[2],处理成本350~750欧元/吨干污泥[3]。2000-2010年的10年间,我国城市污水排放量和污泥产生量大幅增长,增长近12倍[4-6]。剩余污泥的大量产生导致后续处理难度加大,能耗和费用也大幅攀升。而且,传统的以堆肥处理、水体消纳、焚烧处理和土地填埋利用为主的剩余污泥处理方法已经无法满足现有需求[7],现阶段,亟待寻求在污水处理过程中实现污泥减量的行之有效的新技术。
生物法的污泥原位减量,在欧美和日本等国开展研究较多,主要集中在解偶联技术、微生物隐性生长技术和生物捕食技术3个方面[8]。微生物复合菌剂法污泥原位减量技术是一种较新的污泥减量方法,是将具有自我消化量大和产酶能力强等特性的复合多功能微生物菌剂投加入活性污泥中,在原系统中减少污泥排放量的一种技术[8]。这种技术实现污泥减量的方式主要包括:1)优化微生物群落结构;2)强化微生物分解代谢;3)延长污泥龄、增加活性微生物数量;4)生物捕食等4种[9-13]。针对这种污泥原位减量技术,国内外开展了一些研究。李俊[9]和王敏[10]等分别对 MCMP微生物制剂的污泥减量效果和作用方式进行了探讨,最高实现污泥减量近90%。香杰新[14]等探讨了微生物复合菌剂在膜生物反应器中的应用,使污泥浓度(MLSS)降低 44.4%。蔡勋江[15]等,分析了微生物菌剂EM1用于SBR处理校园生物污水的能力,MLSS降低6%,并且保证了污水处理效果不受影响。
虽然,目前国内外学者针对微生物复合菌剂法污泥原位减量开展了一些研究,也获得了一些很好的实验结果。但是,这些研究主要集中在检测减量效果,缺少在微生物层面的分析。因此,本研究在前人的研究基础上,尝试在探讨微生物复合菌剂法污泥原位减量效果和减量稳定性的同时,使用分子生态学PCRDGGE技术,对污泥原位减量过程中的微生物群落结构变化进行检测,尝试在微生物和分子层面对实现污泥减量的机制进行初步探讨。
1 材料与方法
1.1 实验设置
实验装置如图1所示,采用5 L的塑料量水杯作为SBR实验装置,在底部设曝气盘曝气,由电磁空气压缩泵提供曝气,由气体流量计控制进气量;由时控开关控制兰格蠕动泵的进水和排水的时间。
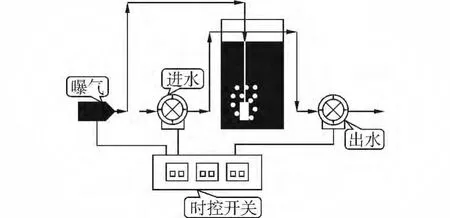
图1 反应装置示意图Fig.1 A schematic diagram of the reactor
反应装置设计有效容积4 L,日处理污水8 L,DO为4 mg/L,控制污泥浓度2 000~2500 mg/L,2组实验装置同时运行;实验运行第3天,按照日处理水量的2%,向反应器中投加微生物复合菌剂。对进出水COD、水温、总氮、总磷和污泥浓度进行监测,同时计算污泥的累计产生量和单位产生量的变化。
由于量水杯无法设置沉淀池排水,因此设计反应装置由3组时控开关控制进行周期运行(图2所示):进水8 min,曝气2.5 h,沉淀静置 15 min,排水 5 min;每个循环运行3 h,每个循环进水1 L,每天配水1次,定期排泥。
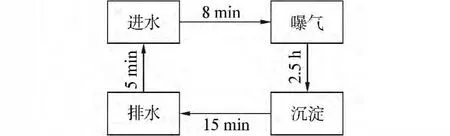
图2 时控开关工作方案Fig.2 The time control switch working program
1.2 污泥减量菌剂
实验过程中,在投加前对微生物复合菌剂进行2 h的曝气,按照日处理水量体积的2%,加入反应系统中。
1.3 实验水质
为了探讨污泥原位减量效果,保证系统运行稳定性,进水水质参考生活污水,采用人工模拟生活污水(COD 320 mg/L),配水水质指标参数如表1所示。

表1 进水成分组成Table 1 The inflow water composition mg/L
1.4 微生物群落监测
1.4.1 基因组DNA提取和样品扩增
不同时间的活性污泥样品的基因组DNA使用美国MOBIO公司的Power Soil DNA Isolation Kit试剂盒提取。细菌基因组DNA使用16S rRNA通用引物扩增,引物为Bac 968 F(5’-AAC GCG AAG AAC CTT AC-3’)和 Univ1401 R(5’-GCG TGT GTA CAA GAC CC-3’),反向引物加 GC clamp(CGC CCG CCG CGC CCC GCG CCC GTC CCG CCG CCC CCG CCC G)。PCR使用大连宝生物公司的PCR扩增试剂盒,扩增程序为:94°C 预变性5 min;94°C 变性30,55°C 退火30 s,72°C延伸30 s,共30个循环;72°C最终延伸10 min。PCR产物使用10 g/L浓度的琼脂糖胶电泳检测。
1.4.2 DGGE 电泳检测
DGGE电泳检测使用美国Bio-Rad的DCodeTM突变检测系统。制备8%的丙烯酰胺凝胶,变性剂浓度依次为30%和60%,其中变性剂和聚丙烯酰胺的浓度从胶的上方向下方递增;60°C 下,200 V 电泳4 h[16]。电泳结束后,凝胶使用 AgNO3染色[17]。
对DGGE凝胶中出现的特异性条带进行切胶回收,经第2轮PCR扩增和纯化后,链接至pMD19-T载体(大连宝生物公司),交由华大基因公司完成测序工作。测序结果提交至GenBank数据库,经比对后,使用生物信息学软件MEGA 4.1的Neighbor-joining构建系统发育进化树[18]。
2 结果与讨论
2.1 微生物菌剂对污染物去除的影响
空白对照组(NC)和实验组(TG)2个反应器中污染物去除率如图3所示。
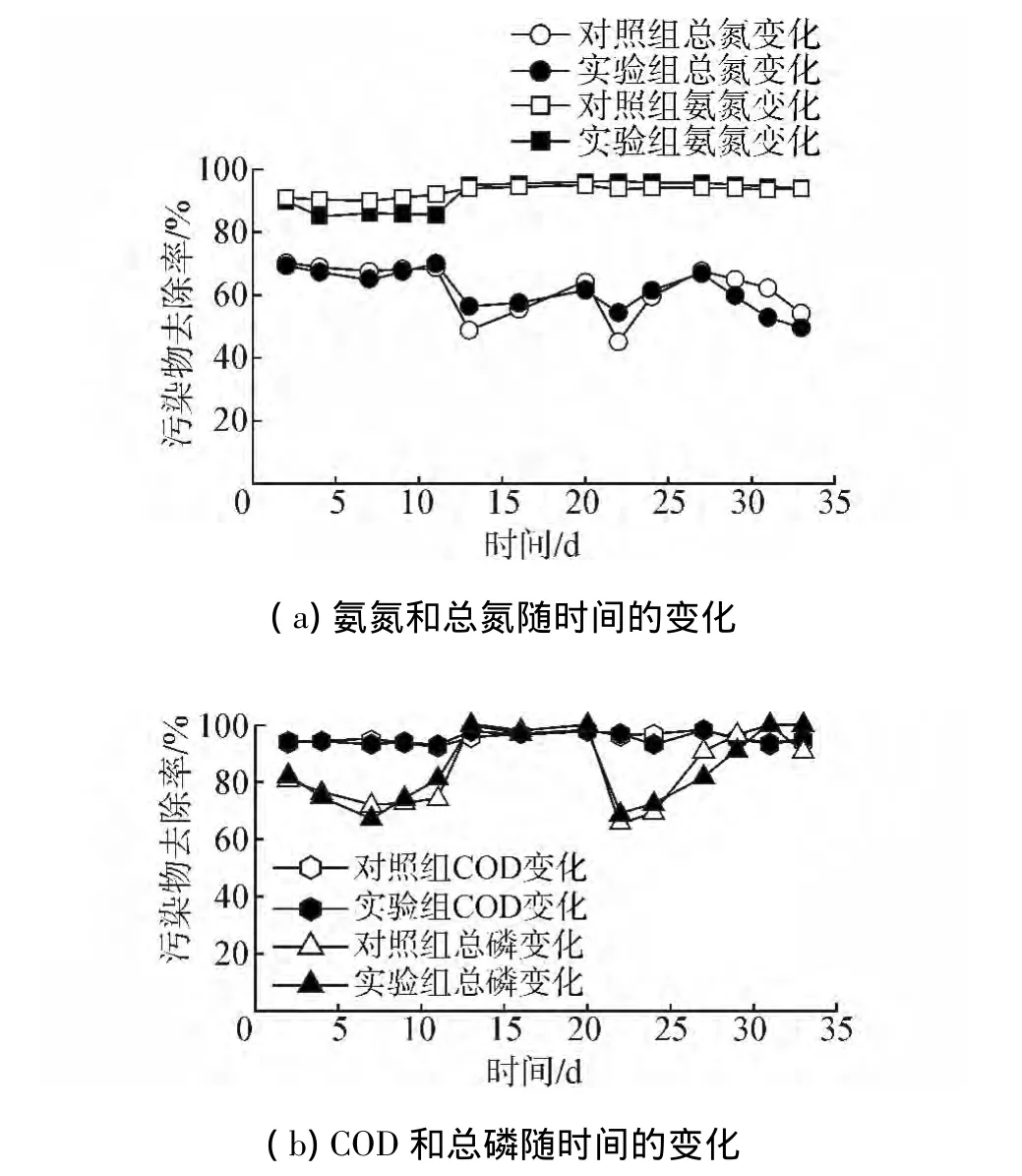
图3 污染物去除率变化Fig.3 The changes of pollutant removal rates
实验初期,反应器处于启动阶段,污染物的去除还略有波动。投加微生物复合菌剂之后,总氮、氨氮和总磷去除率略有下降,随后逐步恢复到与空白对照组相同。在实验运行过程中,第12天和第21天出现停电,导致第13天和第22天的出水氨氮和总磷略有波动,但是对照组和实验组的整体趋势没有受到影响,差异很小。在反应器启动阶段,氨氮去除率在85%~95%之间,随着系统的逐步稳定,氨氮去除率保持在90%以上;由于实验在6~7月间完成,期间温度变化较大,可能是总氮和总磷去除效率产生大幅波动的另一个主要原因,在反应器运行过程中,总氮平均去除率在60%左右,总磷平均去除率在80%以上,其中,在第13~20天和第31~33天,总磷的去除效率接近100%,而且实验组对总磷的去除效率要优于空白对照组。在反应器运行的33 d内,COD的去除率未受到投加微生物菌剂的影响,一直保持在95%左右。
2.2 微生物菌剂污泥原位减量效果
图4所示为污泥累计产生量和单位污泥产生率变化情况。在实验初始,空白对照组和实验组的污泥浓度分别为1 989 mg/L和2 190 mg/L,按照反应器容积4 L计算,总污泥量分别为7 956 mg和8 760 mg,实验组的污泥总量略高于空白对照组。在第3天投加微生物复合菌剂后,额外增加的微生物使实验组的污泥累计产量有一个明显提升。从图中可以发现,实验组的污泥累计产量的增幅低于空白对照组,随着实验的进行,空白对照组的污泥量逐步趋近于实验组,在第24天超过实验组。实验终止时,投加微生物复合菌剂的实验组较空白对照组累计少产生污泥20.8%。
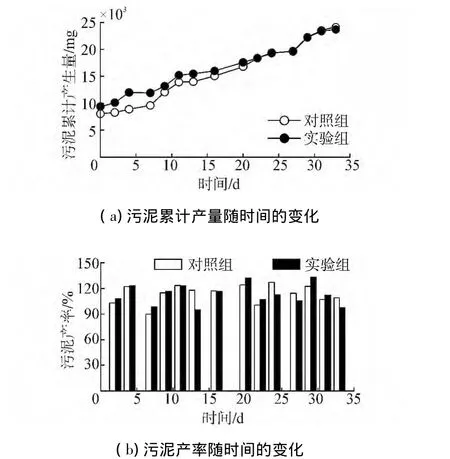
图4 污泥产生量和单位产率变化Fig.4 The changes of sludge accumulated production and production rates
2.3 微生物群落多样性分析
在实验过程中,使用PCR-DGGE技术分析了投加微生物复合菌剂对系统中微生物的群落结构的影响,电泳结果如图5所示,其中NC为空白对照组,TG为实验组。通过比较发现,2个反应器中的微生物群落结构存在很大差异,将电泳中的特异性条带切胶回收并测序,测序结果如表2所示,系统发育进化树见图6。
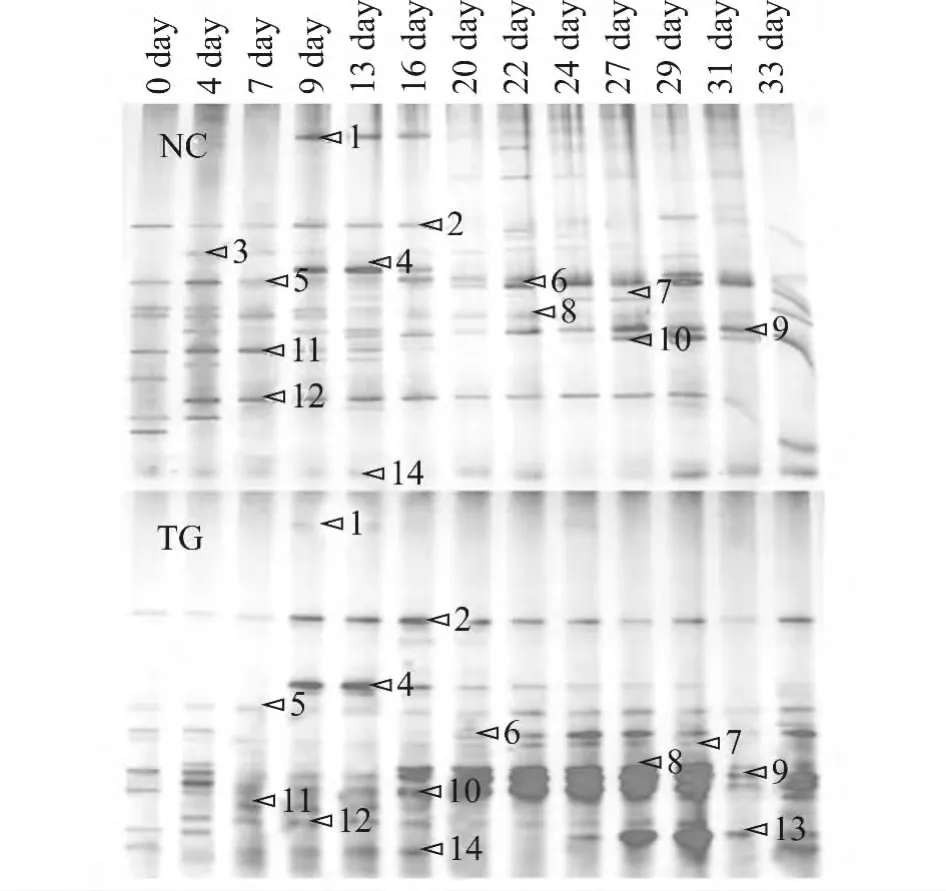
图5 不同时期样品的16S rRNA基因DGGE电泳谱图Fig.5 DGGE profile of the 16S rRNA gene during different periods
投加微生物复合菌剂后,2个反应器的微生物群落结构产生明显的差异。在第7~13天,系统内的微生物之间产生明显的竞争,群落结构形成演替变化。NC组条带少而且清晰,而实验组的条带亮度较弱较平均,说明实验组的微生物竞争较激烈,种群演替速率较快。第16~31天,TG组经过前期较为激烈的种群竞争,系统形成稳定的群落结构,活性污泥中band 8、9、10对应的微生物形成稳定的优势菌群,同时形成band 2、4、5、6共存的群落结构,而且在15 d的运行时间内,保持稳定。NC组的微生物群落结构仍然处于演替过程中,没有形成特别稳定的群落结构,主要以band 6、7、9、12对应的微生物为主,其余微生物互相竞争演替。在微生物互相竞争的过程中,一些微生物逐步被淘汰。band 12在NC组中一直存在于反应的始终;而在TG组,从第13天开始逐渐减弱,最后消失。band 14在NC组中较弱,但是一直都可以被检测到,但是在TG组竞争被逐步淘汰。
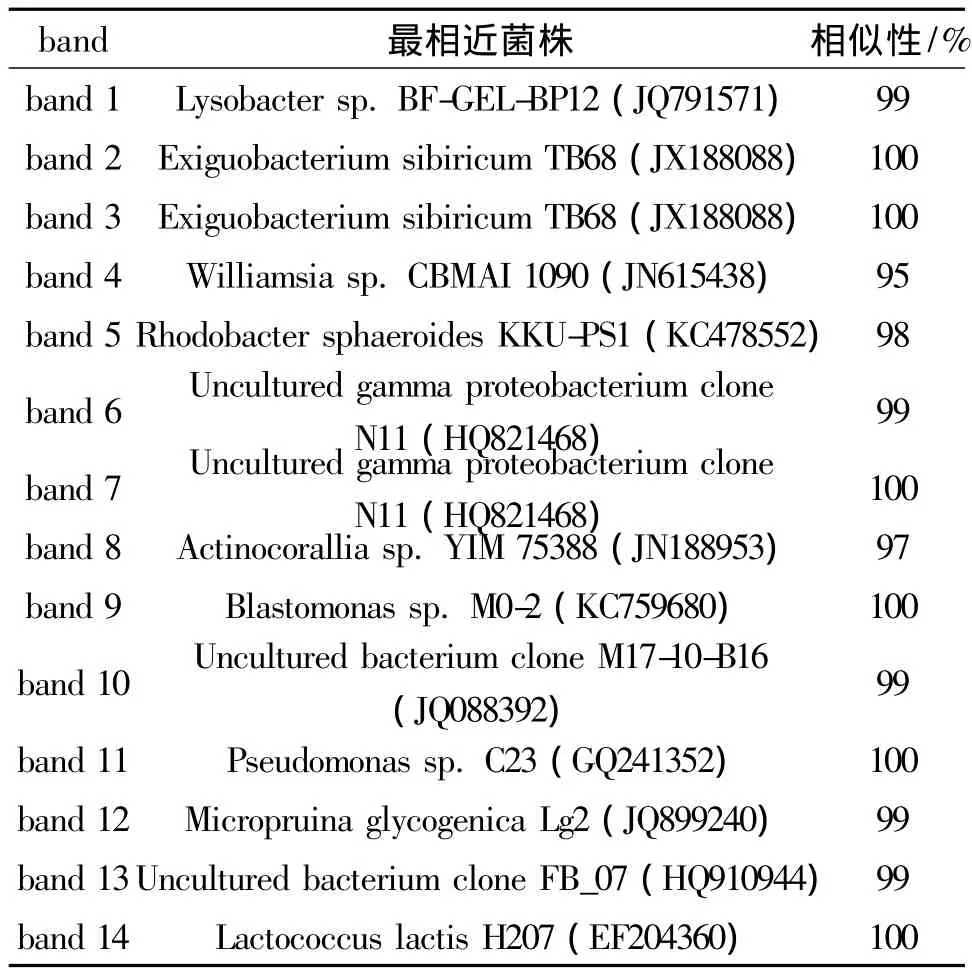
表2 污泥中微生物16S rRNA比对结果Table 2 Phlogenic affiliations of 16S rRNA from sludge samples
通过测序结果比对发现,在第16~31天的稳定期间,实验组形成的稳定微生物群落结构组成主要包括:Exiguobacterium sibiricum(band 2)、Williamsia sp.(band 4)、Rhodobacter sphaeroides(band 5)、Uncultured gamma proteobacterium(band 6)、Actinocorallia sp.(band 8)、Blastomonas sp.(band 9)和 uncultured bacterium clone(band 10)。
向活性污泥中投加微生物复合菌剂,可以促进活性污泥中的微生物的竞争,菌剂中的微生物强化了活性污泥中可以起到减量效果的微生物的数量优势,加速一些老化和衰弱菌群被淘汰,优化活性污泥中的微生物群落结构,在最短时间内形成稳定的优势菌群。在实验的第12天和第21天,实验室出现了几小时的短暂停电,2组反应器的污染物的去除率受到影响;其中总氮的去除率降低至50%左右,停电对NC组的总氮去除效率的影响更为明显,2次停电导致次日检测时总氮去除率低于50%。从DGGE谱图可以发现,停电导致微生物群落结构改变,与前后2次取样时间点相比较,NC组的微生物群落结构受影响更为明显,TG组的微生物群落变化不大,可以推断是导致NC组总氮去除率明显降低的原因。投加微生物复合菌剂,可以强化菌群结构,降低外界因子对微生物群落结构的扰动,保证系统的稳定运行。
复合菌剂中存在的一些真菌和放线菌,例如:Actinocorallia sp.(band 8)可以促进系统中的活性污泥保持良好的絮凝性和稳定状态。投加微生物复合菌剂还巩固了一些功能菌群的优势地位,通过比较之前的研究发现,在实验中检测到的微生物均为污水处理过程中常见微生物,其中,Rhodobacter sp.(band 5)具有非常良好的聚磷能力[19-20],Exiguobacterium sp.(band 2)同时具备氨化和固磷能力[21-22],Williamsia sp.(band 4)具有很好的有机污染物降解能力[23],Blastomonas sp.(band 9)与污水中碳循环有关[24]。具有污染物降解能力的功能微生物在系统中迅速达到优势地位,并保持稳定,可以提高系统保持污染物的去除能力;稳定的功能微生物群落结构降低了受外界影响时对污染物去除率产生波动。
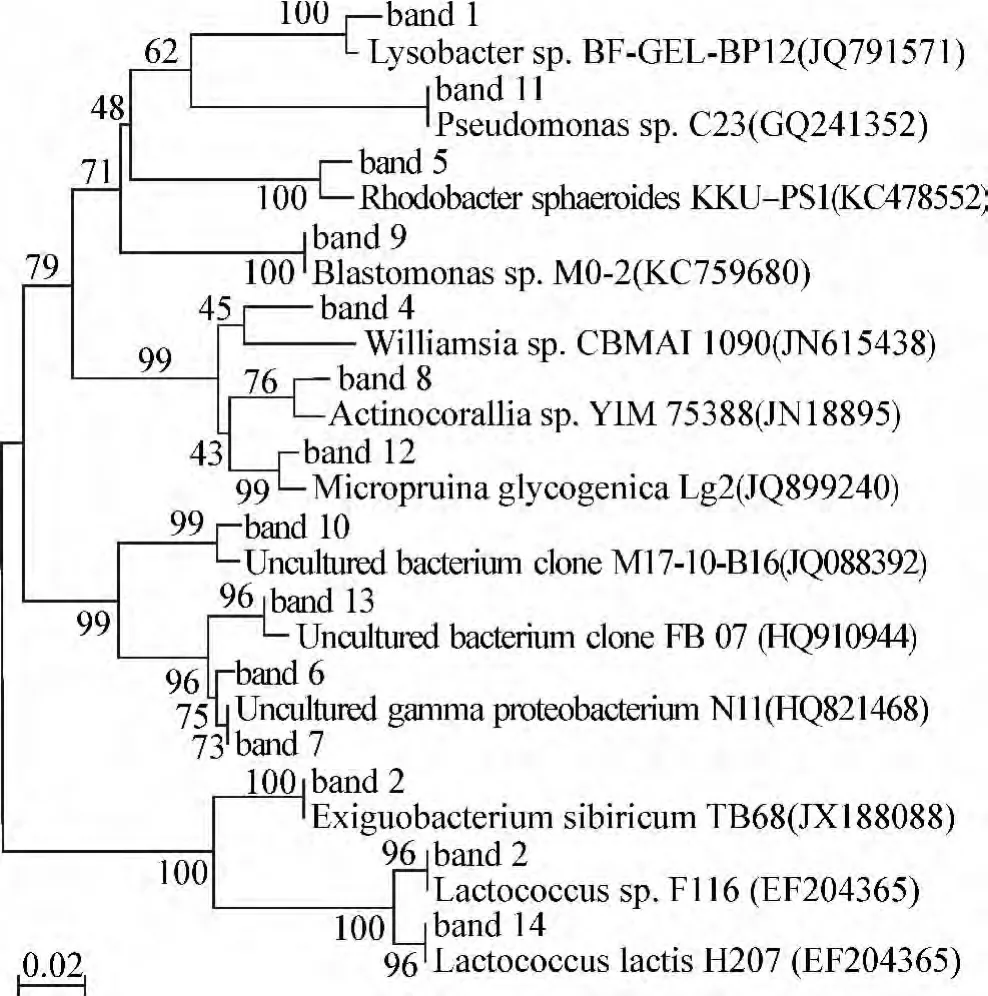
图6 16S rRNA系统发育进化树谱图Fig.6 Phylogenetic tree of dominant populations based on 16S rRNA
3 结论
1)在SBR系统中投加微生物复合菌剂可以减少剩余污泥的产生量。在33 d的运行时间内,与空白对照组相比,实现污泥原位减量20.8%;COD和氨氮的去除效率未受到影响,均保持在90%以上,而T-N和T-P的去除效率较空白对照组略有提高。
2)向活性污泥中投加微生物复合菌剂,可以促进活性污泥中的微生物的竞争,缩短污泥中微生物形成稳定群落结构的时间,并增强群落结构稳定性,降低了受外界环境因子变化影响。
3)微生物复合菌剂可以强化脱氮固磷和污染物去除能力强的微生物的优势地位,提高污染物去除效率。在本实验中组成稳定群落结构的功能微生物主要为Rhodobacter sp.、Exiguobacterium sp.、Williamsia sp.、Blastomonas sp.、Actinocorallia sp.和一些未被培养的微生物。
[1]AFSHIN T,NASER M,ALI AKBAR A,et al.Investigation of the excess sludge reduction in SBR by oxidizing some sludge by ozone[J].Iranian Journal of Chemistry and Chemical Engineering,2009,28(4):95-104.
[2]ROMAN H J,BURGESS J E,PLETSCHKE B I.Enzyme treatment to decrease solids and improve digestion of primary sewage sludge[J].African Journal of Biotechnology,2006,5(10):963-967.
[3]GINESTET P.Comparative Evaluation of sludge reduction routes[M].[S.l.]:IWA Publishing,2007:15.
[4]梁鹏,黄霞,钱易,等.污泥减量化技术的研究进展[J].环境污染治理技术与设备,2003(1):44-52.LIANG Peng,HUANG Xia,QIAN Yi,et al.Research progress on sludge reduction technologies[J].Tech Equip Environ Pollut Control,2003(1):44-52.
[5]王守仁,王增长,宋秀兰,等.污泥处理技术发展[J].水资源保护,2010,26(1):80-83.WANG Shouren,WANG Zengzhang,SONG Xiulan,et al.Development of technique for sewage sludge treatment[J].Water Resource Prot,2010,26(1):80-83.
[6]陈菊香.剩余污泥减量化-资源化的研究[J].环境科技,2011,24(2):7-9.CHEN Juxiang.Research on reduction and reuse of excess sludge[J].Environmental Science and Technology,2011,24(2):7-9.
[7]贾丽.A+OSA污泥减量工艺物质能量转化及其微生态特性研究[D].重庆:重庆大学,2012:11-16.JIA Li.Study on conversion of the mass and energy and microecological characters in A+OSA excess sludge reduction process[D].Chongqing:Chongqing University,2012:11-16.
[8]张海珍.MCMP-II多功能复合微生物制剂用于城市污水处理厂污泥减量[D].重庆:重庆大学,2008:5-20.ZHANG Haizhen.Full scale study on activated sludge reduction of WWTP using multifunctional compound micrio-organisms preparation[D].Chongqing:Chongqing University,2008:5-20.
[9]李俊,朱臻,朱国政,等.利用MCMP微生物制剂减少剩余污泥产量的研究[J].环境工程学报,2007,1(12):92-95.LI Jun,ZHU Zhen,ZHU Gguozheng,et al.Study on reducing of excess sludge production by MCMP inoculation[J].Chinese Journal of Environmental Engineering,2007,1(12):92-95.
[10]王敏,王里奥,包亮,等.多功能微生物制剂用于污泥减量的研究[J].中国给水排水,2007,23(7):16-19.WANG Min,WANG Li'ao,BAO Liang,et al.Study on application ofmultifunctionalcompound microorganism product forsludgereduction[J]. ChinaWaterand Wastewater,2007,23(7):16-19.
[11]李俊,庞子山,朱臻,等.利用微生物制剂进行污泥减量的生产性试验研究[J].中国给水排水,2008,24(3):1-4.LI Jun,PANG Zishan,ZHU Zhen,et al.Study on productive experiment of sludge reduction by microbial preparation[J].China Water and Wastewater,2008,24(3):1-4.
[12]GUJER W,HENZE M,MINO T,et al.Activated sludge model No.3[J].Water Sci Technol,1999,39(1):183-193.
[13]CABRERO A.Effects of copper and zinc on the activated sludge bacteria growth kinetics[J].Water Res,1998,32:1355-1362.
[14]香杰新,蔡勋江,范洪波,等.复合菌剂用于膜生物反应器的污泥减量试验研究[J].水处理技术,2009,35(5):98-101.XIANG Jiexin,CAI Xunjiang,FAN Hongbo,et al.Study on addition of hybrid bacteria into membrane bioreactor for sludge reduction[J].Technol Water Treat,2009,35(5):98-101.
[15]蔡勋江,李娴,黎晓微.不同微生物菌剂用于SBR处理校园生活污水的研究[J].工业用水与废,2012,43(1):64-67.CAI Xunjiang,LI Xian,LI Xiaowei.Treatment of schoolyard domestic sewage by SBR added with different microbial agents[J].Ind Water Wastewater,2012,43(1):64-67.
[16]REN N,XING D,RITTMANN B E,et al.Microbial community structure of ethanol type fermentation in bio-hydrogen production[J].Environ Microbiol,2007,9(5):1112-1125.
[17]BASSAM B J,CAETANO-ANOLLES G,GRESSHOFF P M.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].Anal Biochem,1991,196:80-83.
[18]ZHAO X,XING D,ZHANG L,et al.Characterization and over expression of a[FeFe]-hydrogenase gene of a novel hydrogen-producing bacterium Ethanoligenens harbinense[J].Int J Hydrogen Energy,2010,35:9598-9602.
[19]李广科,桑楠.球形红杆菌废水除磷作用的研究[J].城市环境与城市生态,2001,14:22-24.LI Guangke,SANG Nan.Study on biological phosphate removal by Rhodobacter sphacroides[J].Urban Env Urban Ecol,2001,14:22-24.
[20]李广科,赵由才,桑楠.球形红杆菌磷耐受能力和除磷特性的研究[J].农业环境保护,2002,21:403-405,416.LI Guangke,ZHAO Youcai,SANG Nan.Tolerance and removal Characteristics of Rhodobacter sphacroides towards phosphate[J]. AgricultureEnvironmentalProtection,2002,21:403-405,416.
[21]闫韫.布吉河生物修复过程中氮循环功能菌群分布研究[D].哈尔滨:哈尔滨工业大学,2008:47-55.YAN Yun.Study on the distribution of nitrogen cycling microbial community in bioremediation process of Buji River[D].Harbin:Harbin Institute of Technology,2008:47-55.
[22]许彦娟,张利平.反硝化聚磷菌的分离筛选及鉴定[J].河北农业大学学报,2008,30:60-63.XU Yanjuan,ZHANG Liping.Isolation screening and identification of denitrifying polyphosphate-accumulating organisms[J].Journal of Agricultural University of Hebei,2008,30:60-63.
[23]管芜萌.长庆油田石油污染土壤的原位修复微生物的筛选和鉴定[D].西安:西北农林科技大学,2010:7-19.GUAN Wumeng.Filtration and identification of in-situ remedtion microbial ecological for oil contaminated soil in Changqing Oil Field[D].Xi'an:Northwest A & F University,2010:7-19.
[24]吴文祥.烟草自毒物质及其对根际土壤微生物影响的研究[D].福州:福建农林大学,2010:29-33.WU Wenxiang.Study on the autotoxic substances of tobacco and the effects of autotoxic substances on the rhizospheric microbiology[D].Fuzhou:Agriculture and Forestry U-niversity,2010:29-33.

