人脐带沃顿胶间充质干细胞体外分离条件的优化及传代效应的流式细胞学检测
洪敬欣,李茜,2,韩俊领,2△
人脐带沃顿胶间充质干细胞体外分离条件的优化及传代效应的流式细胞学检测
洪敬欣1,李茜1,2,韩俊领1,2△
目的观察不同胶原酶消化方法对人脐带沃顿胶间充质干细胞(mesenchymal stem cell,MSC)分离和培养结果的影响,并鉴定其分化潜能;探讨传代效应对其免疫表型的影响。方法将制备好的脐带标本分别加入Ⅰ型、Ⅱ型及Ⅳ型胶原酶,持续消化4~18 h,筛网过滤,离心收集细胞,用DMEM/F12培养基重悬细胞,调整细胞密度4.8× 103~1×104/cm2,接种培养,比较不同消化法分离人脐带沃顿胶MSC的效果。Von kossa钙结节染色、四环素荧光标记鉴定人脐带沃顿胶MSC向成骨方向分化的能力,RT-PCR鉴定其向心肌细胞分化的能力。应用流式细胞仪检测连续传代后MSC的免疫表型变化。结果Ⅰ型胶原酶消化法能够从人脐带沃顿胶获取了数量较多、活力较高的MSC,而且细胞出现伸展的时间及原代培养时间均短于Ⅱ型胶原酶及Ⅳ型胶原酶消化法。表面标记分析显示:随着传代次数的增加,阳性标记CD29、CD44、CD73、CD90、CD105的表达百分率没有变化,而阴性标记CD31、CD34和HLA-DR的表达率增加明显。体外诱导实验表明:来源于人脐带沃顿胶的MSC具有体外成骨和成心肌样细胞分化的能力。结论Ⅰ型胶原酶消化法简单易行,对细胞损伤小,能稳定、高效地从人脐带沃顿胶中分离出MSC。
脐带;间质干细胞;胶原酶类;传代效应;沃顿胶
脐带是连于胚胎脐部与胎盘间的索状结构,外被羊膜、内含分化的黏液性结缔组织,结缔组织内除闭锁的卵黄囊和尿囊外,还有脐动脉和脐静脉[1]。脐带中的间充质干细胞(mesenchymal stem cell,MSC)可来源于沃顿胶、脐血管周围、脐血及脐静脉血管内皮下,人脐带MSC在适当的诱导条件下能向脂肪和成骨细胞分化,是理想的组织工程种子细胞。目前许多实验室分离人脐带MSC的方法不尽相同,主要包括胶原酶消化法、脐静脉内膜消化法、植块法[2-4],其中胶原酶消化法多以胶原酶为主。目前尚少见关于多种胶原酶消化人脐带沃顿胶差异的报道。为进一步验证哪种胶原酶更适宜消化人脐带沃顿胶MSC,本研究比较了不同胶原酶消化方法对人脐带沃顿胶MSC培养的影响,并观察连续传代后其免疫表型的变化,为其产业化生产及在细胞治疗、组织工程等方面的应用提供依据。
1 材料与方法
1.1材料经产妇知情同意,采集足月剖宫产健康胎儿脐带30份。实验经采集医院伦理委员会批准。脐带采集之前产妇需做艾滋病病毒抗体、乙型肝炎病毒抗体、丙型肝炎病毒抗体、梅毒螺旋体抗体、丙氨酸转氨酶、支原体等检测,全部合格以确保安全后方可采集。
1.2主要仪器与试剂恒温CO2孵箱(美国Thermo SCI⁃ENTIFIC);倒置生物显微镜(美国 LEICA DMI3000B,日本Nikon ECLIPSE TE300);生物显微镜(国产XSP-17C);DMEM/F-12培养基、Ⅰ型胶原酶、Ⅱ型胶原酶、Ⅳ型胶原酶、胰蛋白酶、0.4%台盼蓝染液、PBS均购自美国GIB⁃CO;PE标记的CD73、APC标记的CD34/CD44/小鼠IgG1购自美国 GIBCO;PE标记的 CD29/CD105/小鼠 IgG1、FITC标记的 CD31/CD90/HLA-DR、APC标记的小鼠IgG1κ购自英国Serotec;地塞米松、β-甘油磷酸钠、2-磷酸抗坏血酸、四环素染液、5-氮胞苷均购自美国Sigma;PI、RNase A购自北京赛驰生物科技有限公司;胎牛血清(澳大利亚PAA);Von kossa染色液(上海舜百生物科技有限公司)。
1.3人脐带沃顿胶MSC的分离脐带剪断双侧结扎部分,用1×PBS反复冲洗脐带,然后将脐带剪成1~5 mm3大小的组织块后放入试剂瓶,每份脐带标本平均分成3份,每份分别用以下3种方法进行分离培养。(1)Ⅰ型胶原酶消化法:向试剂瓶内加入Ⅰ型胶原酶,持续消化4~18 h,筛网过滤,离心收集细胞。用DMEM/F12培养基(含体积分数为10%的FBS)重悬细胞,调整细胞密度4.8×103~1×104个/cm2,接种于6孔板内,37℃、5%CO2恒温孵箱内培养,24 h后换液。(2)Ⅱ型胶原酶消化法:向试剂瓶内加入Ⅱ型胶原酶,以下操作同(1)。(3)Ⅳ胶原酶消化法:向试剂瓶内加入Ⅳ型胶原酶,以下操作同(1)。计算获得的总细胞数及活细胞数,待细胞贴壁后达70%~80%融合时于倒置生物显微镜下观察成纤维细胞集落形成单位(CFU-F),计数标准为50个细胞以上计为1个集落。
1.4人脐带沃顿胶MSC细胞活力分析将0.5 mL细胞悬液加入试管中。按 1∶1加入0.4%台盼蓝染液,染色2~3 min。吸取少许悬液涂于载玻片上,加上盖片。死细胞能被台盼蓝染上色,镜下可见深蓝色的细胞,活细胞不被染色,镜下呈无色透明状。镜下随机读取任意视野分别计数死细胞和活细胞,按下面公式计算细胞活力:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100。
1.5人脐带沃顿胶MSC周期检测将处于对数生长期的人脐带MSC制备成单细胞悬液,1 500 r/min离心3 min;弃去上清,PBS漂洗1次,将细胞重悬于70%乙醇(-20℃预冷)中,4℃固定1 h以上;1 500 r/min离心3 min收集固定后的细胞;PBS洗涤1次,1 500 r/min离心3 min收集细胞;将细胞重悬于含100 mg/L RNase A和1×PI的PBS中,室温孵育30 min;将经PI染色和RNase A消化后的细胞悬液用300目的尼龙膜过滤,流式细胞仪检测、分析。
1.6人脐带沃顿胶MSC免疫表型检测取P4、P7、P10、P15、P20代细胞,胰蛋白酶消化后制备成单细胞悬液,经细胞计数后调整每管细胞总数为1×106个。100 μL PBS重悬,加入荧光标记抗体10 μL;4℃避光孵育30 min;1 500 r/min离心3 min后弃上清,PBS清洗1次以去除游离的荧光抗体;400 μL PBS轻轻混匀悬浮细胞,将细胞悬液移入FACS专用管中,进行仪器检测和分析。
1.7细胞的多向分化潜能及分化后鉴定
1.7.1向成骨细胞分化将P5代细胞以5×104/孔接种于6孔板中,待细胞达70%~80%融合时,更换为成骨诱导培养液(含10%胎牛血清,1×10-7mol/L地塞米松,10 mmol/L β-甘油磷酸钠,50 μmol/L 2-磷酸抗坏血酸的DMEM/F12培养液),诱导后行Von kossa染色及四环素荧光鉴定。
1.7.2向心肌样细胞分化将P5代细胞以5×104/孔密度接种于6孔板中,待细胞达70%~80%融合时,加10 μmol/L 5-氮胞苷,24 h后立即更换为含10%胎牛血清的DMEM/F12培养液,每隔2 d换液1次,培养8周,提取细胞的RNA,行RT-PCR检测人心肌转录因子GATA4和NKX2.5,心肌肌浆网钙ATP酶、α-肌球蛋白重链、肌钙蛋白I、α-横纹肌肌动蛋白及GAPDH基因的表达。
1.8统计学方法结果用SPSS 17.0软件进行统计学分析,3组比较采用方差分析,组间多重比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1不同分离方法对人脐带沃顿胶MSC培养结果的影响Ⅰ型胶原酶消化脐带获得的原代细胞数量多、活性高,贴壁细胞散在分布,24 h见贴壁细胞呈单层生长,伸展为短梭形、长梭形,细胞数量和细胞活力均优于Ⅱ型和Ⅳ型胶原酶消化法,见图1、表1。此后实验中所采用细胞均由Ⅰ型胶原酶消化所得。

Fig.1 The primary human umbilical cord mesenchymal stromal cells in Wharton's jelly isolated by three different ways of digestion(×40)图1 人脐带沃顿胶MSC通过不同分离方法获得的原代细胞(×40)
Tab.1 Comparison the cell number and vitality between three different ways of isolation of human umbilical cord mesenchymal stromal cells in Wharton's jelly表1 3种方法分离人脐带沃顿胶MSC产生的细胞数量和细胞活率比较 (±s)
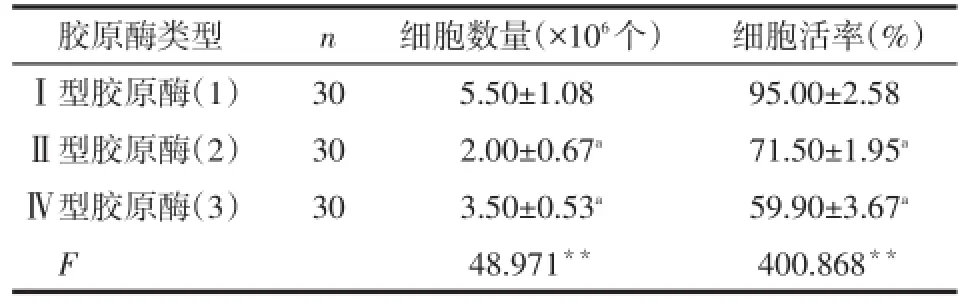
Tab.1 Comparison the cell number and vitality between three different ways of isolation of human umbilical cord mesenchymal stromal cells in Wharton's jelly表1 3种方法分离人脐带沃顿胶MSC产生的细胞数量和细胞活率比较 (±s)
**P<0.01;a与(1)比较,P<0.05
n胶原酶类型Ⅰ型胶原酶(1)Ⅱ型胶原酶(2)Ⅳ型胶原酶(3)F细胞数量(×106个)5.50±1.08 2.00±0.67a3.50±0.53a48.971**细胞活率(%)95.00±2.58 71.50±1.95a59.90±3.67a400.868**30 30 30
2.2人脐带沃顿胶MSC的细胞周期情况91.67%细胞处于G0/G1期,8.33%细胞处于活化增殖状态的S+G2+M期,见图2。
2.3人脐带沃顿胶MSC的免疫表型特征P4、P7、P10、P15及P20代细胞高表达黏附分子受体标记CD29、CD44,间质细胞标记 CD73(SH3)、CD105 (SH2),及干细胞标记CD90,而低表达或不表达内皮细胞标记CD31、造血干细胞标志CD34和组织相容性Ⅱ类抗原HLA-DR,见图3。P15代细胞的阴性表面标记HLA-DR表达率增加4倍,P20代细胞的阴性表面标记CD31、CD34和HLA-DR的表达率明显增高,见表2。
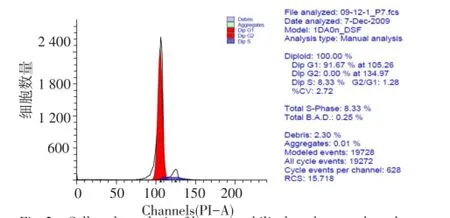
Fig.2 Cell cycle analysis of human umbilical cord mesenchymalstromal cells in Wharton's jelly图2 人脐带沃顿胶间充质干细胞的细胞周期分析
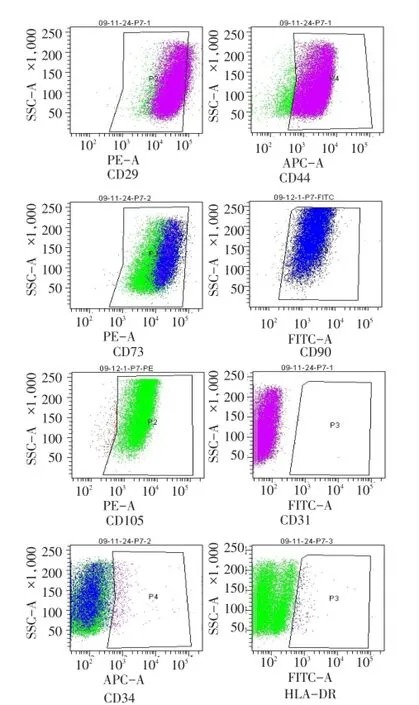
Fig.3 Immunophenotype of umbilical cord mesenchymal stromal cells in Wharton's Jelly图3 人脐带沃顿胶间充质干细胞的免疫表型检测

Tab.2 Flow cytometry results of human umbilical cord mesenchymal stromal cells in Wharton's jelly表2 人脐带沃顿胶MSC传代效应的流式细胞学检测 (%)
2.4人脐带沃顿胶MSC的分化潜能
2.4.1成骨分化经过21 d的诱导,显微镜下可见P5代人脐带MSC可形成成骨细胞,四环素的荧光检测可见在形成钙结节的位置有红色荧光信号,Von kossa染色(苏木素复染)可见黑色矿化物沉积,见图4。
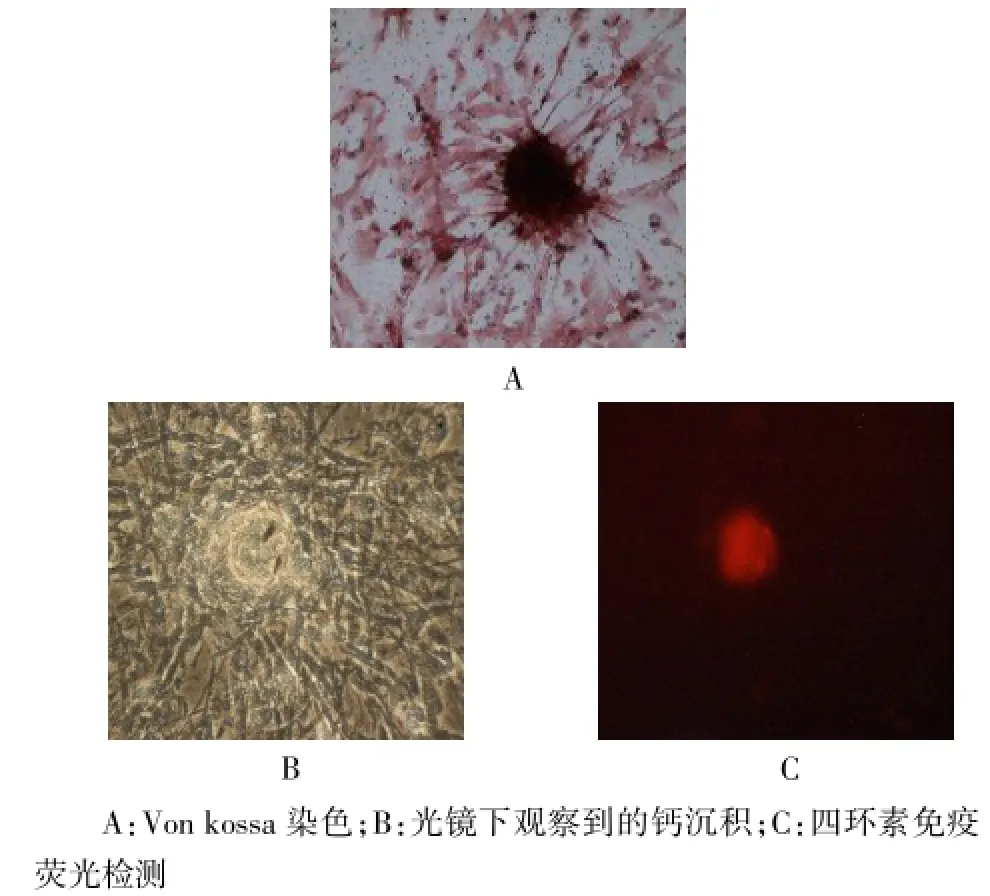
Fig.4 Differentiation potentials of passage 5 of human umbilical cord mesenchymal stromal cells in Wharton's jelly(×100)图4 体外诱导3周后第5代人脐带沃顿胶间充质干细胞的成骨分化潜能(×100)
2.4.2心肌分化经5-氮胞苷诱导10 d,显微镜下观察,细胞朝一个方向拉长为杆状,有部分细胞出现死亡。诱导30 d,细胞逐渐变为多角形及星形,细胞增殖速度有所减缓。诱导56 d,细胞变为双核或多核细胞,细胞变得较宽大。RT-PCR结果表明,诱导分化的细胞有心肌细胞早期转录因子NKX2.5和G⁃ATA4及心肌肌浆网钙ATP酶基因、α-肌球蛋白重链基因、肌钙蛋白I基因、α-横纹肌肌动蛋白基因的表达,而诱导前的人脐带沃顿胶MSC均没有这些心肌细胞的特异性基因表达,见图5。

Fig.5 RT-PCR identification of cardiac differentiation图5 人脐带沃顿胶MSC的心肌分化RT-PCR鉴定
3 讨论
脐带为富含胶原和葡萄糖胺聚糖的组织,其中胶原占50%,透明质酸占葡萄糖胺聚糖的70%[5]。Wang等[6]将去除血管的脐带组织刮除沃顿胶组织后,胶原酶消化16 h,培养3 d即可观察到成纤维样细胞生长。Romanov等[7]和Covas等[8]对脐带血管系统行酶消化,培养7 d观察到成纤维样细胞。Saru⁃gaser等[9]将包裹沃顿胶基质的脐血管用胶原酶消化,可以观察到星形的成纤维样细胞。Mitchell等[10]用植块法获得了MSC,并证明了沃顿胶中的MSC具有前软骨细胞的特性[11]。郑志娟等[12]利用胶原酶、胰酶、透明质酸酶、DNA酶等消化沃顿胶发现只消化脐带血管收获细胞数为(2.5~25)×104个/cm脐带[13]。由此可见利用胶原酶消化整根脐带组织获得的有核细胞数最多。有研究采用植块法分离MSC,发现不同个体的脐带组织MSC爬出的时间不一致,平均需要2~3周的时间,如果采用胶原酶消化法培养MSC,2~3周的时间可以将细胞至少传代1~2次[14]。基于上述报道和考虑,本研究比较了不同胶原酶消化方法对分离人脐带沃顿胶MSC数量、细胞活力的影响。因为脐带组织富含胶原和透明质酸,故实验选择Ⅰ、Ⅱ和Ⅳ型胶原酶消化法。结果显示,采用Ⅰ型胶原酶消化法能从人脐带组织中分离出活性高且数量较多的MSC,而且细胞出现伸展的时间及原代培养时间均短于使用Ⅱ、Ⅳ型胶原酶消化法。该法简单易行,能减少MSC丢失,对细胞损伤小,培养成功率高,具有大规模培养的可能。细胞周期检测结果显示,91.67%细胞处于G0/G1期,8.33%细胞处于活化增殖状态的S+G2+M期,说明细胞具有很强的增殖潜能。因为实验采用的PI单染法,其缺点是无法区分G0期和G1期、G2期和M期。流式细胞学检测发现P4、P7、P10、P15、P20均较高表达黏附分子受体标记CD29、CD44,间质细胞标记CD73(SH3)、CD105(SH2)及干细胞标记CD90,表达率均在97%以上。此外,还发现10代以内的脐带MSC几乎不表达内皮细胞标记CD31、造血干细胞标记CD34和组织相容性Ⅱ类抗原HLA-DR,表达率在1%以下。但是超过10代,阴性标记表达率明显升高,例如P15和P20代HLA-DR表达率分别为4.1%和8.9%,P20代CD31和CD34的表达率为4.1%和3%,这些均说明经过多次传代长期体外培养扩增的绝大部分MSC,都已经是其分化的后代,即表达各种分化抗原的、已经定向分化的间充质细胞和终末分化而成的各种结缔组织细胞。由于至今还没有方法可以在体外纯化或克隆化MSC,当前唯一的方法是体外富集MSC,即收集培养贴壁的细胞。因此,在收获的间充质细胞群中,不可避免地混杂了同样也贴壁生长的,包括神经干细胞或肝脏干细胞等各种成体干细胞。
由于至今尚缺乏鉴定MSC的特异性指标,所以在MSC的相关实验设计时,需要既考虑其一系列的免疫表型,又要验证MSC诱导分化后的细胞。本实验在成骨诱导过程中发现,随着细胞的传代,一部分细胞会聚集成白色结节样结构,其周围的细胞呈放射状。MSC可对肝星状细胞有直接调控的效应[15]。心肌诱导实验验证了人脐带沃顿胶MSC在5-氮胞苷作用下能分化为具有心肌细胞标记的细胞,但实验未观察到分化细胞跳动的现象,考虑是体内外环境差异,影响到MSC向心肌细胞的分化,缺乏体内心肌细胞的结构和功能,因而不能形成完全的自发跳动,这仍然需要进一步的实验得以完善。随着人们对MSC更深入的探索,相信MSC作为细胞和基因治疗的靶细胞,以及种子细胞具有广阔的应用前景。
[1]Hou KD,Lu SB,Yuan M.The applications of the new seed cellsumbilical cord derived-mesenchymal stem cells in tissue engineer⁃ing[J].Med J Chin PLA,2007,32(9):988-990.[侯克东,卢世璧,袁玫.新种子细胞-脐带间充质干细胞在组织工程中的应用[J].解放军医学杂志,2007,32(9):988-990].
[2]Wang HS,Hung SC,Peng ST,et al.Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord[J].Stem Cells,2004,22 (7):1330-1337.
[3]Lu LL,Liu YJ,Yang SG,et al.Isolation and characterization of hu⁃man umbilical cord mesenchymal stem cells with hematopoiesissupportive function and other potentials[J].Haematologica,2006,91(8):1017-1026.
[4]Zhang YQ,Liang J,Tian QS,et al.Optimization of isolation and cul⁃ ture methods of human umbilical cord-derived mesenchymal stem cells[J].Journal of Mudanjiang Medical University,2013,34(5):7-9.[张亚倩,梁军,田沁森,等.人脐带间充质干细胞分离培养方法的优化[J].牡丹江医学院学报,2013,34(5):7-9].
[5]Yang WC,Dong YH.The research progress of human umbilical cord mesenchymal stem cells[J].Journal of Tissue Engineering and Reconstructive Surgery,2010,6(5):292-294.[杨文成,董有海.人脐带间充质干细胞的研究进展[J].组织工程与重建外科杂志,2010,6(5):292-294].
[6]Wang HS,Hung SC,Peng ST,et al.Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord[J].Stem Cells,2004,22(7):1330-1337.
[7]Romanov YA,Svintsitskaya VA,Smirnov VN.Searching for alterna⁃tive sources of postnatal human mesenchymal stem cells:candidate MSC-like cells from umbilical cord[J].Stem Cells,2003,21(1):105-110.
[8]Covas DT,Siufi JL,Silva AR,et al.Isolation and culture of umbili⁃cal vein mesenchymal stem cells[J].Braz J Med Biol Res,2003,36 (9):1179-1183.
[9]Sarugaser R,Lickorish D,Baksh D,et al.Human umbilical cord perivascular(HUCPV)cells:a source of mesenchymal progenitors [J].Stem Cells,2005,23(2):220-229.
[10]Mitchell KE,Weiss ML,Mitchell BM,et al.Matrix cells from Whar⁃ton's jelly form neurons and glia[J].Stem Cells,2003,21(1):50-60.
[11]Sun GD,Li ZZ.The research progress of umbilical cord derivedmesenchymal stem cells in tissue engineering[J].Progress in Mod⁃ern Biomedicine,2009,9(12):2389-2391.[孙国栋,李志忠.人脐带间充质干细胞在组织工程中的研究进展[J].现代生物医学进展,2009,9(12):2389-2391].
[12]Zheng ZJ,Zhuang WX,Fu WY.Advances of the umbilical cord Mesenchymal stem cells[J].Progress of Anatomical Sciences,2008,14 (1):100-104.[郑志娟,庄文欣,付文玉.人脐带间充质千细胞的研究进展[J].解剖科学进展,2008,14(1):100-104].
[13]Feng K,Xiao L,Ma XH,et al.Isolation,culture and surface markers detection of human umbilical cord mesenchymal stem cells[J].Jour⁃nal of Leukemia&Lymphoma,2013,22(6):354-356.[冯凯,肖漓,马锡慧,等.人脐带间充质干细胞分离培养及表面标志检测[J].白血病·淋巴瘤,2013,22(6):354-356].
[14]Pang RQ,He J,Li FB,et al.A simple method for isolation of human umbilical cord mesenchymal stem cell[J].Chin J Cell Stem Cell (Electronic Edition),2011,1(2):30-33.[庞荣清,何洁,李福兵,等.一种简单的人脐带间充质干细胞分离培养方法[J].中华细胞与干细胞杂志(电子版),2011,1(2):30-33].
[15]Chen LM,Xu RN,Lv S,et al.Role of human umbilical cord mesen⁃chymal stem cells in the regulation of activation and apoptosis of he⁃patic stellate cell[J].Med J Chin PLA,2014,39(1):11-14.[陈黎明,徐若男,吕飒,等.脐带间充质干细胞对肝星状细胞活化、凋亡的调控作用研究[J].解放军医学杂志,2014,39(1):11-14].doi:10.11855/j.issn.0577-7402.2014.01.03.
(2014-08-15收稿2014-09-20修回)
(本文编辑闫娟)
Optimization the methodology of isolating human ubilical cord mesenchymal stromal cells from Wharton's jelly and examination of their passage effect on immune phenotype using flow cytometry
HONG Jingxin1,LI Qian1,2,HAN Junling1,2△
1 Union Stem Cell&Gene Engineering Co.,Ltd.,Tianjin Cord Blood Bank,Tianjin 300384,China;2 Institute of Hematology,Blood Disease Hospital,Peking Union Medical College and Chinese Academy of Medical Sciences
△Corresponding Author E-mail:hanjl1@126.com
ObjectiveTo observe the effects of different collagenase digestions on isolating human umbilical cord mesenchymal stromal cells(MSC)from Wharton's jelly,to exam their differentiation ability and to investigate their passage effect on the immune phenotype.MethodsHuman umbilical cord samples were digested by collagenaseⅠorⅡorⅣfor 4-18 hours then were passed through sieves.Cells were collected by centrifugation then inoculated in DMEM/F12 medium at concentration within range of 4.8×103-1×104/cm2to compare the effect of different digestions on MSC.Von kossa staining and tetracycline fluorescence was used to label the osteogenic differentiation capacity of MSC.Also RT-PCR was employed to identify the differentiate capacity of MSC into myocardial-like cells.The immunophenotype of MSCs were detected by flow cytometry after subculture.ResultsUsing collagenaseⅠdigestion,the number of MSCs isolated from human umbilical cord in Wharton's jelly and their vitality were much higher while the period to show cell extension and primary culture time were shorter than those using collagenaseⅡorⅣdigestions.The analysis of surface marker revealed that the expression of positive markers include CD29,CD44,CD73,CD90 and CD105 did not change with passages while the negative markers such as CD31,CD34 and HLA-DR increased significantly with passages;Differential experiments induced in vitro show that human umbilical cord MSC in wharton's jelly had the ability to differentiate into osteoblasts and myocardial-like cells.Con⁃clusionThe human umbilical cord MSC in Wharton's jelly was successfully isolated by collagenaseⅠdigestion.This meth⁃od was simple with a high success rate while cell loss and damage were minimum.This makes large-scale cultivation possi⁃ble.Negative markers increased with cell passages.This phenomenon revealed that MSC showed directional differentiation.
umbilical cord;mesenchymal stem cells;collagenases;passage effect;Wharton's jelly
R394.2
ADOI:10.11958/j.issn.0253-9896.2015.02.008
1天津,协和干细胞基因工程有限公司(邮编300384);2中国医学科学院、北京协和医学院,血液学研究所,血液病医院
洪敬欣(1978),女,高级工程师,医学博士,主要从事干细胞及免疫细胞研究
△E-mail:hanjl1@126.com

