一维直孔道MOFs对CH4/N2和CO2/CH4的分离
张倬铭,杨江峰,陈杨,王勇,李立博,李晋平
(太原理工大学精细化工研究所,山西 太原 030024)
引 言
能源和环境问题是人类发展到现阶段遇到的巨大挑战,在面临全球环境污染和温室效应的危机之下,使用清洁的气体能源是全世界能源领域的发展战略和趋势。我国是一个以煤炭为能源主体的国家,面临着降低碳排放的巨大压力,因此倡导使用低碳气体能源是大势所趋。然而,我国常规天然气的产量不足,近年来的进口量达1000 亿立方米/年,因此开发新的气体能源作为天然气的补充极为重要[1-2]。煤层气和生物质燃气(主要指沼气)是具有巨大发展潜力的非常规天然气,我国的煤层气储量与常规天然气的储量相当,达到了36 万亿立方米;而生物质燃气的潜在年产量也有望超过1000 亿立方米,如果合理开发利用将和煤层气共同成为我国常规天然气的有效补充[3-4]。然而,我国煤层气普遍存在的低渗透性造成地面抽采极其困难,而井下抽采的煤层气中混入了大量空气,其中N2的含量达到了40%~60%[5]。厌氧发酵技术的不完善使得生物质燃气中CO2的含量达到了30%,降低了燃气的燃烧热值[6]。基于以上的分析,开发高效的CH4/N2和CO2/CH4的分离技术将是加快这两种非常规天然气开发的策略之一。
吸附分离技术以其操作灵活、投资低、见效快等优点,成为气体分离技术领域的优选。对比两组混合气体组合,CO2/CH4的组合分离要相对容易,源于CO2的分子动力学直径小,约为0.33 nm,其扩散能力较强;其次CO2本身极化率大于CH4,吸附剂表面表现出对CO2较强的吸附和较高的吸附热[7-8]。相对来说CH4/N2要难分很多,同时也是气体吸附分离中比较难分的一对组合。CH4和N2的分子动力学直径相近(0.38 nm 和0.36 nm),N2略小,扩散能力高于CH4;而CH4本身极化率高于N2,与吸附剂表面的吸附势能和吸附热普遍高于N2,这也是目前的吸附剂对CH4/N2的分离系数普遍较低的原因,因此开发高选择性分离CH4/N2混合物的吸附剂一直是热点课题[9-10]。
金属有机骨架(MOFs)材料是近年来发展迅速的一类新型多孔吸附剂,因其具有丰富且可以调变的孔型和表面,有望对CH4/N2这对难分的组合带来良好的契机[11-13]。本课题组在以往的研究中发现,小孔径的吸附剂对CH4的吸附选择性更强,同时对CH4/N2具有较高的吸附选择性[14],因此推测具有小分子气体直径级别的MOFs 材料同样会有很好的效果。
Cu(INA)2是一个具有一维菱形孔道的微孔MOFs 材料,由金属Cu 和短链有机配体4-羧酸吡啶连接而成,均一的菱形孔大小为0.6 nm×0.8 nm,说明小分子气体CO2、CH4和N2是可以被吸附并穿过材料的一维孔道(图 1)[15-16]。本研究选择Cu(INA)2作为研究对象,XRD 和TG 表征了所合成的样品,将样品压片造粒后,通过纯气体的吸附曲线计算了气体的吸附选择性,对比研究了该材料对CH4/N2和CO2/CH4两组气体混合物的分离性能。
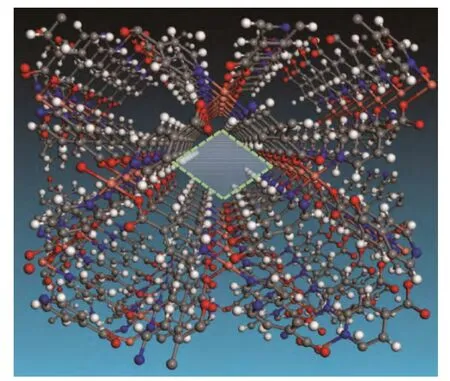
图1 Cu(INA)2 的结构示意图[15]Fig.1 Schematic of Cu(INA)2’s structure[15] (light red: Cu, red: O, blue: N, gray: C, white: H)
1 实验材料和方法
1.1 制备方法
Cu(INA)2的合成方法基于本课题组之前的工作[17],并做了相对放大的实验:用电子天平称取2.42 g 的三水硝酸铜(0.01 mol,阿拉丁试剂,AR)溶解于200 ml 的去离子水和乙醇(国药集团化学试剂,AR)的混合溶剂中(1:1),在上述溶液中加入2.46 g 的4-羧酸吡啶(异烟酸,0.02 mol, 阿拉丁试剂,AR),将混合物封闭在20 ml 的小瓶中,室温下超声15 min 之后转移到85℃ 烘箱反应30 h。得到的蓝色晶体用水和乙醇的混合溶剂(200 ml)清洗2 次(1:1),最后在室温下干燥。
1.2 样品表征
采用日本Rigaku Mini Flex Ⅱ型X 射线衍射仪进行测定,Cu 靶Kα射线,Ni 滤波,工作电压30 kV,电流15 mA,步长0.01°,扫描速率为4(°)·min-1,扫描范围2θ = 5°~40°。实验中样品的受热失重分析是在德国Netzsch STA449 F5 差热分析仪上进行的,其中升温速率5℃·min-1,在空气(氧气/氮气= 20%/80%)气氛下进行,流速为100 ml·min-1。
1.3 气体吸附测试
CO2、CH4和 N2吸附等温线的测定使用Intelligent Gravimetric Analyser(IGA001,英国海德重量法吸附仪)进行测试。在150℃下进行高真空抽气,活化时间为6 h,直到没有质量损失,缓慢降低到样品所需的吸附温度,真空下保持30 min,吸附等温线中每个测试点的压力稳定保持30 min 后开始记录数据。
1.4 混合气体穿透测试
本实验中所使用的装置及流程在本课题组以往论文中提到[18],混合气体穿透测试实验使用样品质量为4.93 g,材料需在3 MPa 压力下进行压片和粉碎造粒,筛分并选取 180~380 μm 的样品填充吸附柱,将吸附柱装入测试系统;测试前首先用高纯氦气(99.999%)吹扫吸附柱,使得吸附剂原位活化;关闭载气,打开原料气阀门,保持5~10 min待流量稳定后通入吸附柱;在出口端进行采气,通过气相色谱(岛津GC-2014C)进行气体组分分析;由采气时间和分析得到的气体组分含量,最终绘制出随时间变化气体的穿透曲线。
2 计算部分
2.1 模型
本工作中对材料的模拟均采用刚性结构模型。利用 X 射线衍射数据构建Cu(INA)2骨架模型。
2.2 力场参数
CH4和N2由TraPPE 力场描述,CO2由EPM2力场描述。MOF 材料的骨架原子采用Dreiding 力场参数,气体与材料之间的相互作用通过L-J 势能模型来描述,L-J 参数如表1 和表2 所示。其中σ和ε/kb分别表示分子间L-J 势能的尺寸和能量参数。
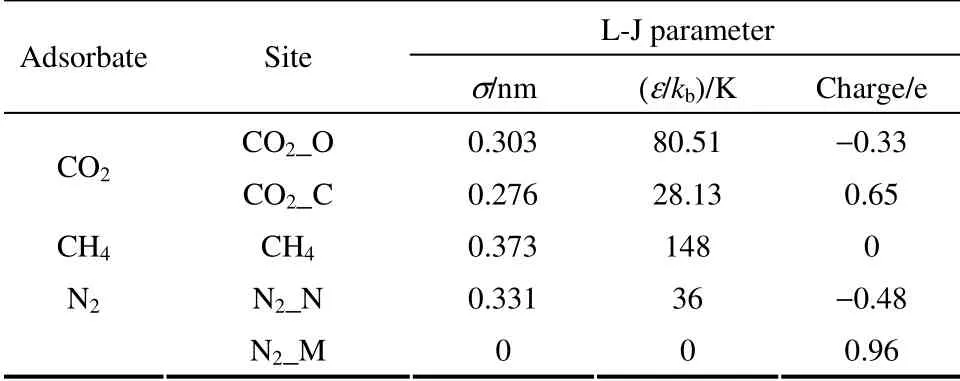
表1 气体的L-J 参数Table 1 L-J parameters of CO2, CH4 and N2
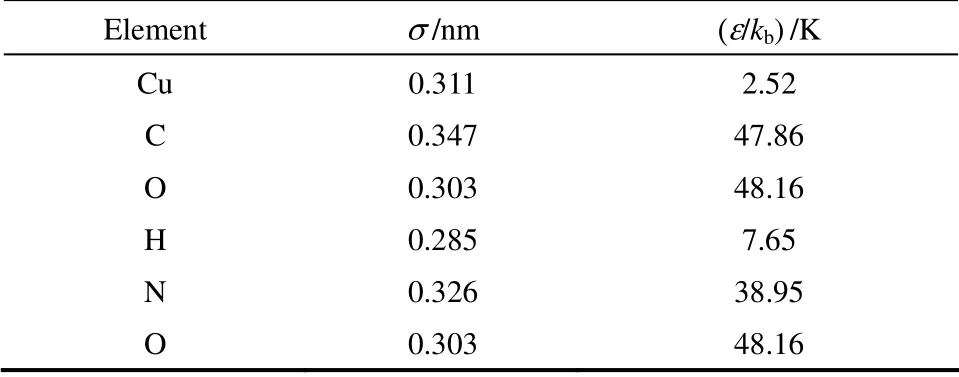
表2 材料骨架的L-J 参数Table 2 L-J parameters of structure
2.3 吸附模拟方法
利用北京化工大学仲崇立课题组[19]开发的巨正则系综蒙特卡罗模拟(GCMC)程序,研究Cu(INA)2对气体的吸附行为。模拟盒子选择6×2×3个单元晶胞。采用周期性边界条件,L-J 势能截断半径为 1.28 nm,长程静电作用力采用Ewald 加和技术,模拟步数为 1.20×108步,其中前6.00×107步用于使体系达到平衡,后6.00×107步用于抽样统计,用 Peng-Robinson 方程计算气体的逸度。
2.4 理想吸附溶液理论(IAST)
IAST 计算过程中涉及到的公式如下:
吸附曲线拟合朗格缪尔-弗里德里希吸附方程

式中,q 为吸附量,qsat为饱和吸附量,p 为压力,b 和v 为方程的系数。
吸附平衡选择性利用方程

式中,q1和q2分别为混合物各个组分的吸附分量,p1和p2为混合物的吸附分压。
3 结果与讨论
3.1 样品表征
从图2 的XRD 表征可以看出,合成样品与所报道的单晶衍射数据模拟图谱对比,衍射特征峰的位置和相对衍射强度与模拟图谱保持一致(10.7°,19.0°,21.6°和22.7°等),从而可以确定合成得到了所需的Cu(INA)2样品[15]。在经过3 MPa 的压力下挤压成片,然后破碎、筛分,经XRD 粉末衍射表征后发现衍射峰强度和位置没有受到任何收变,说明在经受过高压造粒后,样品的晶体结构不会收变,混合气体的分离实验不会因此而受影响。TG 图谱显示样品在300℃以前完全没有任何失重,之后才会迅速地坍塌失重,350℃后完全趋于平缓。这也说明在300℃以前或者室温下对材料进行操作不会造成任何的影响。

图2 样品Cu(INA)2 的XRD 谱图及模拟的标准谱图Fig.2 XRD of Cu(INA)2 under 3MPa pressure and simulated pattern
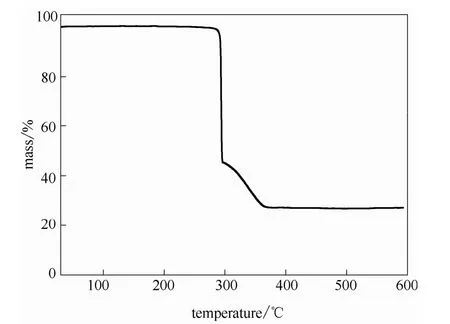
图3 样品Cu(INA)2 在空气气氛(O2/N2=20%/80%)加热速度为5℃·min-1 的热失重曲线Fig.3 Thermogravimetric curve of sample at heating rate of 5℃·min-1 with air flow (O2/N2=20%/80%)
3.2 气体吸附测试
经过高压造粒后的样品在150℃下进行真空活化,排除样品中的水分子和气体分子,冷却至室温进行气体吸附测试。图4 中列出了CO2、CH4和N2在0、15 和25℃下的吸附曲线,可以发现3 种气体在Cu(INA)2样品上表现出了很大吸附差异,CO2的吸附量最大,CH4次之,而N2几乎不被吸附。在25℃,一个大气压下(0.1 MPa)的CO2,CH4和N2的吸附量分别达到了34.4、14.8 和2.3 cm3·g-1,吸附量随着温度的降低逐渐增大,0℃时吸附量增至47.8、23.9 和3.4 cm3·g-1。
吸附热是判断吸附剂对气体吸附能力的判据之一,因此通过巨正则系综蒙特卡罗(GCMC)分子模拟计算了气体吸附的等温吸附热[19-20]。计算结果显示 Cu(INA)2对 CO2吸附热最高为 33.7 kJ·mol-1,但相比其他MOFs 材料,如Mg-MOF-74和Ni-MOF-74 的CO2吸附热要高很多,分别达到了47.2 和37.8 kJ·mol-1[21],说明Cu(INA)2对CO2的吸附能力不强,因此推断相对的选择吸附性也不会高。CH4的吸附热是一个相对比较高的数据达到29.6 kJ·mol-1,比M-MOF-74 高(Mg-MOF-74, 26.3 kJ·mol-1; Ni-MOF-74, 26.0 kJ·mol-1)[22]。N2的吸附量最低,其所对应的吸附热也最低为 22.5 kJ·mol-1。根据3 种气体的吸附热差异发现CH4和N2的差值为7.1 kJ·mol-1,大于CO2和CH4的差值4.1 kJ·mol-1,因此推断Cu(INA)2更利于CH4/N2的吸附分离。从图5 的GCMC 模拟的示意图可以得到,当CO2、CH4和N2在被吸附时,分子基本全部停留于Cu(INA)2一维的菱形孔道的中心位置,说明材料缺少吸附位点,完全靠气体自身性能停留于一维的直孔道中。这同时也是基本依靠吸附位点的CO2吸附所表现的吸附热相对较低,而依靠小孔吸附势能的CH4吸附的吸附热相对较高的原因。

图4 CO2、CH4 和N2 在0、15 和25℃下的吸附曲线Fig.4 Adsorption isotherms of CO2, CH4 and N2 at 0, 15 and 25℃
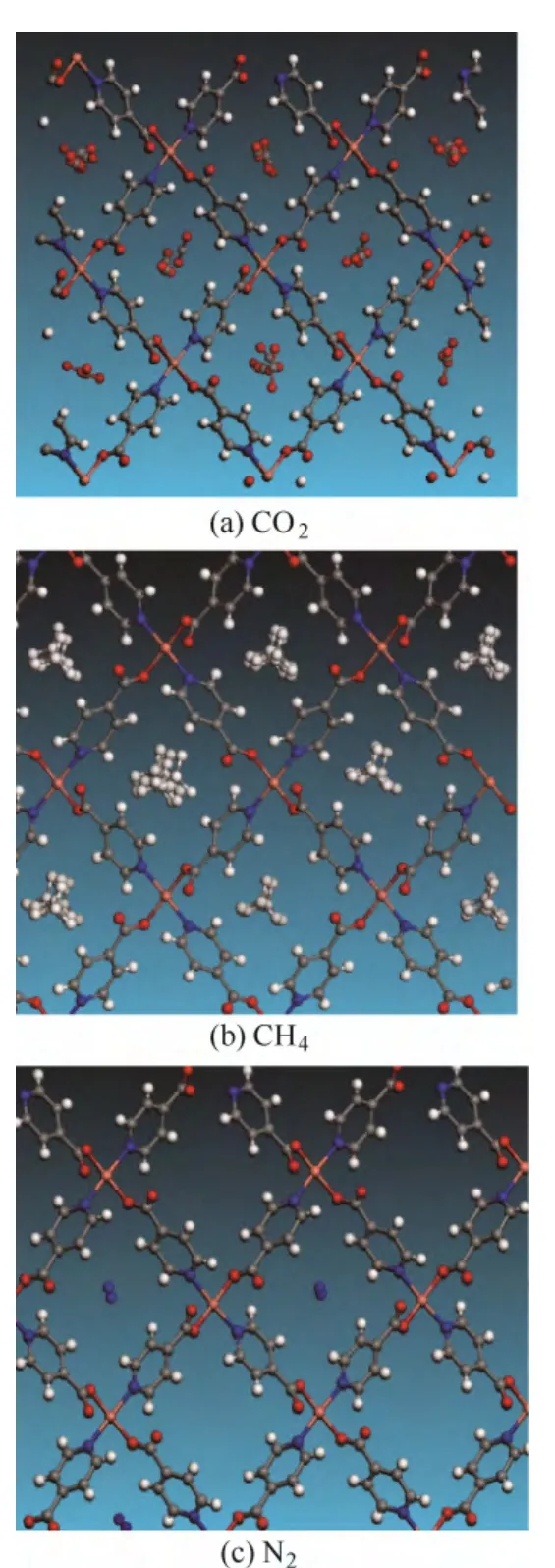
图5 GCMC 模拟结果显示的CO2、CH4 和N2 在 Cu(INA)2 一维孔道内的吸附状态Fig.5 Adsorption state of CO2, CH4 and N2 in 1 dimension pore of Cu(INA)2 by GCMC

图6 不同温度下(0~25℃)的Cu(INA)2 对CO2/CH4 和CH4/N2 的吸附选择性Fig.6 Adsorption selectivity of CO2/CH4 and CH4/N2 on Cu(INA)2 at different temperatures
基于纯气体的吸附曲线和等温吸附热,推测材料更有利于CH4/N2的吸附分离,但吸附选择性系数是判断气体吸附分离的更有利判据,因此利用IAST[23]理论计算了混合物CH4/N2(50%/50%)和CO2/CH4(50%/50%)的吸附选择性Si/j。图6 中列 出了不同温度下SCO2/CH4和SCH4/N2随着压力增加的数据,计算的结果印证了之前的推测,Cu(INA)2对CH4/N2的选择性系数要高于CO2/CH4,这一点完全与大多吸附剂所表现的CO2/CH4吸附选择性高于CH4/N2不同,而且数值随着温度降低而升高,从25℃时的SCH4/N2=8 到0℃超过SCH4/N2=10,不会随着压力的收变而收变,这是目前所报道的吸附剂中极少出现的(平衡吸附量见表3)[24]。

表3 混合气体中各组分的平衡吸附量Table 3 Equilibrium adsorption capacity of CO2, CH4 and N2 in gases mixtures/cm3·g-1
3.3 气体分离测试
基于Cu(INA)2对CH4/N2的高吸附选择性,做了CH4和N2二元混合气体(50%/50%)的穿透曲线,并与二元混合气体CO2和CH4(50%/50%)的穿透实验做了对比。如图7 所示,在气体流量20 ml·min-1时,CO2、CH4和N2在吸附柱内的穿透时间差异很大,而且穿透时间与吸附量成反比,即吸附量最低的N2在不到1 min 的时候首先穿透,其次是CH4在2 min 穿透,CO2在第3 min 穿透。
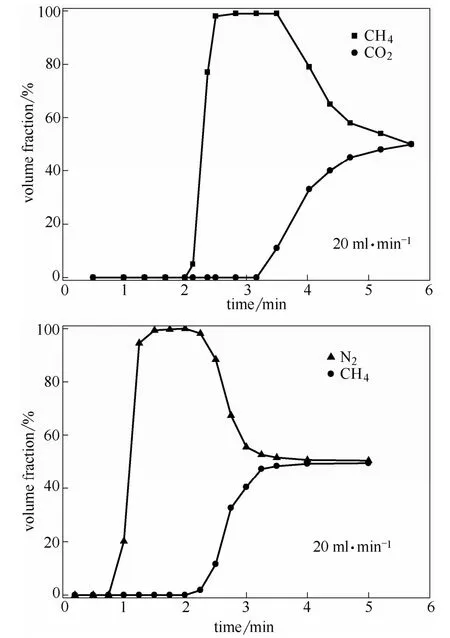
图7 25℃下Cu(INA)2 对CO2/CH4 (50%/50%)和CH4/N2 (50%/50%)二元混合物的穿透曲线Fig.7 Breakthrough caves of CO2/CH4 (50%/50%) and CH4/N2 (50%/50%) on Cu(INA)2 under 5℃
实验表明Cu(INA)2可以将CO2/CH4和CH4/N2的两两混合的气体分开,且中间的间隔时间十分相近,这一点和大多吸附剂对CO2/CH4分离间隔时间 长而CH4/N2的间隔时间短是不同的,再加上混合气体CH4/N2的总穿透时间更短,说明该材料对CH4/N2的分离性能是有相对优势的。另外,对比两组混合气体穿透曲线,CO2/CH4穿透曲线拖尾严重,即气体穿透不仅需要时间长,而且达到完全平衡需要的时间更长,这说明材料在分离CO2/CH4时是需要更多脱附时间的,即材料再生需要的时间较长,这在吸附分离技术中也是不占优势的。
4 结 论
本文测试并分析了具有一维孔道结构的MOFs材料Cu(INA)2对二元混合物CH4/N2(50%/50%)和CO2/CH4(50%/50%)的分离性能。首先,从纯气体CO2、CH4和N2的吸附曲线分析得出,Cu(INA)2对3 种气体都表现出了极大的吸附差异,从GCMC 计算得到的吸附热发现其对CH4吸附能力相对其他MOFs 材料高,达到29.6 kJ·mol-1;而CO2的吸附热要相对低一些33.7 kJ·mol-1,N2为22.5 kJ·mol-1,根据吸附热差异推测该材料更易于CH4/N2的吸附分离。通过IAST 理论计算得出的吸附选择性印证了这一推测,对CH4/N2的吸附选择性高于CO2/CH4的吸附选择性。混合气体的穿透曲线显示,对两组混合气体的穿透间隔时间是一样的,但CH4/N2混合物的总体穿透时间短,更有利于其分离;而CO2/CH4混合物不仅穿透时间长,而且穿透曲线有拖尾,平衡较慢,吸附剂再生时间也较长,不具优势。
致谢非常感谢荷兰阿姆斯特丹大学的Rajamani Krishna对本论文中吸附选择性Si/j的计算(图6)所做的贡献,感谢北京化工大学仲崇立教授课题组提供的GCMC 程序软件支持。
[1]Jia Chengzao (贾承造), Zhang Yongfeng (张永峰), Zhao Xia (赵霞).Prospects of and challenges to natural gas industry development in China [J].Natural Gas Industry (天然气工业), 2014, 34: 1-11.
[2]Guo Jiaofeng (郭焦锋).Accelerating gas energy development is China's chosen sustainable development strategy [J].International Petroleum Economics (国际石油经济), 2013, 12: 25-31.
[3]Feng Ming (冯明) , Chen Li (陈力), Xu Chengke (徐承科), Li Chunkai (李春凯).Coal bed methane resources and sustainable development in China [J].Resources Science (资源科学), 2007, 29: 100-104.
[4]Tian Yuanyu (田原宇), Qiao Yingyun (乔英云).Biomass gasification technology challenges and technical options [J].Sino-Global Energy (中外能源), 2013, 18: 27-32.
[5]Yang Jiangfeng (杨江峰), Zhao Qiang (赵强), Yu Qiuhong (于秋红), Dong Jinxiang (董晋湘), Li Jinping (李晋平).Progress of recoveryof coal bed methane and adsorption materials for separation of CH4/N2by pressure swing adsorption [J].Chemical Industry and Engineering Progress (化工进展), 2011, 30: 793-801.
[6]Hu Hui (胡辉), Zou Yanhui (邹妍晖), Zhang Haixu (张海旭), Cheng Hui (程晖), Li Fang (李芳).Capturing carbon dioxide in biomass gas by calcium-based sorbents [J].Chinese Journal of Environmental Engineering (环境工程学报), 2013, 7: 663-667.
[7]Li Jianrong, Kuppler R J, Zhou Hongcai.Selective gas adsorption and separation in metal–organic frameworks [J].Chemical Society Reviews, 2009, 38: 1477-1504.
[8]Chaemchuen S, Kabir N A, Zhou K, Verpoort F.Metal-organic frameworks for upgrading biogas via CO2adsorption to biogas green energy [J].Chemical Society Reviews, 2013, 42: 9304-9332.
[9]Ackley M W, Yang R T.Diffusion in ion-exchanged clinoptilolites [J].AIChE Journal, 1991, 37: 1645-1656.
[10]Ren X, Sun T, Hu J, Wang S.Synthesis optimization of the ultra-microporous [Ni3(HCOO)6]framework to improve its CH4/N2separation selectivity [J].RSC Advances, 2014, 4: 42326-42336.
[11]Li J R, Sculley J, Zhou H C.Metal-organic frameworks for separations [J].Chemical Reviews, 2011, 112: 869-932.
[12]Sumida K, Rogow D L, Mason J A, McDonald T M, Bloch E D, Herm Z R, et al.Carbon dioxide capture in metal-organic frameworks [J].Chemical Reviews, 2011, 112: 724-781.
[13]Li J R, Ma Y, McCarthy M C, Sculley J, Yu J, Jeong H K, et al.Carbon dioxide capture-related gas adsorption and separation in metal-organic frameworks [J].Coordination Chemistry Reviews, 2011, 255: 1791-1823.
[14]Yang J, Zhao Q, Xu H, Li L, Dong J, Li J.Adsorption of CO2, CH4, and N2on gas diameter grade ion-exchange small pore zeolites [J].Journal of Chemical & Engineering Data, 2012, 57: 3701-3709.
[15]Lu J Y, Babb A M.An extremely stable open-framework metal-organic polymer with expandable structure and selective adsorption capability [J].Chemical Communications, 2002, (13): 1340-1341.
[16]Wang P, Li G, Chen Y, Chen S, James S L, Yuan W.Mechanochemical interconversion between discrete complexes and coordination networks-formal hydration/dehydration by LAG [J].CrystEngComm., 2012, 14: 1994-1997.
[17]Chen Y, Li L, Yang J, Wang S, Li J.Reversible flexible structural changes in multidimensional MOFs by guest molecules (I2, NH3) and thermal stimulation [J].Journal of Solid State Chemistry, 2015, 226: 114-119.
[18]Yang J, Krishna R, Li J, Li J.Experiments and simulations on separating a CO2/CH4mixture using K-KFI at low and high pressures [J].Microporous and Mesoporous Materials, 2014, 184: 21-27.
[19]Tong M, Yang Q, Xiao Y, Zhong C.Revealing the structure-property relationships of covalent organic frameworks for CO2capture from postcombustion gas: a multi-scale computational study [J].Physical Chemistry Chemical Physics, 2014, 29: 189-198.
[20]Yang Q, Vaesen S, Vishnuvarthan M, Ragon F, Serre C, Vimont A, et al.Probing the adsorption performance of the hybrid porous MIL-68 (Al): a synergic combination of experimental and modelling tools [J].Journal of Materials Chemistry, 2012, 22: 10210-10220.
[21]Rana M K, Koh H S, Hwang J, Siegel D J.Comparing van der Waals density functionals for CO2adsorption in metal organic frameworks [J].The Journal of Physical Chemistry C, 2012, 116: 16957-16968.
[22]Rana M K, Koh H S, Zuberi H, Siegel D J.Methane storage in metal-substituted metal–organic frameworks: thermodynamics, usable capacity, and the impact of enhanced binding sites [J].The Journal of Physical Chemistry C, 2014, 118: 2929-2942.
[23]Myers A L, Prausnitz J M.Thermodynamics of mixed-gas adsorption [J].AIChE Journal, 1965, 11: 121-127.
[24]Li L, Yang J, Li J, Chen Y, Li J.Separation of CO2/CH4and CH4/N2mixtures by M/DOBDC: a detailed dynamic comparison with MIL-100(Cr) and activated carbon [J].Microporous and Mesoporous Materials, 2014, 198: 236-246.

