CH4-N2在MOFs结构材料中的吸附分离性能
胡江亮,孙天军,刘小伟,李德伏,赵生生,王树东
(1 中国科学院大连化学物理研究所洁净能源国家实验室,催化基础国家重点实验室,辽宁 大连 116023; 2 中国科学院大学,北京 100049)
引 言
能源短缺和环境污染是我国当前面临的两大焦点问题。甲烷(CH4)是当今国际公认的低碳洁净能源,其开发与洁净利用已成为解决我国能源供求矛盾、实现能源多样化、保持经济环境可持续发展的重大战略之一[1]。根据我国能源规划,到2020年天然气在一次能源消费中的比例拟提高到12%,相当于年消费量为4000 亿立方米,天然气资源缺口将达到1500 亿立方米,供需矛盾日益尖锐。除了常规天然气的持续开发,资源总量巨大的非常规天然气的开采利用将是有力补充。但在此类低浓度甲烷气提纯过程中,因N2分子与CH4的物理化学性质非常接近[2-3]而成为非常规甲烷气提纯/回收过程的关键共性技术难题,是当前我国天然气发展与节能减排战略所面临的最大技术障碍之一[4-6]。
变压吸附(PSA)是最有前景的CH4与N2分离技术之一。因此设计制备吸附剂,尽可能增大CH4与N2两者与吸附材料之间的作用力差异,是PSA 过程实现CH4-N2高效分离的关键。从微观角度探讨材料结构-吸附性能之间的关系,是CH4-N2吸附分离研究的热点内容。国内外众多的科研工作者,围绕CH4与N2的基本差异,针对众多传统吸附材料进行了系统的CH4-N2基础研究,具体包括各种活性炭(activated carbon,AC)[7],碳分子筛(carbon molecular sevievs,CMS)[8],各种传统A 型、X 型、Y 型与沸石类分子筛,以及新型分子筛SAPO-34、ETS-4 与DDR 等[9-12]。研究结果表明,活性炭、CMS、改性的斜发沸石、Sr-ETS-4 在CH4-N2的分离过程中均展现了各自独特的性能,但均未实现CH4与N2的高效分离,主要原因在于:(1)活性炭基吸附剂的孔道分布与表面官能团复杂多变且无法控制[6-8];(2)硅铝分子筛类材料高度极化的表面增强了CH4的优先吸附性,与其动力学优先选择N2的特性相抵触[6,10-12];(3)相互冲突的CH4、N2四偶极矩与极化率差异,致使金属离子(Li+、Na+、K+、Mg2+或Ca2+)交换与Si/Al 比调变很难实现筛分型吸附剂表面势场的定向调节[6,10,13-14];(4)速率型CMS 与筛分型Sr-ETS-4 吸附剂孔道太小(0.4 nm 左右),导致吸附剂易失活或效率大幅下降[8,15-16]。
理论上讲,在保证吸附剂微孔孔隙发达的同时,控制孔表面性质与分离窗口尺寸可以进一步强化CH4-N2的吸附分离效率[17-23]。但很显然,现有分子筛与活性炭材料的表面性质与分离窗口的调控优化技术已经不能满足要求,尤其是微观尺度上的超微孔道与表面性质调节效率低下。金属-有机框架材料(metal-organic frameworks,MOFs),不仅兼具活性炭与分子筛的优点,即大的吸附容量与特定网络尺寸,还具有表面结构与表面势能的优良可控性。从上述理论与实验研究经验可以推断[6,11,15],MOFs材料可为吸附材料的微观结构调控研究提供一个操作平台,有望成为进一步提高CH4-N2吸附分离效率的最佳材料之一。当前有许多研究工作通过吸附等温线测定对MOFs 材料的CH4-N2吸附分离选择性进行了预测[24-33],具体包括 Al-BDC[24-25]、[Cu(Me-4py-trz-ia)][24]、Cu-BTC[25]、MOF-5[26]、MOF-177[27]、ZIF[28]与[Cu(dhbc)2(bpy)][29]。从预测结果来看,MOFs 材料的分离性能差异较大,但还没有表现出所期待的优异分离性能。
总而言之,人们对CH4-N2吸附剂已经有了比较深刻的了解,并从不同的认知角度掌握了诸多吸附剂的CH4-N2分离特性。很多理论与实验研究可以确认孔径小于0.8 nm,低极性微孔材料具有CH4- N2分离优势[17-18,23],然而依然不能系统性地界定材料结构对材料性能的影响规律,尤其是新型MOFs材料结构强化CH4-N2吸附分离的机理不清楚。本文采用溶剂法大量合成几种典型的金属有机框架结构,对其结构进行表征,通过静态与动态相结合的方法确定其吸附分离性能,探讨材料结构与其性能的关系,以期为CH4/N2的吸附分离提供基础数据和科学依据。
1 实验方法与材料
1.1 材料与仪器
三水硝酸铜、十八水硫酸铝、六水硝酸镍、七水硫酸锌、对苯二甲酸(H2BDC)、均苯三甲酸(H3BTC)、2,5-二羟基对苯二甲酸、2-甲基咪唑(2-mIM)、甲酸与三乙烯二胺(dabco),含量大于98%,分析级,天津市光复精细化工研究所生产;乙醇、甲醇、N,N-二甲基甲酰胺(DMF)、丙酮、四氢呋喃(THF),分析级,天津市科密欧化学试剂有限公司;椰壳活性炭,河南神泰环保科技有限公司;5A 分子筛,SiO2/Al2O3≈2,国药集团化学试剂有限公司;SAPO-34,大连化学物理研究所提供;实验用水为去离子水。实验药品直接用于样品合成,未做任何纯化处理。
美国阿美特克AMETEK ProLine 过程质谱仪(process mass spectrometers),进气口温度60℃,灯丝电流2.7 A,电压5.8 V;使用荷兰帕纳科(PANalytical)公司X’Pert PRO 型X 射线衍射仪进行物相分析(Cu Kα靶,电压40 kV,电流40 mA);采用美国Quantachrome公司的Autosorb-iQ2型物理吸附仪进行吸附性能表征,N2为吸附气体;真空干燥箱与马弗炉,德国纳博热公司生产;自制聚四氟乙烯内衬高压釜进行材料合成;穿透测试装置为自制设备。
1.2 合成方法
Cu-BTC:将26.1 g 三水硝酸铜和12.6 g 均苯三甲酸分别溶于360 ml 去离子水和360 ml 乙醇中,混合后搅拌30 min 直到均匀,得到混合溶液。将混合溶液转移到带有聚四氟乙烯内衬的高压釜中密封紧密,置于110℃的烘箱中反应18 h,然后自然降温,过滤得到固体,分别用去离子水、乙醇洗涤数次,120℃过夜干燥,得到15.6 g 蓝绿色固体粉末Cu-BTC。
Al-BDC:将23.3 g 十八水硫酸铝和19.9 g 对苯二甲酸溶于300 ml DMF 中,然后转移到有聚四氟乙烯内衬的高压釜中,在130℃反应16 h。随后过滤固体,采用3×100 ml DMF 和100 ml 甲醇洗涤,并于真空干燥箱中200℃干燥16 h,然后将得到的样品在马弗炉中330℃处理72 h,最终获得15.7 g 白色粉末Al-BDC。
ZIF-8:将 57.5 g 七水硫酸锌和131.4 g 2-甲基咪唑分别溶于250 和830 ml 甲醇中,混合搅拌30 min 直到均匀,得到混合溶液。将混合溶液转移到带有聚四氟乙烯内衬的高压釜中密封紧密,置于100℃的烘箱中反应4 h。后续处理过程与Cu-BTC合成中的情况相同。
Ni-MOF-74:将19.7 g 六水硝酸镍和7.2 g 2,5-二羟基对苯二甲酸分别溶于150 ml H2O 和150 ml四氢呋喃中,混合后搅拌30 min 直到均匀,得到混合溶液。将混合溶液转移到带有聚四氟乙烯内衬的高压釜中密封紧密,置于130℃的烘箱中反应48 h。后续处理过程与Cu-BTC 合成中的情况相同。
[Ni2(BDC)2(dabco)]:将18.9 g 六水硝酸镍、10.8 g 对苯二甲酸和7.1 g 三乙烯二胺溶于650 ml DMF中搅拌30 min 直至均匀,得到混合溶液。将混合溶液转移到带有聚四氟乙烯内衬的高压釜中密封紧密,置于120℃的烘箱中反应48 h。后续处理过程与Cu-BTC 合成中的情况相同。
[Ni3(HCOO)6]:将28.4 g 硝酸镍和25 ml 甲酸溶于400 ml DMF 中,搅拌30 min 得到均匀混合溶液。将混合溶液转移到带有聚四氟乙烯内衬的高压釜中密封紧密,置于100℃的烘箱中反应12 h,然后自然降温。采用离心分离得到固体,分别用DMF(2×100 ml)、丙酮(2×50 ml)洗涤,在50℃真空干燥2 h,得到16.5 g浅绿色固体粉末[Ni3(HCOO)6]。
1.3 结构表征
采用美国 Quantachrome 公司生产的Autosorb-iQ2 型吸附仪测量77 K 温度下N2吸附等温线,并进行吸附剂比表面积和孔结构分析。在吸附测试之前,吸附剂需要在140℃下高真空脱气处理12 h,最后通过对N2吸附等温线的数据处理,得到吸附材料的比表面积、总孔容、微孔孔容和孔径分布。比表面积根据N2吸附等温线采用BET 方程计算,孔径分布采用非定域密度泛函理论(NLDFT)方法计算,微孔孔容采用D-R 方程计算,总孔容在p/p0=0.95 时获得。
采用PANalytical 公司生产的X’Pert PRO 型仪器进行XRD 分析。激发光源为Cu Kα射线(λ=0.1542 nm),管电压40 kV,管电流40 mA,扫描范围2θ=5°~60°,扫描速度5(°)·min-1,步长0.01°。
1.4 吸附与分离性能测试
1.4.1 静态法单组分吸附 CH4与N2的单组分吸附等温线在Quantachrome公司的Autosorb-iQ2型吸附仪上测定,压力范围为0~0.1 MPa,吸附温度为298 K,其中吸附温度由外置循环水浴精确控制,控制精度为0.01℃。
吸附等温线模型采用三参数Tóth 模型[30]:

式中,N 为气体吸附量,mmol·g-1;Nmax为拟合的最大吸附量,mmol·g-1;B 和c 均为拟合参数。
Tóth 相对于Langmuir 模型,引入了第3 个参数c,用来表征吸附系统的不均匀性[31]。
根据Tóth 模型得到的参数,通过方程(2)可计算气体吸附的亨利系数:
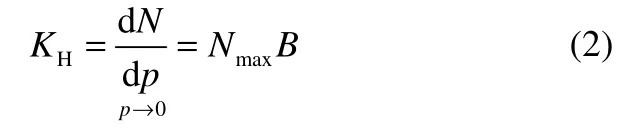
式中, KH是气体吸附的亨利系数,mmol·g-1·MPa-1。
理想选择性Si,j,通过组分i、j 的亨利系数之比得到:

1.4.2 动态法双组分穿透分离 CH4/N2双组分穿透分离测试采用自制的固定床实验装置进行。采用动态分离实验得到的吸附分离选择性又称分离因子,其定义是混合气体各组分在吸附相和气相的摩尔分率之比,即

式中,xi、xj分别为吸附相中组分i、j 的摩尔分数;yi、yj分别为气相中组分i、j 的摩尔分数;qi、qj分别为吸附剂上组分i、j 的吸附量。
由式(4)可知,各组分吸附相的吸附量测定是计算分离因子的关键。在整个实验过程中各组分的气相组成恒定已知,本实验通过动态法测定组分i 和j 的穿透曲线,根据物料守恒即可求得各组分的吸附量,从而得到平衡吸附分离因子[32]。吸附量的计算根据方程(5)计算:

式中,qi为i 组分在吸附剂上的吸附量;F 为通过床层的原料气的总流量;C(t)是i 组分的气相浓度;Ci,0是i 组分的初始气相浓度;tf是i 组分从床层的穿透时间;Vd为床层的死体积,由排水法测得;mads为吸附剂的质量。
为了验证动态法穿透分离装置的有效性,本文采用5A、SAPO-34 分子筛进行CH4/N2吸附分离实验,发现所测得的结果与文献报道值一致。
2 实验结果与讨论
2.1 表征结果
2.1.1 晶体结构表征 图1 给出了Cu-BTC、Al-BDC、ZIF-8、Ni-MOF-74、[Ni2(BDC)2(dabco)]、[Ni3(HCOO)6]等合成材料的实验XRD 谱图,与文献报道的XRD 衍射峰位置和相对强度均相吻合[33-41]。这表明本工作已成功合成出所需的MOFs 材料并且其具有很好的结晶度。
2.1.2 孔结构表征 如图 2 所示,Cu-BTC、Al-BDC、ZIF-8、Ni-MOF-74、[Ni2(BDC)2(dabco)]、[Ni3(HCOO)6]的N2吸附等温线均成Ⅰ型,表明几种骨架材料具有微孔结构。

图1 Cu-BTC、Al-BDC、ZIF-8、Ni-MOF-74、[Ni2(BDC)2(dabco)]与[Ni3(HCOO)6]的XRD 谱图Fig.1 XRD patterns of Cu-BTC, Al-BDC, ZIF-8, [Ni2(BDC)2(dabco)], [Ni3(HCOO)6 and Ni-MOF-74 samples

图2 不同MOFs 材料在77K 下N2 吸附等温线图Fig.2 N2 sorption isotherms at 77 K for all MOF samples investigatedNote: Filled and open symbols represent adsorption and desorption data, respectively.
对MOFs 材料的比表面积、总孔容、微孔孔容和孔径分布进行分析,具体参数见表1。由表可知,与传统的吸附材料相比,几种MOFs 都具有较高的比表面积和发达的微孔孔隙,使它们具备了成为良好吸附材料的条件。比较几种MOFs,可以发现采用单齿、多齿与多元不同配体构建的MOFs 具有明显的结构差异。具有笼腔结构的ZIF-8,其比表面积、总孔容、微孔孔容分别高达1882 m2·g-1、0.87 cm3·g-1和0.76 cm3·g-1。而孔道呈“之”字形的[Ni3(HCOO)6]的比表面积、总孔容和微孔孔容分别仅为322 m2·g-1、0.15 cm3·g-1和0.12 cm3·g-1。在没有穿插的情况下,配体的大小往往决定了骨架内孔道大小。因此,几种MOFs 由于配体大小和配位方式的不同,得到其孔径大小顺序为:Ni-MOF-74> Cu-BTC>Al-BDC≈ [Ni2(BDC)2(dabco)]>[Ni3(HCOO)6]>ZIF-8 。其 中 Cu-BTC 和[Ni2(BDC)2(dabco)]除了主孔道之外,NLDFT 计算也得到MOFs 骨架中连通孔的大小,分别为0.5 和 0.4 nm,与理论值接近。

表1 不同MOFs 的孔结构参数Table 1 Porosity data of all MOF samples based on N2 adsorption isotherms
2.2 单组分吸附
为了评估和预测几种MOFs 的吸附分离性能,本文在298K、0~0.1 MPa 条件下进行了CH4和N2的单组分吸附测试,并采用Tóth 模型对CH4、N2的吸附等温线进行了模拟。Tóth 模型可以很好地吻合所测得的吸附等温线,相关模拟参数见表2。通过测定CH4和N2分别在Cu-BTC 上的吸附等温线来考察其对CH4、N2的吸附能力。如图3 所示,Cu-BTC 对CH4的吸附量大于N2的吸附量,表现出对CH4的选择性吸附。主要是因为CH4的极化率高于N2的极化率(CH4:26×10-25cm-3;N2:17.6×10-25cm-3),从而使得CH4分子在Cu-BTC 孔道内表面的极性势场内更容易极化,进而产生更强的吸附作用。从表2 可以看出,CH4的亨利系数均大于N2的亨利系数,说明Cu-BTC 骨架材料对CH4的吸附作用力大于对N2的吸附作用力。同时,Cu-BTC 具有暴露的金属极性位点使其对具有更高四极矩的N2分子产生了一定的四极子作用力,这种作用力在一定程度上抑制了其CH4/N2的选择性吸附分离能力。如图3,在298 K、0.1 MPa 下,Cu-BTC 对CH4和N2的吸附量分别为0.79 和0.24 mmol·g-1。Cu-BTC 骨架材料的CH4/N2理想选择性S(CH4/N2)为4.1,该选择性优于传统吸附剂如活性炭的分离性能,但并没有较大提升。一方面是由于Cu-BTC 骨架中存在极性吸附位点对N2的吸附量增加从而导致其选择性下降;另一方面,该骨架材料的主孔道为0.82 nm,相对较大,也进一步造成了CH4/N2分离选择性下降。
Al-BDC 对CH4的吸附量大于N2的吸附量,表现出对CH4的选择性吸附,如图3 所示。在298 K、0.1 MPa 下,Al-BDC 对CH4和N2的吸附量分别为0.44 和0.13 mmol·g-1。从表2 可以看出,CH4的亨利系数均大于N2的亨利系数,说明Al-BDC 骨架材料对CH4的吸附作用力大于对N2的吸附作用力。通过亨利系数之比可计算得到Al-BDC 骨架材料的CH4/N2理想选择性,S(CH4/N2)为3.5(见表2),其CH4/N2理想选择性,与报道值(S=3.4~4.4)接近[24]。Al-BDC 与Cu-BTC 的孔径尺寸相近,但Al-BDC 骨架结构中没有暴露的金属位点,其骨架整体极性低,对CH4、N2的吸附量都明显小于Cu-BTC。此外,由于Al-BDC 存在一些颗粒堆积产生介孔分布,这对CH4/N2的分离不利。
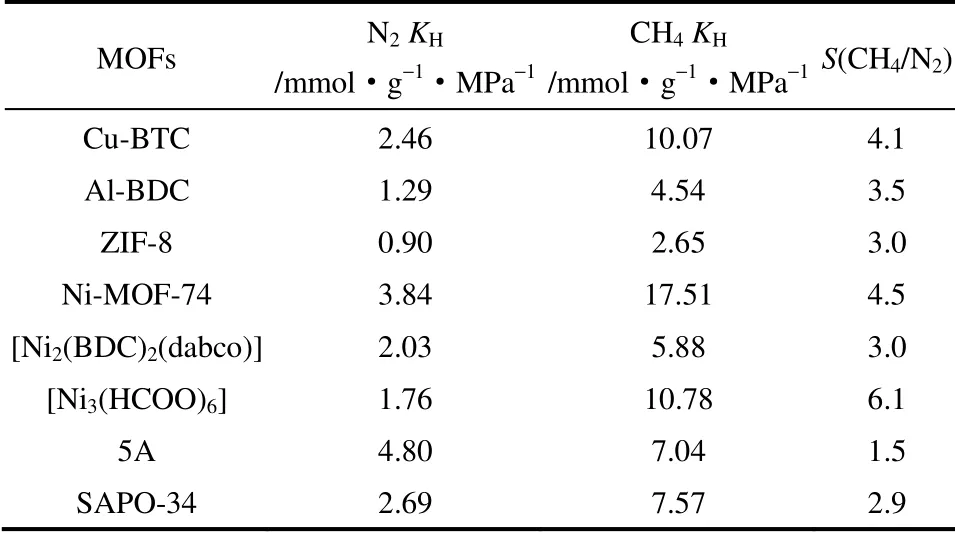
表2 298 K 时, 采用Tóth 模型拟合的CH4 和N2 在不同MOFs 上的亨利系数及其理想选择性Table 2 Henry’s law constants and ideal selectivities of different MOFs for CH4 and N2 adsorption modelling by Tóth model at 298 K
如图3 所示,ZIF-8 对CH4的吸附量也大于N2的吸附量,在298 K、0.1 MPa 下,ZIF-8 对CH4和N2的吸附量分别为0.28 和0.10 mmol·g-1。从表2可以看出,CH4的亨利系数均大于N2的亨利系数,说明ZIF-8 骨架材料对CH4的吸附作用力大于对N2的吸附作用力。ZIF-8 骨架材料的CH4/N2理想选择性S(CH4/N2)为3.0,分离能力与活性炭相当。对CH4和N2的吸附能力远低于Cu-BTC,这是由于ZIF-8骨架表面的弱极性与较大尺寸的笼结构(1.06 nm)所致。
Ni-MOF-74 在298 K、0.1 MPa 下,对CH4和N2的吸附量分别为1.12 和0.32 mmol·g-1。从表2可以看出,CH4的亨利系数大于N2的亨利系数,说明Ni-MOF-74 骨架材料对CH4的吸附作用力大于
对N2的吸附作用力。在几种MOFs 中,Ni-MOF-74具有较大的孔径尺寸,且比表面较低,但却具有最大的气体吸附量。这是因为Ni-MOF-74 骨架中包含有极高比例的开放金属位,为气体提供了大量的吸附位点,增强了气体的吸附能力,表2 中CH4和N2较大的亨利系数也证明了这一点。但与Cu-BTC一样,极性金属位点的存在也会导致N2吸附量的增加,不利于选择性的提高,所以Ni-MOF-74 的CH4/N2理想选择性只有4.5。

图3 298 K 时,CH4 或N2 在不同MOFs、5A 与SAPO-34 分子筛上的吸附等温线及Tóth 模拟Fig.3 Pure gas adsorption isotherms for CH4 and N2 at 298 K on MOFs, 5A and SAPO-34
[Ni2(BDC)2(dabco)]材料在298 K、0.1 MPa 下,对 CH4和 N2的吸附量分别为 0.61 和 0.22 mmol·g-1,如图3 与表2 所示。[Ni2(BDC)2(dabco)]比表面积高达1700 m2·g-1,但由于内表面极性低且孔径较大,导致其气体吸附量并不高。其骨架性质与Al-BDC 相似,在这类材料中比表面积与吸附量成正比。[Ni2(BDC)2(dabco)]骨架材料的CH4/N2理想选择性S(CH4/N2)≈3.0,选择性与活性炭的相当,因此调控孔道的尺寸和内表面极性并提高比表面积是制备优良吸附分离CH4/N2吸附剂的关键。
在298 K、0.1 MPa 下,[Ni3(HCOO)6]对CH4和N2的吸附量分别为0.82 和0.17 mmol·g-1,如图3 所示。从CH4与N2吸附量的较大差异可知,CH4与MOFs 孔道内表面存在强的相互作用。[Ni3(HCOO)6]对CH4的亲和力大于对N2的,这可以从以下两个方面进行解释。首先是[Ni3(HCOO)6]骨架材料具有的小于0.7 nm 的超微孔对小分子气体(CH4和N2)的特异性吸附作用引起的[31]。另一个方面是CH4的极化率高于N2的极化率,从而使得CH4分子在吸附剂表面的极性势场内更容易极化,进而产生更强的吸附作用。虽然N2分子具有更高的四极矩,会产生一定的四极子作用力,但是在该类材料中四极子作用力应该明显弱于极化率产生的作用力。这两种气体分子与吸附剂之间的吸附势由极化率所主导的,因此[Ni3(HCOO)6]骨架材料对CH4的吸附势大于对N2的吸附势。从表2 中列举的CH4、N2的亨利系数也可以看出,在[Ni3(HCOO)6]上CH4的亨利系数远大于N2的亨利系数,进一步表明[Ni3(HCOO)6]骨架材料对CH4的吸附作用力大于对N2的吸附作用力。[Ni3(HCOO)6]的CH4/N2理想选择性S(CH4/N2)为6.1,是目前报道的在多孔材料上CH4/N2吸附分离选择性最高的数值之一,是可用于天然气脱氮的潜在吸附剂。
作为对比,吸附剂5A 和SAPO-34 分子筛对CH4、N2的吸附能力亦通过测定CH4和N2的吸附等温线来考察。如图3 所示,两种分子筛对CH4的吸附量均大于N2的吸附量,均表现出对CH4的选择性吸附。在298 K、0.1 MPa 下,5A 分子筛对CH4和N2的吸附量分别为0.61 和0.39 mmol·g-1;SAPO-34 对CH4和N2的吸附量分别为0.64 和0.25 mmol·g-1。通过比较发现,分子筛对N2的吸附量大于除Ni-MOF-74 外的几种多齿配体MOFs 材料。这是由于分子筛骨架中存在极强的电场梯度,导致其与存在四极矩的N2分子产生四极子作用力,使其N2吸附量增大,进一步导致分子筛对CH4/N2的分离选择性下降。通过计算可知,尽管5A、SAPO-34分子筛与[Ni3(HCOO)6]的孔径接近,但是5A 和SAPO-34 分子筛的 CH4/N2平均理想选择性(S(CH4/N2)<3.0)远低于[Ni3(HCOO)6]框架材料的选择性。
2.3 双组分穿透
采用CH4-N2双组分穿透分离实验来进一步探讨MOFs 材料结构对其吸附分离性能的影响规律。CH4/N2的动态吸附分离能力测试温度为298 K,压力范围为0.1~1.0 MPa。作为对比,5A 分子筛、SAPO-34 也进行了双组分穿透分离实验。各种材料的吸附选择性见表3,各种材料在298 K、0.4 MPa的典型穿透曲线见图4,通过测得的穿透分离曲线,计算得到材料的CH4/N2分离因子α(CH4/N2)。
由图4 可知,所有材料在穿透实验的前期,CH4与N2都被吸附剂吸附,出口未检测到CH4或者N2。随着吸附的进行,N2吸附达到饱和,首先从吸附床中穿透,逐渐达到进料浓度。然后CH4吸附饱和,穿透床层。这表明所有材料对甲烷的作用力均大于氮气,与单组分吸附实验的结果是相吻合的。除Al-BDC 与ZIF-8 外,N2的穿透曲线均出现较大的卷积效应(roll-up),出口浓度大于进料浓度。这是由于N2的吸附弱于CH4,在CH4穿透的瞬间,二者的竞争吸附导致吸附的N2部分脱附,从而使得其浓度高于进料浓度[34]。穿透曲线呈现陡峭的穿透前沿和卷积峰,因此可知CH4/N2的分离机理被归为热力学分离。另外,卷积效应的大小也能在一定程度反映吸附分离性能的优劣,对比图4 中的穿透曲可知,[Ni3(HCOO)6]的N2的卷积效应明显大于其他材料的卷积效应,测试结果亦显示其吸附分离性能优于其他吸附剂。
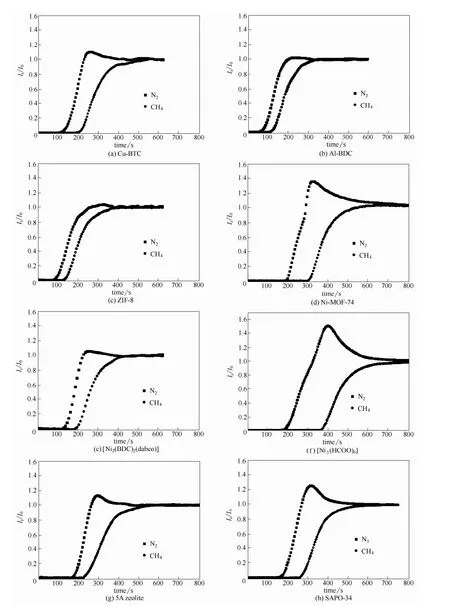
图4 在298 K、0.4 MPa 条件下,等摩尔比CH4-N2 混合气在不同吸附剂上的穿透曲线Fig.4 Breakthrough curves of CH4-N2 equimolar mixture at 298 K and 0.4 MPa on different adsorbents
由计算结果看(见表3),在298 K、0.1~1.0 MPa条件下,[Ni3(HCOO)6]的CH4/N2分离因子为6.0~7.0,与通过单组分气体吸附得到的理想选择性相吻合。同时在本实验条件下测得的Al-BDC 的CH4/N2分离因子为3.5~3.8,与文献报道的其商品化样品Basolite® A100 的3.4~4.4 的分离因子接近[24];而Cu-BTC 的分离因子为3.2~4.0,与文献报道值3.0 ~3.5 相 近[22]。ZIF-8 、 Ni-MOF-74 与[Ni2(BDC)2(dabco)]的分离因子分别为2.8~3.3、3.4~3.9 与3.0~3.4,与其单组分实验结果基本接近。两种分子筛5A 和SAPO-34 具有的CH4/N2分离因子分别为2.0~2.2、2.6~3.0,同单组分实验结果对应,也很好地吻合了文献报道的选择性[43-44]。从文献结果可知,活性炭、H-ZSM-5、菱沸石、13X等分子筛的甲烷氮气分离选择性都低于4。总之,与已有的甲烷氮气吸附剂相比,[Ni3(HCOO)6]表现出优异的CH4/N2分离选择性,达到分子筛类吸附剂的2 倍,也远高于活性炭类材料,初步具备工业应用前景。
表3 所示为不同结构多孔材料的CH4/N2分离选择性,主要包括活性炭、分子筛和金属有机骨架材料3 类。很显然,普通活性炭的分离因子小于4;而分子筛的选择性一般小于3.0。本项研究的大部分材料性能与优质活性炭(分离因子3.5 左右)相似,优于分子筛,其中[Ni3(HCOO)6]的分离性能最佳,分离因子高达7.0。
通过这些多孔材料的结构及性能可以发现,活性炭是非极性或弱极性吸附剂,且孔道复杂、孔径分布过宽,导致其对CH4/N2的分离选择性低,同时活性炭均一微孔孔道不易控制,为提高吸附分离性能带来困难。而分子筛为强极性吸附剂,其结构特点是表面具有暴露的带有负电荷的阴离子氧和孤立的阳离子,从而使其骨架内具有极强的电场,对具有高极化率的CH4分子吸附的同时,对具有较高四极矩的N2分子也有较强的极化作用,从而限制了分子筛的CH4/N2选择性。相对Si/Al 分子筛而言,Al-BDC、[Ni2(BDC)2(dabco)]框架的极性较弱,但是其配体相对较长,导致孔径较大,从而降低了CH4/N2的分离性能。ZIF-8 的极性相对也较弱,但其孔道尺寸大大限制了其应用。Cu-BTC 与Ni-MOF-74 存在暴露的Cu2+与Ni2+吸附位点,使其表面具有更加复杂的吸附势场,也会对其CH4/N2分离性能带来一定影响。对于单齿配体的甲酸盐[Ni3(HCOO)6],其骨架结构中多重的金属配位方式和孔道内的两性亲和使其具有优异的电子传输能力和特殊的极性势场;同时0.4~0.5 nm 的超微孔孔道内壁会对气体分子产生叠加的吸附势场,有利于CH4/N2的分离,具有较高的吸附分离选择性。
3 结 论
(1)采用溶剂热方法,以对苯二甲酸、均苯三甲酸、2-甲基咪唑、三乙烯二胺、甲酸为配体大量合成了6 种典型结构的纳米孔MOFs 材料,采用静态与动态吸附相结合的实验手段测定了不同结构MOFs 材料的CH4/N2吸附分离性能。
(2)多齿配位的纳米孔MOFs 材料,甲烷氮气分离选择性介于3~4 之间,明显高于Si/Al 分子筛材料,与活性炭相当,主要源于MOFs 没有类似Si/Al 分子筛的强大孔道极性;但是,多齿配体MOFs材料因其配体较长,导致孔道较宽,从而限制了其选择性的进一步提高;同时,MOFs 骨架中的开放金属位可能会增大孔道极性,也不利于其分离性能的提高。
(3)单齿甲酸配体构建的超微孔[Ni3(HCOO)6]框架具有非常优异的CH4/N2分离性能,其孔径约为0.5 nm,分离选择性高于6,是传统Si/Al 分子筛与活性炭的2 倍,极具应用价值。
[1]Hevia M A G, Fissore D, Ordonez S, Diez F V, Barresi A A.Combustion of medium concentration CH4-air mixture in non-stationary reactors [J].Chem.Eng.J., 2007, 131(1/3): 343-349.
[2]Johnson Ⅲ R D.NIST Computational chemistry comparison and benchmark database, NIST standard reference database [DB].[2013-08-16].http://cccbdb.nist.gov/.
[3]Perry R H, Green D W.Perry’s Chemical Engineers’ Handbook [M].New York: McGraw-Hill, 1999.
[4]David C B, John L B, Arash A.Nitrogen removal from natural gas: phase Ⅱ [M].Washington, DC: U.S.Department of Energy, 1999.
[5]Simone C, Carlos A G, Alirio E R.Separation of CH4/CO2/N2mixtures by layered pressure swing adsorption for upgrade of natural gas [J].Chem.Eng.Sci., 2006, 61(12): 3893-3906.
[6]Tagliabue M, Farrusseng D, Valencia S, Aguado S, Ravon U, Rizzo C, Corma A, Mirodatos C.Natural gas treating by selective adsorption: material science and chemical engineering interplay [J].Chem.Eng.J., 2009, 155(3): 553-566.
[7]Zhou Li, Guo Wencai, Zhou Yaping.A feasibility study of separating CH4/N2by adsorption [J].Chinese J.Chem.Eng., 2002, 10(5): 558-561.
[8]Balys M R, Buczek B.Comparison mixture of separation of methane-nitrogen on a carbon molecular sieve and on a natural zeolite [J].Przem.Chem., 2008, 87(2): 98-101.
[9]Simone C, Carlos A G, Alirio E R.Adsorption equilibrium of methane, carbon dioxide and nitrogen on zeolite 13X at high pressures [J].J.Chem.Eng.Data, 2004, 49(4): 1095- 1101.
[10]Jayaraman A, Yang R T, Chinn D, Munson C L.Tailored clinoptilolites for nitrogen/methane separation [J].Ind.Eng.Chem.Res., 2005, 44(14): 5184-5192.
[11]Steven M K, Valerie A B.A titanosilicate molecular sieve with adjustable pores for size-selective adsorption of molecules [J].Nature, 2001, 412: 720-722.
[12]Krisha R, Baten J M.Influence of segregated adsorption on mixture diffusion in DDR zeolite [J].Chem.Phys.Lett., 2007, 446(4): 344-349.
[13]Yang Jiangfeng, Zhao Qiang, Xu Hong, Li Libo, Dong Jinxiang, Li Jinping.Adsorption of CO2, CH4and N2on gas diameter grade ion- exchange small pore zeolites [J].J.Chem.Eng.Data, 2012, 57(12): 3701-3709.
[14]Yang Jiangfeng, Li Junmin, Wang Wei, Li Libo, Li Jinping .Adsorption of CO2, CH4and N2on 8-, 10- and 12-membered ring hydrophobic microporous high-silica zeolites: DDR, Silicalite-1 and Beta [J].Ind.Eng.Chem.Res., 2013, 52 (50): 17856-17864.
[15]Ruthven D M.Molecular sieve separations [J].Chem.Ing.Tech., 2011, 83(1/2): 44-52.
[16]Grande C A.Carbon molecular sieves for hydrocarbon separations by adsorption [J].Ind.Eng.Chem.Res., 2005, 44(18): 7218-7222.
[17]Kluson P, Scaife S, Quirke N.The design of microporous graphitic adsorbents for selective separation of gases [J].Sep.Purif.Technol., 2000, 20(1): 15-24.
[18]Zhao Guofeng, Bai Peng, Zhu Hongmei, Yan Rixiong, Liu Xinmei, Yan Zifeng.The modification of activated carbons and the pore structure effect on enrichment of coal-bed methane [J].Asia-Pac.J.Chem.Eng., 2008, 3(3): 284-291.
[19]Wang Yuxin(王玉新), Liu Congmin(刘聪敏), Zhou Yaping(周亚平).Preparation of mesopore-enriched bamboo activated and its adsorptive applications study [J].Journal of Functional Materials(功能材料), 2008, 39(3): 420-423.
[20]Zhou Jing(周静), Bai Renliu(柏任流), Zheng Kaibo(郑开波).Effect of pore structure of activated carbon on selectivie adsorption of coal-bed methane [J].Petrochemical Technology(石油化工), 2013, 42(7): 749- 754.
[21]Su Yanmin(苏艳敏), Xu Shaoping(徐绍平), Wang Jifeng(王吉峰), Liu Wanzhu(刘万祝), Xiao Ronglin(肖荣林), Ouyang Shaobo(欧阳少波).Influence of micropore structure of activated carbons on their selective adsorption of CH4from CH4/N2mixture [J].Natural Gas Industry(天然气工业), 2013, 33(3): 89-94.
[22]Liu Bei, Smit B.Comparative molecular simulation study of CO2/N2and CH4/N2separation in zeolites and metal organic frameworks [J].Langmuir, 2009, 25(10): 5918- 5926.
[23]Krishna R, Baten J M.Comment on comparative molecular simulation study of CO2/N2and CH4/N2separation in zeolites and metal organic frameworks [J].Langmuir, 2010, 26(4): 2975-2978.
[24]Möllmer J, Lange M, Möller A, Patzschke C, Stein K, Lassig D, Lincke J, Glaser R, Krautscheid H, Staudt R.Pure and mixed gas adsorption of CH4and N2on the metal-organic framework Basolite A100 and a novel copper-based 1,2,4-triazolyl isophthalate MOF [J].J.Mater.Chem., 2012, 22(20): 10274-10286.
[25]Rallapalli P, Prasanth K P, Patil D, Somani R S, Jasra R V, Bajaj H C.Sorption studies of CO2, CH4, N2, CO, O2and Ar on nanoporous aluminum terephthalate [MIL-53(Al)][J].J.Porous Mater., 2010, 18(2): 205-210.
[26]Wang Qingmin, Shen Dongmin, Bülow M, Lau M L, Deng Shuguang, Fitch F R, Lemcoff N O, Semanscin J.Metallo-organic molecular sieve for gas separation and purification [J].Micropor.Mesopor.Mat., 2002, 55(2): 217-230.
[27]Saha D, Bao Zongbi, Jia Feng, Deng Shuguang.Adsorption of CO2, CH4, N2O, and N2on MOF-5, MOF-177, and zeolite 5A [J].Environ.Sci.Technol., 2010, 44(5): 1820-1826.
[28]Pérez-Pellitero J, Amrouche H, Siperstein F R, Pirngruber G, Nieto-Drahi C, Chaplais G, Simon-Massenron A, Bazer-Bachi D, Peralta D, Bats N.Adsorption of CO2, CH4, and N2on zeolitic imidazolate frameworks: experiments and simulations [J].Chem.Eur.J., 2010, 16 (5): 1560-1571.
[29]Yang Jiangfeng, Yu Qiuhong, Zhao Qiang, Liang Jianming, Dong Jinxiang, Li Jinping.Adsorption CO2, CH4and N2on two different spacing flexible layer MOFs[J].Micropor.Mesopor.Mat., 2012, 161: 154-159.
[30]Tóth J.Thermodynamical model and prediction of gas/solid adsorption isotherms [J].J.Colloid Interface Sci., 2004, 275(1): 2-8.
[31]Do D D.Adsorption Analysis: Equilibria and Kinetics [M].London: Imperial College Press, 1998.
[32]Peralta D, Chaplais G, Simon-Masseron A, Barthelet K, Chizallet C, Quoineaud A-A, Pirngruber G D.Comparison of the behavior of metal-organic frameworks and zeolites for hydrocarbon separations [J].J.Am.Chem.Soc., 2012, 134(19): 8115-8126.
[33]Chui S S.A chemically functionalizable nanoporous material [Cu3(TMA)2(H2O)3]n[J].Science, 1999, 283 (5405): 1148-1150.
[34]Hamon L, Jolimaitre E, Pirngruber G D.CO2and CH4separation by adsorption using Cu-BTC metal-organic framework [J].Ind.Eng.Chem.Res., 2010, 49(16): 7497-7503.
[35]Ye Jingyun, Liu Changjun.Cu3(BTC)2: CO oxidation over MOF based catalysts [J].Chem.Commun., 2011, 47(7): 2167- 2169.
[36]Loiseau T, Serre C, Huguenard C, Fink G, Taulelle F, Henry M, Bataille T, Férey G.A rationale for the large breathing of the porous aluminum terephthalate (MIL-53) upon hydration [J].Chem.Eur.J., 2004, 10(6): 1373-1382.
[37]Park K S, Ni Z, Cote A P, Choi J Y, Huang Rudan, Uribe-Romo F J, Chae H K, O'Keeffe M, Yaghi O M.Exceptional chemical and thermal stability of zeolitic imidazolate frameworks [J].Proceedings of the National Academy of Sciences, 2006, 103(27): 10186-10191.
[38]Dietzel P D C, Georgiev P A, Eckert J, Blom R, Strassle T, Unruh T.Interaction of hydrogen with accessible metal sites in the metal-organic frameworks M2(dhtp) (CPO-27-M; M = Ni, Co, Mg) [J].Chem.Commun., 2010, 46(27): 4962-4964.
[39]Dietzel P D C, Panella B, Hirscher M, Blom R, Fjellvag H.Hydrogen adsorption in a nickel based coordination polymer with open metal sites in the cylindrical cavities of the desolvated framework [J].Chem.Commun., 2006, (9): 959-961.
[40]Liang Zhijian, Marshall M, Chaffee A L.CO2adsorption, selectivity and water tolerance of pillared-layer metal organic frameworks [J].Micropor.Mesopor.Mat., 2010, 132(3): 305-310.
[41]Wang Zheming, Zhang Bin, Zhang Yanjuan, Kurmoo M, Liu Tao, Gao Song, Kobayashi H.A family of porous magnets, [M3(HCOO)6](M=Mn, Fe, Co and Ni) [J].Polyhedron, 2007, 26(9/11): 2207-2215.
[42]Ackley M W , Yang R T.Adsorption characteristics of high-exchange clinopti1olites [J].Ind.Eng.Chem.Res., 1991, 30(12): 2523-2530.
[43]Sircar S, Golden T C.Purification of hydrogen by pressure swing adsorption [J].Sep.Sci.Techn., 2000, 35(5): 667-687.
[44]Rivera-Ramos M E, Hernández-Maldonado A J.Adsorption of N2and CH4by ion-exchanged silicoaluminophosphate nanoporous sorbents: interaction with monovalent, divalent and trivalent cations [J].Ind.Eng.Chem.Res., 2007, 46(14): 4991-5002.

