痛风性关节炎湿热蕴结证大鼠模型建立的研究
尹明,向黎黎,熊辉*,曲良烨,齐新宇,周彪(.湖南中医药大学,湖南长沙4008;.湖南中医药大学第二附属医院,湖南长沙40005;.张仲景国医院,河南南阳47000)
·基础研究·
痛风性关节炎湿热蕴结证大鼠模型建立的研究
尹明1,向黎黎1,熊辉2*,曲良烨3,齐新宇1,周彪1
(1.湖南中医药大学,湖南长沙410208;2.湖南中医药大学第二附属医院,湖南长沙410005;3.张仲景国医院,河南南阳473000)
目的探究建立痛风性关节炎湿热蕴结证大鼠模型的方法。方法选用健康成年SD雄性大鼠40只,按随机法将大鼠分为4组:正常对照组(A组),痛风组(B组),湿热组(C组),痛风加湿热模型组(D组),每组10只。各组经不同的处理或造模后,观察大鼠的一般状态,用Bradford法检测大鼠尿液水通道蛋白2(AQP2),放射免疫法检测内皮素(ET)、降钙素基因相关肽(CGRP),ELISA法定量测定热休克蛋白70(HSP70),HE染色、光镜下观察大鼠踝关节滑膜组织、舌组织。结果一般状态,C、D组符合湿热证的表现,B、D组符合痛风性关节炎的表现。尿液AQP2:A、B组高于C组和D组(P<0.05)。血浆ET:A组低于B、C、D组(P<0.05),B组低于C、D组(P<0.05),C组低于D组(P<0.05)。血浆CGRP:A组高于B、C、D组(P<0.05),B组低于C组和D组(P<0.05),C组低于D组(P<0.05)。血清HSP70:B、D组高于A、C组(P<0.05)。结论在高脂高糖饮食+湿热环境+关节腔注射药物的复合干预下,可以成功复制痛风性关节炎湿热蕴结证的大鼠动物模型。
痛风性关节炎;湿热蕴结证;大鼠模型
〔Abstract〕Objective To explore the methods for building the gouty arthritis rat models with damp-heat syndrome. Methods 40 healthy adult SD male rats were divided into 4 groups:normal control group(group A),gout group(group B),damp-heat group(group C),gout with damp-heat group(group D),10 in each group.The general status of the rats was observed before and after establishment.The water rat urine protein channel 2(AQP2)was detected by Bradford method;the endothelin(ET)and calcitonin gene-related peptide(CGRP)were measured by radiation immune method.HSP70 was detected byELISAmethod.TheratsweredyedbyHE.Synovialandtonguetissuesofanklesinratswereobservedby light-microscopy.Results In the general status,group C and D showed the manifestations in hot and humid,group B and D were in accordance with the performance of gouty arthritis.Urine AQP2 in group A and B was higher than that in group C and D(P<0.05).The content of plasma ET in group A was lower than that in group B,C and D(P<0.05),group B was lower than Group C and D,and group C was lower than group D(P<0.05).Plasma CGRP in group A was higher than that in group B,C and D(P<0.05),group B is lower than group C and group D(P<0.05),group C is lower than group D(P<0.05).Serum HSP70 in group B and D were higher than group A and C(P<0.05).Conclusion Under the comprehensive intervention of the high fat and sugar diet+damp-heat environment+articular cavity drug injection,the gouty arthritis rat models with damp-heat syndrome can be built successfully.
〔Keywords〕gouty arthritis;damp-heat syndrome;rat models
痛风(Gout)是体内嘌呤代谢紊乱导致的代谢性疾病,病因是尿酸盐在关节及关节周围组织中沉积,引起的急性炎症反应[1]。在现今实验研究中,单纯痛风性关节炎模型及单纯中医湿热证大鼠模型的研究较多,但痛风性关节炎“病”与中医湿热证“证”病证结合动物模型的研究较少,该病证结合动物模型的建立,成为亟待解决的问题。本课题采用对痛风性关节炎湿热证单因素造模与多因素复合造模的大鼠模型对比研究的方法,探讨建立痛风性关节炎湿热证大鼠模型的可行性,现报道如下。
1 材料与方法
1.1动物
SPF级健康成年SD雄性大鼠40只,体质量(200±20)g,清洁级;由湖南中医药大学动物实验中心提供,动物许可证编号:SCXH(湘)2013-0004。
1.2试剂及仪器
1.2.1主要试剂微晶尿酸钠(Sigma),氧嗪酸钾(Sigma),吐温80(Sigma);红星二锅头酒(酒精度为52度,北京红星股份有限公司生产);大鼠血清HSP70试剂盒(北京华埠力特生物技术研究所);尿AQP2试剂盒(碧云天生物技术研究所);油脂(自购),蜂蜜(湖南明园蜂业);尿酸检测试剂盒(比色法,德国罗氏诊断有限公司)。
1.2.2主要仪器QHX-300BS-Ⅲ人工气候箱(上海新苗医疗器械制造有限公司);GC-1500r放射免疫计数器(科大创新股份有限公司中佳分公司);WH-2微型漩涡混合仪(上海沪西分析仪器厂有限公司);DNM-9602酶标分析仪(北京普林新技术有限公司)。
1.3方法
1.3.1试剂的制备参考Coderre等[2]介绍的方法进行改良。(1)尿酸钠溶液:500 mg微晶尿酸钠加4.5 mL生理盐水,再加0.5 mL吐温80,加热搅拌,配成5 mL尿酸钠溶液;(2)氧嗪酸钾溶液:0.3 g氧嗪酸钾晶体溶解于9.7 mL生理盐水中配成3%氧嗪酸钾溶液。
1.3.2动物分组与造模健康成年SD雄性大鼠40只,喂养1周后按随机数字表法分为4组:正常对照组(A组),痛风组(B组),湿热组(C组),痛风加湿热模型组(D组),每组10只。A组:在正常温湿度(温度24~28℃,相对湿度60%~75%)环境下,普通饲料喂养,自由饮水15 d;B组:在正常温湿度环境下,普通饲料喂养,自由饮水15 d。第13天上午,用1 mL一次性无菌注射器配5号针头,在大鼠右侧踝关节背侧,从45°方向插入至胫骨肌腱内侧,将50 μL尿酸钠溶液注入到踝关节腔内,制备急性痛风模型[3];C组:在正常温湿度环境下,普通饲料喂养,加用200 g/L蜂蜜水自由饮用,且隔日上午按1 g/100 g体质量比率灌服油脂,并隔日灌服52度白酒1 mL/100 g,两者隔日交替,共持续10 d,然后放入人工气候箱中[温度为(32±2)℃,相对湿度(92± 3)%],每天造模时间为上午8~12时、下午13~17时,共5 d;D组:造模与C组一致,第13天上午,用与B组一致的方法,制备急性痛风模型。
1.4观测指标
1.4.1一般状态以造模第1、5、10、15天4个时相点重点观察各组大鼠的食量、水量、大小便、体质量、外观、精神状态等的变化情况,做详细记录并进行对比分析。
1.4.2尿液水通道蛋白2(AQP2)测定将每只大鼠放入单独的大鼠代谢笼中,禁食,自由饮水,收集24 h的尿液3.8~15 mL/只。采用Bradford法测定大鼠尿液中的AQP2含量。
1.4.3血浆内皮素(ET)和降钙素基因相关肽(CGRP)的测定大鼠腹腔注射麻醉后,腹主静脉取血2 mL,注入含7.5%EDTA二钠30 μL和抑肽酶40 μL的试管中,将样品置于-20℃,采用放射免疫法测定ET和CGRP浓度。
1.4.4大鼠舌的采集及检测试验期间肉眼观察大鼠舌象。试验结束后处死大鼠,舌根部剪下舌,10%中性甲醛溶液固定。常规脱钙,石蜡包埋,切片,HE染色,显微镜下观察舌组织变化。
1.4.5血尿酸(UA)、热休克蛋白70(HSP70)的测定大鼠麻醉后,腹主静脉取血4 mL,分别注入2 支EDTA抗凝管中,每支2 mL,摇匀,冷藏。用酶学比色法检测大鼠血UA,ELISA法定量测定HSP70表达。
1.4.6大鼠踝关节观察指标及评价方法观察指标包括周径[2]、肿胀情况[2]、步态和镜下踝关节滑膜组织形态学检查:(1)周径测量通过皮尺测量实验前0 h和造模后2、4、6、12、24、48、72 h大鼠右后踝关节同一部位的周径。(2)炎症指数分级标准:正常为0级,计0分;关节皮肤红斑,轻度肿胀,骨性标志可见为1级,计2分;关节明显红肿,骨性标志消失,但肿胀局限于关节部位为2级,计4分;关节以外肢体肿胀为3级,计6分。(3)各组大鼠痛风造模72 h后的步态计分步态分级评分标准据文献改良[4-5]:0级:正常行走,计0分;1级:轻微跛行,受试下肢略有弯曲,计2分;2级:跛行,受试下肢刚触及地面,计4分;3级:重度跛行,受试下肢离开地面,三足着地行走,计6分。(4)镜下关节滑膜组织形态学检查。大鼠处死后,以踝关节为中心上下0.5 cm处剪断,取下受试关节和周围软组织,分别快速切取踝关节滑膜,放入40 g/L中性甲醛溶液中固定,乙二胺四乙酸100 g/L脱钙,常规脱水、透明、包埋、切片和HE染色,显微镜下观察局部病理组织学变化。
1.5统计学分析
2 结果
2.1各组大鼠的一般状态
2.1.1一般表现A组:在喂养期间,正常饮食饮水、毛色光泽、活动正常,大便正常。B组:造模前表现同A组。自第13天造模后大鼠饮食饮水减少,表现明显烦躁不安,右踝关节明显增粗,且红、肿、热,伴功能障碍,活动受限等。C组:开始造模后逐渐出现,饮食、饮水量减少,出现倦怠,嗜卧懒动,行动呆滞,毛发蓬松颜色枯槁,小便黄;造模第5天,均开始出现大便溏泻或黏腻;第11天,出现明显呼吸粗重,烦躁不安,毛发疏松粗糙,阴囊松弛下垂,大便溏泻或黏腻症状加重,渐见肛周污秽。D组:造模后症状与C组相同,且在第13 d开始合并出现B组造模后的相同症状。
2.1.2各组大鼠不同时间点体质量变化第10、15天,C、D两组大鼠体质量与A、B两组比较差异具有统计学意义(P<0.05);A组与B组,C组与D组各时相点比较差异无统计学意义。见表1。
表1 各组大鼠4个不同时相点体质量变化比较(±s,n=10,g)

表1 各组大鼠4个不同时相点体质量变化比较(±s,n=10,g)
注:与A组比较★P<0.05,与B组比较△P<0.05。
组别A组B组C组D组第1天243.1±11.7 243.5±12.0 244.3±11.6 241.6±11.4 第5天273.2±15.5 272.8±12.6 268.1±18.7 267.9±12.6 第10天316.6±18.6 309.1±15.4 273.1±19.4★△282.5±14.2★△第15天338.5±24.7 329.3±16.1 266.8±12.1★△269.7±14.1★△
2.2各组大鼠尿液AQP2、血浆ET、CGRP、HSP70结果
(1)4组大鼠尿液AQP2含量比较,A、B组高于C组和D组(P<0.05)。(2)4组大鼠血浆ET含量比较,A组低于B、C、D组(P<0.05),B组低于C、D组(P<0.05),C组低于D组(P<0.05)。(3)4组大鼠血浆CGRP含量比较,差异有统计学意义(P<0.05)。A组高于B、C、D组(P<0.05),B组低于C组和D组(P<0.05),C组低于D组(P<0.05)。(4)4组大鼠血清HSP70含量比较,B、D组高于A、C组(P<0.05)。血浆ET与CGRP的相关性:A组、B组,ET和CGRP水平呈正相关(r=0.886、r=0.989,P <0.05);C组、D组,ET与CGRP水平呈负相关(r=-0.706、r=-0.725,P<0.05)。见表2。
表2 各组大鼠ET、CGRP、AQP2、HSP70含量比较(±s,n=10)
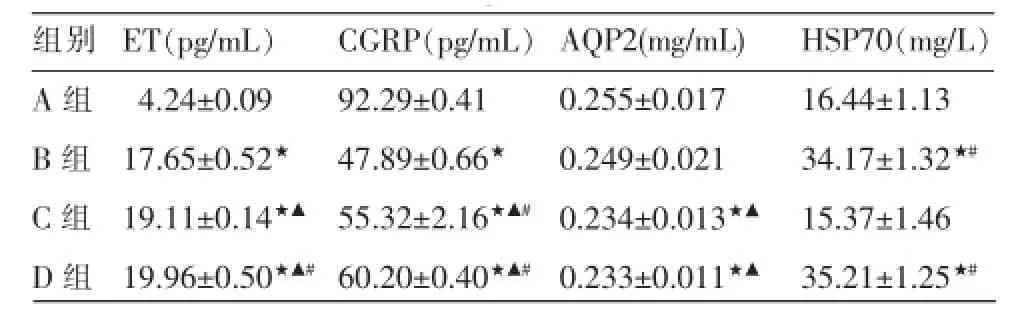
表2 各组大鼠ET、CGRP、AQP2、HSP70含量比较(±s,n=10)
注:与A组比较★P<0.05,与B组比较▲P<0.05,与C组比较#P<0.05。
组别A组B组C组D组ET(pg/mL)4.24±0.09 17.65±0.52★19.11±0.14★▲19.96±0.50★▲#CGRP(pg/mL)92.29±0.41 47.89±0.66★55.32±2.16★▲#60.20±0.40★▲#AQP2(mg/mL)0.255±0.017 0.249±0.021 0.234±0.013★▲0.233±0.011★▲HSP70(mg/L)16.44±1.13 34.17±1.32★#15.37±1.46 35.21±1.25★#
2.3大鼠舌象观察结果
肉眼观察:A组舌淡红,苔薄白;B组舌红,苔微黄;C组舌红,苔腻微黄;D组舌红,苔黄腻。镜下组织病理观察:A组:丝状乳头排列正常,无破坏,乳头呈圆锥形,尖端略向咽部倾斜。B组:丝状乳头复层扁平上皮多有角化、脱落,且乳头高度参差不齐,尖端变钝或消失,上皮的厚度较C组变厚。菌状乳头固有层毛细血管增多,乳头数目及其分枝减少。C组:丝状乳头复层扁平上皮角化较B组严重,上皮的形状变的矮短,尖端变钝或消失。菌状乳头固有层毛细血管增多,乳头数目及其分枝增多。D组:丝状乳头复层扁平上皮见角化、脱落,根部间或有空洞表现,上皮的形状矮短并多有破坏,尖端变钝间或有消失。菌状乳头固有层毛细血管增多。见图1(封三彩图)。
2.4各组大鼠血UA、踝关节炎症指数、步态计分结果
4组大鼠血UA比较,差异均无统计学意义(F= 0.530,P=0.665)。各组大鼠踝关节炎症指数与痛风造模72 h后步态计分比较结果:B组、D组分别与A组、C组比较,差异有统计学意义(P<0.05),A组与C组,B组与D组比较差异无统计学意义(P>0.05)。见表3。
表3 痛风造模72 h后各组大鼠血UA、踝关节炎症指数、步态计分比较(±s,n=10)
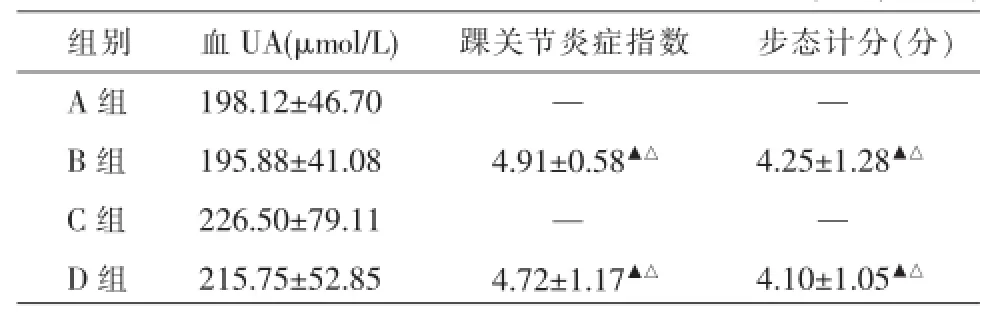
表3 痛风造模72 h后各组大鼠血UA、踝关节炎症指数、步态计分比较(±s,n=10)
注:与A组比较▲P<0.05,与C组比较△P<0.05,下表同。
组别A组B组C组D组血UA(μmol/L)198.12±46.70 195.88±41.08 226.50±79.11 215.75±52.85踝关节炎症指数—4.91±0.58▲△—4.72±1.17▲△步态计分(分)—4.25±1.28▲△—4.10±1.05▲△
2.5大鼠踝关节周径
造模后,B组、D组大鼠关节肿胀度均明显增加,在6~72 h达到高峰,分别与A组、C组比较,差异均有统计学意义(P<0.05);B组与D组,A组与C组比较差异无统计学意义(P>0.05)。见表4。
表4 不同时间各组大鼠踝关节周径变化(±s,n=10,cm)
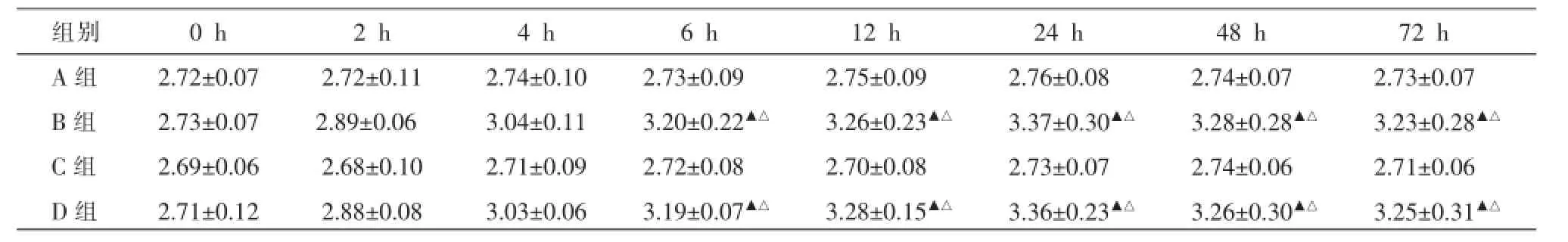
表4 不同时间各组大鼠踝关节周径变化(±s,n=10,cm)
组别A组B组C组D组0 h 2.72±0.07 2.73±0.07 2.69±0.06 2.71±0.12 2 h 2.72±0.11 2.89±0.06 2.68±0.10 2.88±0.08 4 h 2.74±0.10 3.04±0.11 2.71±0.09 3.03±0.06 6 h 2.73±0.09 3.20±0.22▲△2.72±0.08 3.19±0.07▲△12 h 2.75±0.09 3.26±0.23▲△2.70±0.08 3.28±0.15▲△24 h 2.76±0.08 3.37±0.30▲△2.73±0.07 3.36±0.23▲△48 h 2.74±0.07 3.28±0.28▲△2.74±0.06 3.26±0.30▲△72 h 2.73±0.07 3.23±0.28▲△2.71±0.06 3.25±0.31▲△
2.6各组大鼠镜下踝关节滑膜组织的形态学结果
A组:踝关节及其周围组织结构正常清晰,滑膜完整正常,无任何组织病理学改变;B组:局部解剖关节取材时,踝关节腔内可见尿酸盐结晶沉着。光镜下可见滑膜壁增厚,血管充血明显,滑膜及附近软骨被炎细胞严重侵润破坏,出现组织坏死现象;C组:表现同A组;D组:表现同B组。见图2(封三彩图)。
3 讨论
中医认为痛风性关节炎属于“痹证”、“历节”等范畴,近年国内学者对痛风证型的研究结果显示:在我国,尤其是中南部地区,湿热蕴结证为痛风临床主要证型[6]。在中医临床诊断中,湿热蕴结证有纳呆,渴不多饮,小便黄,大便溏,身体困重,舌质红,苔滑腻等表现。本实验研究结果中可以看出,C组与D组在一般状态中的表现和舌象均符合湿热蕴结证的表现;在体质量统计中,C、D组均较A、B组体质量下降,与湿热证表现相一致;B、D组一般状态表现出局部关节炎症状,在大鼠踝关节炎症指数、步态、踝关节周径观测中,与A、C组比较具有统计学意义,均符合局部关节炎症状表现;同时B、D组在踝关节滑膜及周围组织镜下观察的形态学结果与痛风性关节炎病理改变相符。
AQP2是近年来发现的存在于肾脏集合管的调节水重吸收的关键蛋白之一[7]。研究表明[8],尿液AQP2含量可作为判断湿热证“湿”邪偏重与否的重要指标。本研究中C、D组尿液AQP2含量低于A、B组,且比较差异有统计学意义,可提示此实验成功复制出痛风性关节炎湿热证中的“湿”证。ET具有收缩血管作用,CGRP则是舒张血管作用,两者具有生物学拮抗作用[9]。ET和CGRP协同调节血管收缩与舒张,影响血流量及热量散发[10-11],ET含量升高、CGRP含量下降使血管收缩大于舒张,热量散发受抑制,与湿热证“热”的机制相关。本研究中C、D组ET含量高于A组,CGRP含量低于A组,且ET含量和CGRP含量呈负相关,可提示本实验成功建立出湿热证中的“热”证。热休克蛋白70(HSP70)在人体内是一种具有重要功能的蛋白质。通常仅在细胞内微量表达,但在机体组织遭受损伤、感染、炎症、细胞因子作用下时,均可引起HSP70过量表达,以维持细胞的正常功能[12]。在本实验结果中可以佐证关节炎症的产生和关节滑膜、软骨损伤坏死的表现。
本实验造模方法应会对被试动物大鼠的血尿酸有一定的影响,但在四组之间的比较没有统计学意义,未能通过影响全身嘌呤代谢而使体内血尿酸升高诱导出痛风模型,本模型仅为局部造成急性痛风性关节炎的模型,与人类痛风性关节炎相比还是存在一定的差异,因此后期研究中应对此方面着重进行探索。综上所述,在持续高脂高糖饮食+湿热环境+关节腔注射药物等复合因素干预作用下,可以复制出痛风性关节炎湿热蕴结证病症结合的大鼠动物模型。但根据近期研究报道[13],只有人类和灵长类、鸟类动物尿酸氧化酶(UOX)基因中存在无意突变而沉默,无法合成UOX或合成的UOX不具生物活性,而其他种类动物,包括本实验选用的大鼠都有完整的UOX基因,嘌呤代谢途径虽与人类不同,其最终代谢产物为CO2和H2O,本实验模型的阳性结果可能与造模干预后到指标测试的时间紧密有关。动物模型与血尿酸、UOX及其基因表达的相关性有待进一步研究。
[1]吴锦秋,李盛华.中药治疗急性痛风性关节炎的研究进展[J].中国中医骨伤科杂志,2014,22(2):79-80.
[2]Coderre TJ,Wall PD.Ankle joint urate arthritis(A JUA)in rats an alternative animal model of arthritis to that produced by Freundcs adjuvant[J].Pain,1987,28(3):379-393.
[3]尤力都孜·买买提,热比姑丽·伊斯拉木,阿布都吉力力·阿布都艾尼.痛风及其动物模型研究初探[J].中药药理与临床,2012,28(3):172-173.
[4]贺石林,李元建.医学科研方法学[M].北京:人民军医出版社,2003:226-228.
[5]Chen SY,Chert CL,Shen ML,et a1.Clinical features of familialgout and effects of probable genetic association between gout and its related disorders[J].Metabolism,2001,50(5):1 203-1 207.
[6]熊辉,姜国勇,胡楠,等.痛风性关节炎中医证素及证型的聚类研究[J].中医正骨,2011,23(11):26-28.
[7]Nielsen S,Agre P.The aquaporin family of water channels in kidney[J].Kidney Int,1995,48(4):1 057-1 068.
[8]吴仕九,廖礼兵.湿热证大鼠肾内髓及尿液中水通道蛋白AQP2含量的变化[J].中国中医药科技,2003,10(1):4-5.
[9]吕娟丽,孙慧萍,阎赋琴,等.七叶皂苷钠对沙土鼠脑缺血再灌注损伤ET和CGRP的影响[J].中国药师,2014,17(4):596-598.
[10]Nguyen BN,Johnson JA.The role of endothelin in heart failure and hypertension[J].Pharmacotherapy,1998,18(4):706-719.
[11]Zolk O,Quattek J,Schrader T,et al.Alterations of the cardiac endothelin system in human end-stage heart failure[J].Circulation,1998,98(17):551.
[12]门可,王霞,周宏超,等.血清中HSP70定量检测方法的建立[J].第四军医大学学报,2001,22(20):1 835-1 837.
[13]楼秀余.人类痛风病与UOX基因沉默相关的研究[J].中外医学研究,2012,10(10):154-155.
(本文编辑匡静之)
Study of the Establishment of the Gouty Arthritis Rat Models with Damp-heat Syndrome
YIN Ming1,XIANG Lili1,XIONG Hui2*,QU Liangye3,QI Xinyu1,ZHOU Biao1
(1.Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;2.The Second Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410005,China;3.Zhangzhongjing Traditional Chinese Hospital,Nanyang,Henan 473000,China)
R589.7
A
10.3969/j.issn.1674-070X.2015.02.003.006.05
2014-12-14
湖南省自然科学基金项目(13JJ3102);湖南省教育厅科学研究项目(12C0274);湖南中医药大学青年教师科研基金资助。
尹明,男,讲师,研究方向:骨与关节疾病的防治。
*熊辉,男,教授,博士研究生导师,E-mail:xh_hn@sina.com。

