压阻式微悬臂梁传感器检测生化毒剂的响应动力学研究
刘志伟,童朝阳,穆晞惠,郝兰群,刘 冰,张金平,高 川
(防化研究院,国民核生化灾害防护国家重点实验室,北京102205)
压阻式微悬臂梁传感器检测生化毒剂的响应动力学研究
刘志伟,童朝阳*,穆晞惠,郝兰群,刘冰,张金平,高川
(防化研究院,国民核生化灾害防护国家重点实验室,北京102205)
为了探索压阻式微悬臂梁传感器检测靶分子的信号响应规律,在利用压阻式微悬臂梁传感器生化毒剂大量实测数据的基础上,基于配体-受体动力学和吸附动力学创建了两种压阻式微悬臂梁传感器检测靶分子的动力学模型,利用创建的动力学模型对检测数据进行了分析。结果表明:创建的模型能很好地拟合抗体、适配子等不同敏感分子检测不同种类(大分子蛋白毒素、小分子化学毒剂)、不同浓度生化毒剂的实测数据,相关系数R值均在0.948 5以上(p<0.01)。两种模型中,基于配体-受体特异结合动力学模型由于考虑了敏感膜与靶分子间的特异相互作用,对传感器实际检测数据的拟合效果更佳,相关系数R值均在0.957 1以上(p<0.01),能更好的反映压阻式微悬臂梁传感器检测靶分子的响应特点和规律;并且能求出更有意义的平衡响应电压(ΔUe)、响应时间(t0)等参数,根据曲线拟合方程求出的ΔUe、t0均与实测值非常接近。
压阻式微悬臂梁;生物传感器;生化毒剂;检测;响应动力学
EEACC:7230M;7230J;7110;7220doi:10.3969/j.issn.1004-1699.2015.09.006
压阻式微悬臂梁是一种新型电学读出悬臂结构,可直接将发生在微悬臂梁上的生化反应转化为电压信号进行输出,具有读出方式简单、易于集成,成本低,体积小等优点,较传统光学读出及动态模式微悬臂梁更适合于不透明、混浊等复杂环境样品的现场快速检测[1-11]。但由于压阻式微悬臂梁的加工难度较大,目前国内外对其的应用报道还很少。利用压阻式微悬臂梁传感器检测生化靶分子时,不可避免会出现非特异性信号等异常信号的干扰,如何去除异常信号的干扰是数据处理中急需解决的问题,迫切需要建立传感器检测生化靶分子的响应动力学模型,对检测过程中的实际响应信号进行分析。目前人们常用Langmuir等温吸附模型来研究分子在物质表面的吸附过程,但Langmuir等温吸附主要是基于物理吸附原理,无法区分特异性和非特异性分子吸附[12]。本研究旨在利用压阻式微悬臂梁传感器生化毒剂大量实测数据的基础上,结合配体-受体动力学创建一种特异信号响应的基于不同敏感分子(抗体、适配子)检测不同类型靶分子(大分子蛋白质、小分子化合物)的动力学模型,探索压阻式微悬臂梁传感器检测生化分子的信号响应特点和通用规律,提高传感器检测的准确性及抗干扰能力,为未来在环境监测、食品卫生检验及生物反恐等应用领域发展适合生化毒剂现场快速检测的微小型传感器提供技术基础和参考依据。
1 实验部分
1.1试剂和仪器
β-银环蛇毒素(β-BGT)、T2毒素、蓖麻毒素(ricin)、沙林(GB)、生物素化的β-BGT多抗、生物素化的T2毒素多抗、生物素化的ricin适配子(5′-Bio-TCG CAA GAC GGA CAG AAG CTG ATT GTT ATT TTT TTT TTT GTT TAT GCT GTA TGC CAT TAG GTT GGT GGA GCG ATT TGT-3′)、生物素化的GB适配子(5′-Bio-TCG CAA GAC GGA CAG AAG TTG GGA CTG CCA CTT TGT GTT TTG GTT ATA GTA CTT ATT TGC GTT GGT GGA GCG ATT TGT-3′)由本实验室制备;活化生物素(biotin-NHS ester)、3,3,-二巯基丙酸(DDPA)、1-乙基-3-(3-二甲氨丙基)-碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、亲和素(avidin)、乙醇胺均购自Sigma公司;牛血清白蛋白(BSA,上海国药集团有限公司);PBS缓冲液(pH7.4,0.01 mol/L)、双蒸水均自制;其他所用化学品和试剂均为分析纯。
压阻式微悬臂梁检测平台由本室与北京大学微电子学研究院共同搭建(压阻式微悬臂梁传感芯片:长200 μm,宽50μm,厚约1 μm,表面镀金)。压阻式微悬臂梁的检测原理是基于半导体材料的压阻效应,在微悬臂梁上的合适区域掺杂上半导体材料,由于微悬臂梁表面生化反应的发生而使微悬臂梁弯曲时,会引起掺杂区电阻的变化,可通过惠斯通电桥将电阻变化转化为电压变化进行输出。
1.2压阻式微悬臂梁传感器的构建
将压阻式微悬臂梁置于检测池中,加入DDPA (5 g/L),反应1 h使其表面金膜包被上羧基;双蒸水清洗悬臂梁及检测池后加入EDC(5 g/L)和NHS(5 g/L),反应0.5 h,完成对悬臂梁表面的氨基活化修饰;清洗悬臂梁后自然晾干,滴加20 μL 100 mg/L的亲和素,反应0.5 h;清洗后滴加20 μL 1mol/L的乙醇胺反应0.5 h以灭活金膜表面残余的羧基;清洗后将悬臂梁置于含PBS缓冲溶液的检测池中,加入生物素化的敏感材料至饱和,反应约2 h,清洗悬臂梁及检测池。本研究中的生物素化敏感材料为生物素化的β-BGT抗体、生物素化的T2毒素抗体、生物素化的ricin适配子、生物素化的GB适配子。
1.3生化毒剂的检测
将固定好敏感材料的微悬臂梁置于含0.01 M PBS缓冲溶液的检测池中,待信号稳定后向检测池中加入不同浓度的生化毒剂(β-BGT、T2毒素、ricin、GB,一个芯片测量一个浓度),记录传感器的输出电压。
1.4压阻式微悬臂梁传感器响应动力学分析
敏感膜与靶分子的相互作用通常可用配体-受体结合和物理吸附方式来加以描述,分别基于配体—受体动力学和吸附动力学的原理,创建了压阻式微悬臂梁传感器检测生化靶分子的动力学模型,通过对实测数据的拟合分析,探索其信号响应的特点和规律。
1.4.1基于配体—受体动力学的模型创建
将配体(A)溶液加到有受体(B)修饰的压阻式微悬臂梁上,发生如下反应,生成受体-配体的结合物(C)。

在配体浓度很低的情况下,配体—受体间的结合满足假一级动力学方程[13]:
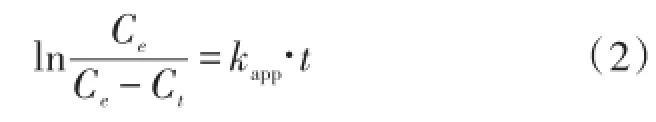
式中:kapp为表观反应速率常数,Ct为t时刻受体-配体复合物浓度,Ce为反应达到平衡时刻的受体-配体复合物浓度。
压阻式微悬臂梁的总电压灵敏度可表示为[14]:

式中:l,w,和t为悬臂梁长,宽,厚尺寸,lpr为压阻材料的长度,Vbridge为惠斯通电桥的输入电压,γ是压阻材料电阻与总电阻的比率,在简化处理的情况下,γ=1,β*是有效因子,π0是一个常数。在均匀注入压阻材料的情况下,对于一个特定压阻微悬臂梁来说,β*为一个常数,因此SF也为一常数,即压阻式微悬臂梁传感器输出电压变化与悬壁梁上所受的应力Ft成正比。而Ft直接取决于悬臂梁表面形成的配体-受体复合物浓度Ct,可设Ft=K1Ct(K1为常数)。设加样时压阻式微悬壁梁传感器输出电压为U0,t时刻输出电压为Ut,ΔU=Ut-U0,从而可得到:
ΔU=Ut-U0=SFFt=SFK1Ct(4)
最后,配体溶液加入到传感器检测池以后,需要一个时间传感器才能响应。设响应时间为t0,结合式(2)与式(4)及此假设条件可得:
即ΔU随t变化的理论模型,以下简称R模型。其中ΔUe=Ue-U0(ΔUe为反应达到平衡时刻的输出电压与零时刻的输出电压之差,即平衡响应电压)。
1.4.2基于吸附动力学的模型创建
关于生化分子与传感器表面相互作用的动力学模型,常见的是Langmuir等温吸附模型。Langmuir方程可被表示为:
式中:K为Langmuir平衡常数,c为水溶液浓度(或气体分压),Γ为吸附量,Γmax为当c增加时的最大吸附量。将Langmuir方程与压阻式微悬臂梁输出电压变化规律结合起来可得[15]:
Vout=Voff+A(1-e-kt)(7)
Vout为压阻式微悬臂梁的输出电压,Voff为压阻式微悬臂梁的偏置电压,A为常数,k为吸附常数。
压阻式微悬臂梁传感器零时刻的输出电压为:
Vout-0=Voff(8)
任意时刻t时压阻式微悬臂梁传感器的输出电压为:
Vout-t=Voff+A(1-e-kt)(9)
因此,任意时刻t时的响应电压为:
ΔU=Vout-t-Vout-0=A(1-e-kt)(10)
即ΔU随t变化的理论模型,以下简称L模型。
2 结果与讨论
2.1压阻式微悬臂梁免疫传感器的响应动力学
利用上述创建的两种动力学模型对压阻式微悬臂梁免疫传感器检测不同浓度大分子蛋白(abrin)、非蛋白小分子(T2毒素)的实测数据进行响应动力学分析,结果见图1、图2。

图1 两种模型拟合压阻式微悬臂梁免疫传感器检测abrin结果的对比分析
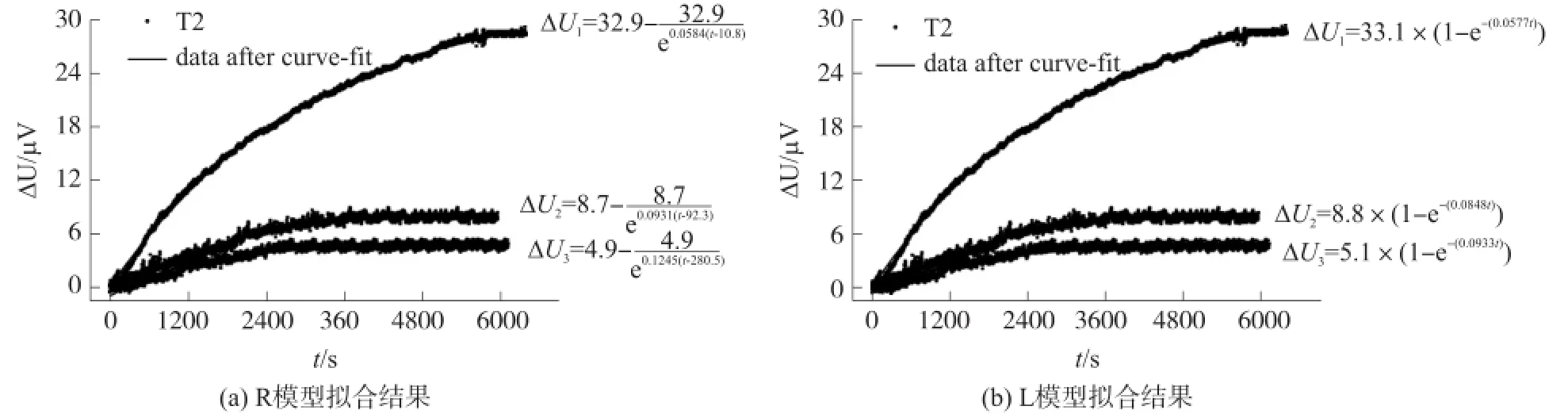
图2 两种模型拟合压阻式微悬臂梁免疫传感器检测T2毒素结果的对比分析
从图1、图2可知,创建的两种压阻式微悬臂梁传感器响应动力学模型都能较好的反映压阻式微悬臂梁免疫传感器检测不同浓度大分子蛋白(abrin)、非蛋白小分子(T2毒素)动力学过程,相关系数R>0.957 3(p<0.01),其中R模型拟合实测数据的相关系数高于L模型,相关系数R>0.971 1(p<0.01),并且由R模型可以拟合得到两个有实际检测意义的模型参数,平衡响应电压(ΔUe)及响应时间(t0)。
传感器对8 μg/L、16 μg/L、32 μg/L abrin的实际平衡响应电压分别为2.5 μV、10.6 μV、21.0 μV,响应时间分别为110 s、80 s、76 s;对4 μg/L、20 μg/L、60 μg/L T2毒素的实际平衡响应电压分别为4.5 μV、7.8 μV、28.0 μV,响应时间分别为250 s、70 s、12 s。R模型中平衡响应电压、响应时间拟合值及L模型平衡响应电压近似拟合值参见图1、图2中曲线拟合方程,如R模型对8 μg/L abrin实测数据拟合的平衡响应电压、响应时间分别为3.2 μV、121.4 s,L模型对8 μg/L abrin实测数据拟合的平衡响应电压近似值为3.8 μV。利用R模型拟合实际平衡响应电压的相对偏差小于利用L模型近似拟合的相对偏差,在低浓度时更为明显,如利用R对8 μg/L abrin拟合的相对偏差为28%,而利用L模型拟合的相对偏差为52%,结果见表1。总体而言,由R模型拟合求得的传感器平衡响应电压、响应时间与实测值均非常接近,且随着abrin 及T2毒素浓度的增加,传感器响应时间缩短,平衡响应电压增大,与实际情况具有很好的一致性。

表1 压阻式微悬臂梁免疫传感器的响应动力学分析
2.2压阻式微悬臂梁适配子传感器的响应动力学

图3 两种模型拟合压阻式微悬臂梁适配子传感器检测ricin结果的对比分析
利用上述创建的两种动力学模型对压阻式微悬臂梁适配子传感器检测不同浓度大分子蛋白(ricin)、小分子化合物(GB)的实测数据进行响应动力学分析,结果见图3、图4。

图4 两种模型拟合压阻式微悬臂梁适配子传感器检测GB结果的对比分析
从图3、图4可知,创建的两种压阻式微悬臂梁传感器响应动力学模型都能较好的反映压阻式微悬臂梁适配子传感器检测不同浓度大分子蛋白(ricin)、小分子化合物(GB)动力学过程,相关系数R>0.948 5(p<0.01),其中R模型拟合实测数据的相关系数高于L模型,相关系数R>0.957 1(p<0.01),并且由R模型可以拟合得到两个有实际检测意义的模型参数,平衡响应电压(ΔUe)及响应时间(t0)。
传感器对0.04 μg/L、0.2 μg/L、2 μg/L、10 μg/L、20 μg/L、40 μg/L ricin的实际平衡响应电压分别为3.5 μV、7.0 μV、8.9 μV、16.5 μV、22.0 μV、42.5 μV,响应时间分别为320 s、230 s、220 s、180 s、120 s、110 s;对10 μg/L、16 μg/L、20 μg/L、32 μg/L、60μg/L GB的实际平衡响应电压分别为4.7 μV、8.6 μV、11.5 μV、22.5 μV、40.0 μV,响应时间分别为240 s、186 s、180 s、168 s、110 s。R模型中平衡响应电压、响应时间拟合值及L模型平衡响应电压近似拟合值参见图3、图4中曲线拟合方程。利用R模型拟合实际平衡响应电压的相对偏差小于利用L模型近似拟合的相对偏差,在低浓度时更为明显,如利用R模型对16 μg/L GB拟合的相对偏差为27.9%,而利用L模型近似拟合的相对偏差为58.1%,结果见表2。总体而言,由R模型拟合求得的传感器平衡响应电压、响应时间与实测值均非常接近,且随着ricin及GB浓度的增加,传感器响应时间缩短,平衡响应电压增大,与实际情况具有很好的一致性。

表2 压阻式微悬臂梁适配子传感器的响应动力学分析
3 结论
根据敏感膜与靶分子相互作用规律,基于配体-受体动力学和吸附动力学创建了两种压阻式微悬臂梁传感器检测靶分子的动力学模型,利用创建的动力学模型对压阻式微悬臂梁免疫传感器和压阻式微悬臂梁适配子传感器检测生化毒剂的实测数据进行拟合分析。结果表明,创建的模型能很好地拟合抗体、适配子等不同敏感分子检测不同种类(蛋白质、化学小分子)、不同浓度生化毒剂的实测数据,相关系数R值均在0.948 5以上(p<0.01)。
两种动力学模型中,基于配体-受体特异结合的动力学模型由于考虑了敏感膜与靶分子间的特异相互作用,克服了基于物理吸附原理Langmuir模型无法区分特异性吸附和非特异性吸附响应的缺陷,能更好的反映压阻式微悬臂梁传感器检测生化靶分子的响应特点和规律,较基于Langmuir等温吸附创建的动力学模型能更好拟合实际检测数据,在浓度较低的情况下更为明显,并能求出更有意义的平衡响应电压(ΔUe)、响应时间(t0)等参数,根据曲线拟合方程求出的传感器平衡响应电压(ΔUe)、响应时间(t0)均与实测值非常接近。该模型未来可用于生化分子检测的数据分析、处理及非特异性干扰信号的排除,在提高压阻式微悬臂梁传感器检测的准确性及抗干扰能力上具有广阔的应用前景。
[1] Patil S J,Adhikari A,Baghini M S,et al.An Ultra-Sensitive Piezoresistive Polymer Nano-Composite Microcantilever Platform for Humidity and Soil Moisture Detection[J].Sensors and Actuators B,2014(203):165-173.
[2] Rajavelu M,Sivakumar D,Daniel R J,et al.Perforated Diaphragms Employed Piezoresistive MEMS Pressure Sensor for Sensitivity Enhancement in Gas Flow Measurement[J].Flow Measurement and Instrumentation,2014(35):63-75.
[3] Sang Shengbo,Zhao Yuan,Zhang Wendong,et al.Surface Stress-Based Biosensors[J].Biosensors and Bioelectronics,2014(51): 124-135.
[4] Thuau D,Ayela C,Poulin P,et al.Highly Piezoresistive Hybrid MEMS Sensors[J].Sensors and Actuators A,2014(209):161-168.
[5] Yang S M,Chang C.A Piezoresistive Bridge-Microcantilever Biosensor by CMOS Process for Surface Stress Measurement[J].Sensors and Actuators B,2010(145):405-410.
[6] Pandya H J,Roy R,Chen W J,et al.Accurate Characterization of Benign and Cancerous Breast Tissues:Aspecific Patient Studies Using Piezoresistive Microcantilevers[J].Biosensors and Bioelectronics,2015(63):414-424.
[7] García-Romeo D,Pellejero I,Urbiztondo M A,et al.Portable Low-Power Electronic Interface for Explosive Detection Using Microcantilevers[J].Sensors and Actuators B,2014(200):31-38.
[8] Sang S B,Zhao Y,Zhang W D,et al.Surface Stress-Based Biosen-sors[J].Biosensors and Bioelectronics,2014(51):124-135.
[9] Zhang Q,Ruan W Z,Wang H,et al.A Self-Bended Piezoresistive Microcantilever Flow Sensor for Low Flow Rate Measurement[J]. Sensors and Actuators A,2010(158):273-279.
[10]李建华,徐立新,陈和峰,等.基于MEMS技术的新型太赫兹混频器设计与制作[J].传感技术学报,2015,28(1):9-12.
[11]俞锋,李昕欣,于海涛.平面内谐振式微悬臂梁生化传感器的设计与制造[J].传感技术学报,2012,25(7):869-875.
[12]黄渊,刘红,张青川.利用微悬臂梁研究聚N-异丙基丙烯酰胺在金表面的自组装[J].物理学报,2009,58(9):6122-6127.
[13]周廷冲.受体生化药理学[M].北京:人民卫生出版社,1985: 104-108.
[14]Doll J C,Park S J,Pruitt B L.Design Optimization of Piezoresistive Cantilevers for Force Sensing in Air and Water[J].Journal of Applied Physics,2009,106:064310-0-064310-12.
[15]Yang S M,Chang C,Yin T I,et al.DNA Hybridization Measurement by Self-Sensing Piezoresistive Microcantilevers in CMOS Biosensor[J].Sensors and Actuators B,2008,130:674-681.

刘志伟(1989-),男,湖南娄底人,研究实习员。主要研究方向为生物检测技术,liuzhw07@lzu.edu.cn。
Study on Response Kinetics of Piezoresistive Microcantilever Sensor for CBW Agents Detection
LIU Zhiwei,TONG Zhaoyang*,MU Xihui,HAO Lanqun,LIU Bing,ZHANG Jinping,GAO Chuan
(State Key Laboratory of NBC Protection for Civilian,Research Institute of Chemical Defense,Beijing 102205,China)
A research about the response kinetics for piezoresistive microcantilever sensor based on mass data of CBW agents detection and molecule kinetic model(receptor-ligand kinetics or adsorption kinetics)has been made,receiving two response kinetic models of piezoresistive microcantilever sensor under different molecule kinetic model.The built models were used to fit the measured data of CBW agents.Results showed that both these two models could well fit the measured data of CBW agents under different types(macromoleule protein toxin and micromolecule chemical agents)and different concentrations,modifying with different sensitive molecules(antibodies and aptamers).The correlation coefficient R was greater than or equal to 0.948 5(p<0.01).In these two models,the model based on specific binding of ligand-receptor could fit the measured data better since it considered the specific interaction between sensitive molecules and target molecules.The correlation coefficient R was greater than or equal to 0.957 1(p<0.01),which could better reflect the response kinetics of piezoresistive microcantilever sensor.And it could give some more meaningful parameters,such as response voltage(ΔUe)and response time(t0).Response voltage(ΔUe)and response time(t0)obtained from the fitting equation on different target molecules fitted well with the measured values.
piezoresistive microcantilever;biosensor;CBW agent;detection;response kinetic
TP301
A
1004-1699(2015)09-1297-06
2015-02-13修改日期:2015-07-20

