上海市生食三文鱼中副溶血性弧菌污染的风险分析
刘海泉,刘冰宣,吕利群,潘迎捷,谢 晶,赵 勇,*(.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 0306;.上海海洋大学水产与生命学院,上海 0306)
上海市生食三文鱼中副溶血性弧菌污染的风险分析
刘海泉1,2,刘冰宣1,吕利群2,潘迎捷1,谢 晶1,赵 勇1,*
(1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海201306;2.上海海洋大学水产与生命学院,上海201306)
为了解上海市生食水产品的安全状况,为食品安全分析和监管提供理论依据,研究上海市生食三文鱼为代表的生食水产品中副溶血性弧菌的污染情况,对上海市3 个批发市场进行监测分析,在2013年基于GB/T 4789.7—2008《食品卫生微生物学检验:副溶血性弧菌检验》方法共检测了90 个样品,副溶血性弧菌检出率为20.00%,其中致病性副溶血性弧菌(tdh+)的检出率为1.10%,使用MEGA软件根据16S rDNA序列开展了菌株多样性分析;根据调查的副溶血性弧菌在生食三文鱼中的污染情况,使用@Risk 5.5 软件分析了生食三文鱼可能引发副溶血性弧菌食物中毒的风险,经Beta-Poisson剂量反应模型、蒙特卡洛模拟等分析后表明,生食三文鱼患病的概率为2.02×10-6,即每百万人有2 人发病;根据上海市三文鱼的平均消费总量,上海市居民每年生食三文鱼因副溶血性弧菌污染可能的患病人数为111 人。上海市居民生食三文鱼由副溶血性弧菌污染引起疾病的风险较小,控制副溶血性弧菌的污染量和每次三文鱼的消费量是减少风险的关键。
生食三文鱼;副溶血性弧菌;风险分析;食品安全
副溶血性弧菌(Vibrio parahaemolyticus),为嗜盐性革兰氏阴性短杆菌,弧菌科弧菌属,最早在1953 年由藤野恒三郎在日本发生的一次食物中毒事件中分离得到。副溶血性弧菌可引起头疼、腹泻、发烧、肠胃炎,严重的还会引起败血症危及生命,其广泛分布于近海区域、盐湖及水产品中[1]。刘秀梅等[2]对1992—2001年食源性疾病监测网的食源性疾病的数据统计显示,副溶血性弧菌引起的食源性疾病数量居我国微生物食源性疾的首位,占微生物食源性疾病发病病因的31.10%。毛雪丹等[3]研究表明,我国每年因副溶血性弧菌感染导致腹泻人数达665.50万 人,占腹泻发病人数的2.16%,远高于美国等发达国家报道的副溶血性弧菌分别占腹泻发病人数的比例[4];同时每年因副溶血性弧菌感染导致急性胃肠炎728.10万 人[3],每年因副溶血性弧菌感染导致的高比例的腹泻和急性胃肠炎可能与我国很多地区有生食水产品的习惯而更易感染副溶血性弧菌有关[4]。
我国生食水产品的历史悠久,素有“生吃螃蟹活吃虾”说法。生食水产品是指经过清洗整理等简单加工工艺,而直接食用的鱼类、贝类、甲壳类和藻类等水产品[5-6]。三文鱼是鲑科鱼类或鲑鳟鱼类的商业名称,因富含Ω-3脂肪酸,肉质鲜美,深受消费者喜爱,是当今世界范围的高档水产消费品;随着我国居民生活水平的提高和饮食保健意识的增强,三文鱼已成为最受欢迎的生食水产品之一[7-9]。
有些生食水产品在南方和沿海地区作为当地传统风味食品,已成为居民普遍食用的食品。但是生食水产品销售、加工条件所限及食用方法不当而引起的食源性疾病和食物中毒时有发生,并出现日趋严重的后果。上海市2010—2011年,对生食水产品病原菌的检测表明,病原菌检出率为13.24%[10]。三文鱼因加工方便,营养美味,健康可口,已成为主要的生食水产品。据统计2008年挪威三文鱼在上海的消费量要占到中国总进口量的1/3左右,并且每年的消费量不断攀升;但对于食用三文鱼的安全性也越来越受到消费者的关注,除寄生虫污染外最主要的问题就是食源性致病菌的污染,其中以副溶血性弧菌污染最为突出。
为了解上海市生食水产品中副溶血性弧菌的流行状况,为副溶血性弧菌引起的食源性性疾病提供间接理论参考,从而更好地控制副溶血性弧菌感染;本研究系统分析了上海市副溶血性弧菌在三文鱼中的污染流行状况,并分析了上海市居民每年生食三文鱼因副溶血性弧菌污染患病的风险。
1 材料与方法
1.1材料
1.1.1样品采集
选取3 处上海市较大的具有代表性水产品批发市场,在4 个季节不同月份,定点搜集样品,每处批发市场采集3 个点,每个点一份样品,每份样品200 g左右均采用无菌方法采集,无菌采样后置4~8 ℃低温保存,3~8 h内在实验室处理检验。一年内共收集90 个样品。1.1.2培养基与试剂
胰蛋白胨大豆肉汤(trypticase soy broth,TSB)、3%碱性蛋白胨水(alkaline peptone water,APW)、硫柠胆蔗琼脂(thiosulfate citrate bile salts-sucrose agar,TCBS)、采样袋北京陆桥技术责任有限公司;Taq DNA聚合酶、dNTP(deoxy-ribonucleoside triphosphate)大连TaKaRa公司;Biospin细菌基因组DNA提取试剂盒杭州Bioer公司;DNA Marker、溶菌酶、蛋白酶K北京天根生化科技有限公司。
1.1.3仪器与设备
VS-100L-U型超净工作台江苏苏净集团;MLS-3750型压力蒸汽灭菌器、MIR-154型高精度低温培养箱日本三洋Sanyo公司;BagMixer®400型拍打式均质器法国Interscience公司;6325型聚合酶链式反应(polymerase chain reaction,PCR)仪、5424型离心机、微量移液器德国Eppendorf公司;PL2002型电子天平瑞士Mettler Toledo公司;Sub-Cell®GT型电泳仪、Gel DocTMXR型凝胶成像分析系统美国Bio-Rad公司。
1.1.4引物
所用引物列于表1,引物由上海生物工程技术有限公司合成。

表1 引物序列及扩增产物Taabbllee 11 PPrriimmeerr sseeqquueenncceess aanndd aammpplliiffi i ccaattiioonn pprroodduuccttss
1.2方法
1.2.1样品中副溶血性弧菌的检验
根据GB/T 4789.7—2008 《食品卫生微生物学检验:副溶血性弧菌检验》[14]方法,使用最大或然数(most probable number,MPN)法分析样品中的副溶血性弧菌数量。
1.2.2分离菌株的保存和培养
根据国标方法分离到的可疑副溶血性弧菌株,使用25%甘油,保存于-80 ℃,以备后续实验使用。
取保存菌株,接种于3% NaCl的TSB肉汤,在37 ℃条件下复苏;划线接种于3% NaCl的TSA琼脂,挑取单菌落接种于营养肉汤中,在37 ℃条件下培养至对数期(OD600 nm=0.8),划线接种于3% NaCl的TSA琼脂,连续活化两次。挑取单菌落,接种于3% NaCl的TSB中,37 ℃、170 r/min振荡培养,培养至OD600 nm=0.8提取DNA。
1.2.3细菌DNA提取
使用Biospin细菌基因组DNA提取试剂盒提取DNA。1.2.4PCR方法
PCR扩增体系溶液体积为25 μL,其中dd H2O 16.2 μL、10×缓冲液(含Mg2+)2.5 μL、dNTPs (2.5 mmol/L)2.0 μL、引物10 μmol/L 各1 μL、Taq酶(5 U/μL)0.3 μL、模板DNA 2.0 μL。16S rDNA体系,因用于测序,反应体系扩倍,最后总体积为50 μL。
PCR程序如下:95 ℃预变性2 min;94 ℃变性30 s,退火(其中16S rDNA基因56 ℃,tlh和trh基因60 ℃,tdh基因58 ℃)30 s,72 ℃延伸2 min,共循环35 次;最后72 ℃再延伸8 min。PCR扩增产物在1.5%琼脂糖凝胶120 V电压,电泳25 min。
1.2.516S rDNA序列测定及系统发育分析
经电泳检测条带单一的样品,PCR反应液送上海生物工程技术有限公司测序。使用MEGA 4.1软件基于Kimura的双参数模型修正的距离矩阵,使用邻接法,依据序列16S rDNA建立了分子系统发育[15]。建树的自展值为1 000 倍重复。根据16S rDNA建立的系统发育来分析副溶血性弧菌的多样性。
1.2.6副溶血性弧菌在生食三文鱼中的风险评估参数设置
副溶血性弧菌感染的风险评估使用@Risk(Version 5.7)软件(Palisade, USA),评估时所用的模型中的变量参数数值如表2所示。
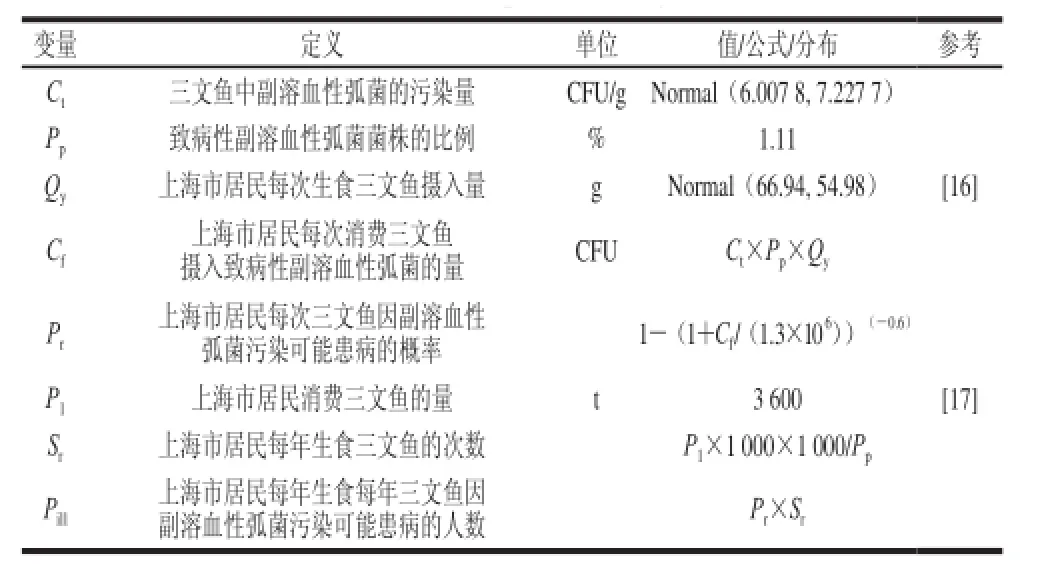
表2 副溶血性弧菌风险评估参数设置情况表Table 2 Parameters set forV. parahaemolyticcuuss risk assessmmeenntt
模型中的参数分布均以@Risk软件的语法表达,使用拉丁超立方抽样方法,进行蒙特卡洛50 000 次迭代模拟。剂量反应关系模型为Beta-Poisson模型[18-19]:
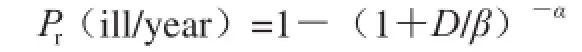
式中:D为上海市居民通过三文鱼每次可能摄入致病性副溶血性弧菌的数量/(CFU/g);α值取0.6,β值取1.3×106。计算预测因摄入被致病性副溶血性弧菌污染的三文鱼可能患病的风险,以及基于上海市居民每年三文鱼总的消费量,进而推算出上海市每年因摄入被致病性副溶血性弧菌污染的三文鱼而患病的人数。
2 结果与分析
2.1副溶血性弧菌在生食三文鱼中的流行情况和污染数量
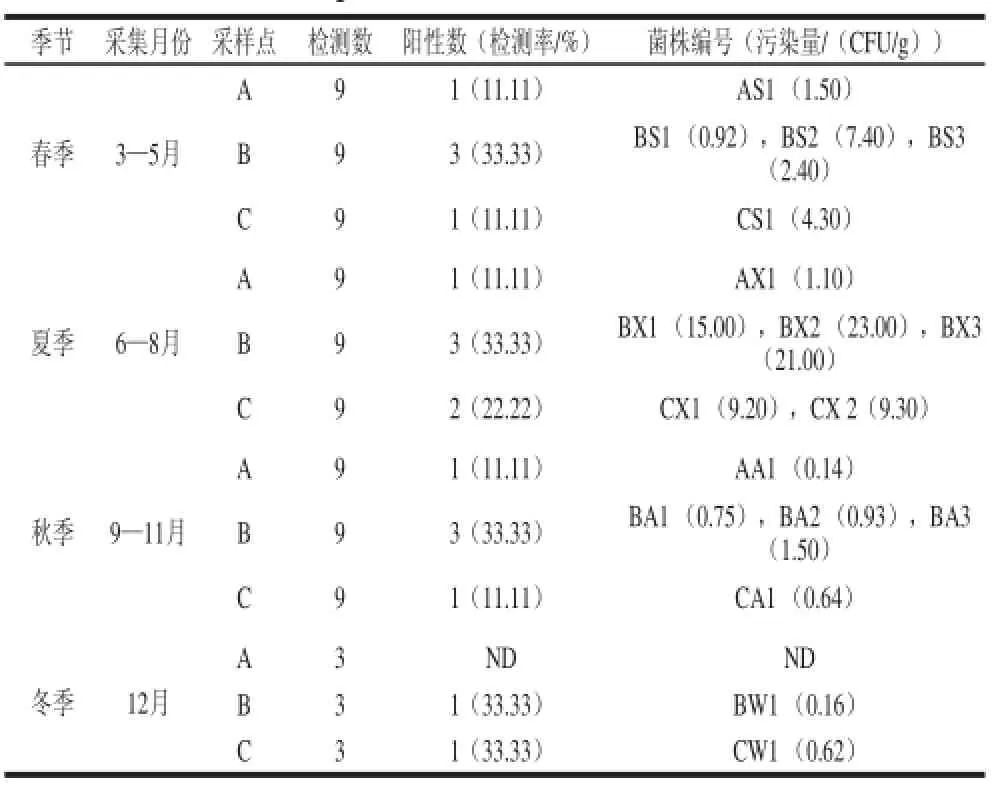
表3 副溶血性弧菌在生食三文鱼中的污染情况和污染水平Table 3 The incidence and level of totalV. parahaemolytiiccuuss in edibllee salmon samples from seafood wholesale market
由表3可以看出,生食三文鱼中副溶血性弧菌的污染率为20.00%(18/90)。通过对3 处批发市场的近一年内的随机抽样检测发现,生食三文鱼中副溶血性弧菌的污染情况有很大差异;批发市场B样品的副溶血性弧菌污染率最高,副溶血性弧菌检出率为33.30%;批发市场A样品的副溶血性弧菌污染率最高,副溶血性弧菌检出率为10.00%。同一批发市场,在不同季节、月份中检出率也有差异,如从批发市场A和C一些月份的样品中没有检测出副溶血性弧菌,这表明副溶血性弧菌在三文鱼中的流行与季节或者气温没有太大的关联,虽然三文鱼在流通、贮藏过程中要求处于冷冻状态[20](即必须在-2 0 ℃),但在销售过程中为冰鲜状态(大约0~4 ℃),乃至冷藏状态(约10 ℃),同时由于大部分摊主不仅仅销售三文鱼,因此交叉污染不可避免,交叉污染可能是引起三文鱼污染的主要原因,通过采样时对市场卫生环境和销售人员的对比批发市场A的卫生情况和处理三文鱼的规范程度最好,因此在不同的批发市场中污染率差异很大。
同时由表3可发现,不同季节内的三文鱼中通过MPN法检测的副溶血性弧菌污染量存在一定差异,在夏季副溶血性弧菌污染量相对来说比较大,而在冬季较低。这表明环境温度还是影响了副溶血性弧菌的流行,这可能一方面因为三文鱼在销售过程中没有很好控制三文鱼的温度,在已经销售了相当一段时间,可能积累了一定数量的副溶血性弧菌;另外副溶血性弧菌交叉污染的机会更大。
2.2致病性副溶血性弧菌的检出率
本研究中含tdh毒力基因的副溶血性弧菌检出概率为1.10%(1/90,菌株CA1),没有检测出含trh毒力基因的菌株。含致病性毒力基因(tdh和trh)菌株的概率用于下步的风险分析。副溶血性弧菌的致病因子主要有溶血毒素、尿素酶和黏附因子,一般认为溶血毒素起到主要的致病作用;溶血毒素主要有耐热直接溶血素(thermostable direct hemolysin,TDH)、耐热直接溶血素相关溶血毒素(TDH-related hemolysin,TRH)及不耐热溶血素(hermolabile hemolysin,TLH)[21]。目前认为,TDH和TRH是与副溶血性弧菌致病性密切相关的因子;其中TDH因子能在血平板上引起β溶血,是主要毒力因子。因此,tdh和trh基因与副溶血性弧菌的致病能力关系密切,检测副溶血性弧菌的tdh和trh毒力基因,间接表明致病性副溶血性弧菌的流行,对食品安全的评估及食源性疾病的流行病学调查有非常重要的指导意义。
2.3副溶血性弧菌多样性分析
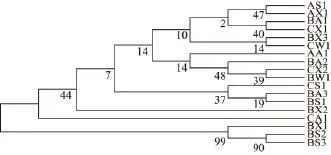
图 1 基于16S rDNA基因建立的18 株副溶血性弧菌系统发育Fig.1 Phylogenic tree of 18 V. parahaemolyticus based on 16S rDNA gene sequence
通过图1可以发现,18 株菌株分为18 个等位基因类型,表明分离到的18 株野生菌株为不同亚型的菌株,具有典型的菌株多样性;同时18 株菌株分为12 个类群,在这12 类群中,只有4 个类群的菌株为同一采集地点分离出的菌株,这也表明了污染三文鱼的副溶血性弧菌其污染源不同。野生菌株多样性及来源分析进一步表明,三文鱼在销售环节受到污染可能性最大。
16S rDNA基因存在于所有细菌,认为是评价细菌演化史的较好标记物,无数的研究已证明16S rDNA基因的高变区序列可确定单一的细菌种或在一定数量下区分不同的种或属[22-24]。27F和1492R或1525R引物,是扩增或克隆16S rDNA基因的理想引物[25-26]。
2.4三文鱼中副溶血性弧菌的风险分析
通过基于GB/T 4789.7—2008 MPN方法对生食三文鱼中副溶血性弧菌的污染进行了调查,使用@Risk进行了三文鱼中副溶血性弧菌的污染量的拟合,分布为Normal (6.007 8, 7.227 7),污染平均值为6.00 CFU/g(图2)。经分析致病性副溶血性弧菌检出概率为1.11%,该数值用于副溶血性弧风险分析。用于生食三文鱼中副溶血性弧菌风险分析的其他数据参考表3所列的文献报道。

图 2 三文鱼中副溶血性弧菌污染量的拟合分布Fig.2 The distribution of V. parahaemolyticus contamination in salmon
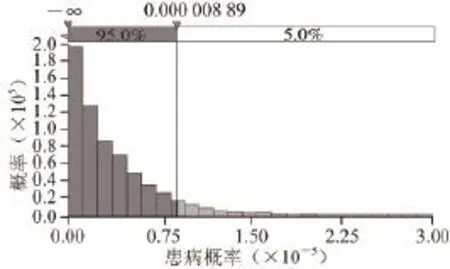
图 3 上海市居民生食三文鱼因副溶血性弧菌污染可能患病的概率Fig.3 The probability of illness among Shanghai citizens caused by V. parahaemolyticus in edible raw salmon
通过评估发现上海市居民通过食用三文鱼可能患病的概率为2.05×10-6(患病最大概率为2.86×10-5,患病最小概率为0,患病的平均概率为2.05×10-6)(图3),即每百万人有2 人发病。上海市居民每年因食用污染了副溶血性弧菌的三文鱼的患病人数为111 人(预测的最大患病人数为703 人,最少患病人数为0 人,平均患病人数为111 人)(图4)。
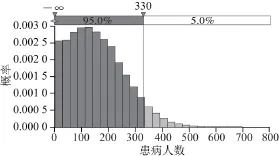
图 4 上海市居民每年生食三文鱼因副溶血性弧菌污染可能患病的人数Fig.4 The number of illness among Shanghai citizens caused by V. parahaemolyticus in edible raw salmon
刘弘等[16]研究表明,生食三文鱼片时在食用前在常温条件下存放1 h后,9—11月份的平均发病概率为最高,为8.71×10-6,按照上海市常驻人口1 921.32万和每月月消费0.13 次的消费频次,上海市9—11月份预期发病人数22 人,上海市每年消费污染了副溶血性弧菌的生食三文鱼片病例数为108 人;其对生食三文鱼片的最终人群预期发病概率进行敏感度分析,结果显示,每年1—5月生食三文鱼片平均每次食用量是相关系数最大的影响因素,6—11月,生食三文鱼片中副溶血性弧菌的污染量是相关系数最大的影响因素。本研究基于上海市三文鱼消费的总量,估算出上海市每年因食用了副溶血性弧菌污染的三文鱼的发病人数为111 人,与刘弘等[16]的研究数据差别不大。
风险分析中的不确定性主要有:对生食三文鱼中副溶血性弧菌污染的风险分析中,因考虑到从采样到分离时的间隔,把检测到的三文鱼中副溶血性弧菌的污染量,作为食用时副溶血性弧菌的可能污染量;没有进一步探讨在污染量的基础上因不同季节温度、放置时间等可能引起的暴露量的改变。生食三文鱼的每次的消费量基于文献报道的数据,同时每年消费的可能与调查与污染量的不匹配,都存在一定的不确定性,本研究中上海市居民生食三文鱼每年总共的消费量是根据相关报道得到[17]。研究中主要分析了从批发零售-消费阶段中副溶血性弧菌的风险,而没有考虑零售前食物链的各个环节;虽然采用模拟的方法有助于对各相关因素不确定性、变异性的量化描述,但采用的剂量-反应关系以及部分模型参数都是应用国内外的文献资料,与上海地区的情况存在差异。但本研究从一个侧面表明了目前上海市生食三文鱼时副溶血性弧菌的风险。
通过对生食三文鱼中副溶血性弧菌污染的风险评估结果表明,上海市居民因生食三文鱼发生的副溶血性弧菌中毒发病概率比较低。
3 结 论
本研究系统调查了上海市3 个主要水产品批发市场中副溶血性弧菌在三文鱼中的流行情况,并进行了定量风险评估。研究结果表明副溶血性弧菌的平均污染率为20.00%,致病性副溶血性弧菌的流行概率约为1.10%,食用三文鱼可能患病的概率为2.02×10-6,上海市居民每年因食用污染了副溶血性弧菌的三文鱼的患病人数为111 人。生食三文鱼因副溶血性弧菌引起的发病概率,按照相关性排序生成的相关图形表明,每次三文鱼摄入量对发病概率影响最大;而因副溶血性弧菌引起的发病人数,却与三文鱼中副溶血性弧菌的污染量最为相关。
通过本研究,建议在三文鱼流通及销售过程中保持冷冻状态,因市场环境因素销售中要避免交叉污染;购买后避免放置时间过长,每次食用量不要太大,尤其在夏天购买时更需注意尽量保持低温状态。
[1]NELAPATI S, NELAPATI K, CHINNAM B K. Vibrio parahaemolyticus: an emerging foodborne pathogen[J]. Veterinary World, 2012, 5(1): 48-63.
[2]刘秀梅, 陈艳, 王晓英, 等. 1992—2001年食源性疾病暴发资料分析:国家食源性疾病监测网[J]. 卫生研究, 2004, 23(6): 725-727.
[3]毛雪丹, 胡俊峰, 刘秀梅. 用文献综述法估计我国食源性副溶血性弧菌病发病率[J]. 中华疾病控制杂志, 2013, 17(3): 265-267.
[4]SCALLAN E, HOEKSTRA R M, ANGULO F J, et al. Foodborne illness acquired in the united states-major pathogens[J]. Emerging Infectious Diseases, 2011, 17(1): 7-15.
[5]高培. 生食水产品食用安全性研究[J]. 食品研究与开发, 2005, 26(5):202-205.
[6]宫春波, 王朝霞, 刘磊, 等. 烟台市生食水产品中副溶血弧菌污染调查及风险评价[J]. 食品安全质量检测学报, 2014, 5(11): 3758-3763. [7]曲立, 范兆廷, 刘雄. 漫谈三文鱼[J]. 黑龙江水产, 2004(4): 3-5.
[8]清早. 话说三文鱼[J]. 海洋世界, 2004(7): 16-17.
[9]包春莹, 赵亚辉. 鲑鱼、鳟鱼、三文鱼、大麻哈鱼之间是什么关系,如何区分?[J]. 科学世界, 2014(3): 103.
[10] 汤志荣, 张磊, 滕迪云. 上海市生食水产品安全监管研究[J]. 上海食品药品监管情报研究, 2012(6): 18-21.
[11] CRISAFI F, DENARO R, GENOVESE M, et al. Comparison of 16S rDNA and toxR genes as targets for detection of Vibrio anguillarum in Dicentrarchus labrax kidney and liver[J]. Research in Microbiology,2011, 162(3): 223-230.
[12] BEI A K, PATTERSON D P, BRASHER C W, et al. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh[J]. Journal of Microbiological Methods, 1999, 36(3): 215-225.
[13] NISHIBUCHI M, HILL W E, ZON G, et al. Synthetic oligodeoxyribonucleotide probes to detect Kanagawa phenomenonpositive Vibrio parahaemolyticus[J]. Journal of Clinical Microbiology,1986, 23(6): 1091-1095.
[14] 卫生部. GB/T 4789.7—2008 食品卫生微生物学检验: 副溶血性弧菌检验[S]. 北京: 中国标准出版社, 2008.
[15] HALL B G. Building phylogenetic trees from molecular data with MEGA[J]. Molecular Biology and Evolution, 2013, 30(5): 1229-1235.
[16] 刘弘, 罗宝章, 秦璐昕, 等. 生食三文鱼片副溶血性弧菌污染的定量风险评估研究[J]. 中国食品卫生杂志, 2012, 24(1): 18-22.
[17] 袁道亮.上海三文鱼市场情况调研[EB/OL]. (2010-06-06). http:// www.zjshfa.org/NewsDetails.asp?ID=72.
[18] 陈艳, 刘秀梅. 福建省零售生食牡蛎中副溶血性弧菌的定量危险性评估[J]. 中国食品卫生杂志, 2006, 18(2): 103-107.
[19]US Food and Drug Administration. Quantitative risk assessment on the public health impact of pathog enic Vibrio parahaemolyticus in raw oysters[R]. Washington: FDA, 2005.
[20] 萧扬, 王锡昌. 如何放心食用生鱼片[J]. 食品与生活, 2014(9): 23.
[21] BISHA B, SIMONSON J, JANES M, et al. A review of the current status of cultural and rapid detection of Vibrio parahaemolyticus[J]. International Journal of Food Science and Technology, 2012, 47(5): 885-899.
[22] van de PEER Y, CHAPELLE S, de WACHTER R. A quantitative map of nucleotide substitution rates in bacterial rRNA[J]. Nucleic Acids Research, 1996, 24(17): 3381-3391.
[23] WOESE C R. Bacterial evolution[J]. Microbiological Reviews, 1987,51(2): 221-271.
[24] PETTI C A, POLAGE C R, SCHRECKENBERGER P. The role of 16S rRNA gene sequencing in identification of microorganisms misidentified by conventional methods[J]. Journal of Clinical Microbiology, 2005, 43(12): 6123-6125.
[25] LILLO A, ASHLEY F P, PALMER R M, et al. Novel subgingival bacterial phylotypes detected using multiple universal polymerase chain reaction primer sets[J]. Oral Microbiology and Immunology,2006, 21(1): 61-68.
[26] SUZUKI M T, GIOVANNONI S J. Bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR[J]. Applied and Environmental Microbiology, 1996, 62(2): 625-630.
Risk Analysis of Vibrio parahaemolyticus in Edible Raw Salmon Marketed in Shanghai
LIU Haiquan1,2, LIU Bingxuan1, LÜ Liqun2, PAN Yingjie1, XIE Jing1, ZHAO Yong1,*
(1. Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation (Shanghai),Ministry of Agriculture, Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation,College of Food Science and Technology, Shanghai Ocean University, Shanghai201306, China;2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai201306, China)
This study aimed to investigate the hygiene of edible raw aquatic products and to provide a theoretical basis for analysis and regulation of food safety in Shanghai. The contamination status of Vibrio parahaemolyticus in edible raw salmon was studied according to the national standard method GB/T 4789.7—2008. Ninety samples of edible raw salmon were collected from three wholesale markets in 2013, out of which, V. parahaemolyticus was detected in nineteen (20.00%) samples and the pathogenic V. parahaemolyticus was detected in one (1.10%) sample. Phylogenic analysis of 18 V. parahaemolyticus was conducted based on the nucleotide sequence data for the 16S rDNA gene using MEGA software. The risk of V. parahaemolyticus in edible raw salmon was analyzed by software @Risk 5.5, Beta-Poisson dose-response model and Monte Carlo simulation. The predicted probability of morbidity associated with the consumption of raw salmon contaminated by V. parahaemolyticus in Shanghai was 2.02 × 10-6, i.e. aproximately 2 cases out of every million people,and the number of patients infected due to the consumption of edible raw salmon contaminated by V. parahaemolyticus was 111 people each year according to the average total consumption of salmon. The health risk of consumption of raw salmon contaminated by V. parahaemolyticus in Shanghai was low. Controlling the level of V. parahaemolyticus in edible raw salmon and the amount of consumption is the key approach to reducing the health risk of consumption of raw salmon contaminated by V. parahaemolyticus.
edible raw salmon; Vibrio parahaemolyticus; risk analysis; food safety
TS201.6
A
1002-6630(2015)24-0195-05
10.7506/spkx1002-6630-201524036
2015-02-03
国家自然科学基金面上项目(31271870);上海市科委计划项目(14DZ1205100;14320502100;12391901300);上海市科技兴农重点攻关项目(沪农科攻字2014第3-5号);上海水产品加工及贮藏工程技术研究中心项目(11DZ2280300)
刘海泉(1980—),男,博士研究生,研究方向为食品安全。E-mail:hqliu@shou.edu.cn
赵勇(1975—),男,教授,博士,研究方向为食品安全。E-mail:yzhao@shou.edu.cn

