牡蛎酶解产物与还原糖美拉德反应工艺优化及挥发性风味物质分析
袁 林,查锋超,姚 烨,韩凯宁,刘 敏,董士远(中国海洋大学食品科学与工程学院 水产品高值化利用实验室,山东 青岛 266003)
牡蛎酶解产物与还原糖美拉德反应工艺优化及挥发性风味物质分析
袁 林,查锋超,姚 烨,韩凯宁,刘 敏,董士远*
(中国海洋大学食品科学与工程学院 水产品高值化利用实验室,山东 青岛266003)
目的:对影响牡蛎酶解产物与还原糖美拉德反应产物(Maillard reaction products of oyster enzymatic hydrolysates and reducing sugar,MRPs-OEH)风味的因素进行优化,得出最佳的美拉德反应条件,并对其风味进行评价。方法:以感官评分为指标,通过Box-Behnken响应面法优化牡蛎酶解产物与还原糖的美拉德反应条件,根据单因素试验结果,采用响应面分析法确定最优工艺参数,采用电子鼻和气相色谱-质谱联用技术对新鲜牡蛎(fresh oyster,FO)、牡蛎酶解产物(oyster enzymatic hydrolysates,OEH)和最优工艺条件下制备的牡蛎美拉德反应产物(optimal Maillard reaction products of oyster enzymatic hydrolysates and reducing sugar,OMRPs-OEH)的风味物质进行比较分析。结果:牡蛎酶解产物与还原糖美拉德反应的最适条件为反应时间29.43 min、反应温度114.62 ℃、反应初始pH 6.97、OEH与还原糖(木糖-葡萄糖质量比2∶1)质量比1∶1,在此条件下MRPs-OEH的综合感官评分为20.88,和预测值20.25比,相对误差约为3.08%。进一步用气相色谱-质谱联用技术对FO、OEH和OMRPs-OEH的风味物质进行分析,分别检出30、36 种和45 种风味化合物。OEH中的主要挥发性成分如癸醛、壬醛、正辛醛、(Z)-2-癸烯醛等,使牡蛎酶解液呈现出腥味、哈喇味和油脂味,经过美拉德反应后,主要挥发性成分变成二甲基三硫醚、二甲基二硫醚、(Z)-4-庚烯醛等,它们综合体现了OMRPs-OEH的贝香味、肉香味和海鲜味,同时产生了一些吡嗪类物质,赋予了其一些坚果-肉香味。结论:美拉德反应不仅改善了牡蛎酶解产物的风味,也为新型牡蛎调味品的开发提供了依据,具有极大的经济和社会价值。
牡蛎;美拉德;响应面;电子鼻;气相色谱-质谱联用.
spectrometry (GC-MS)
牡砺是世界上第一大养殖贝类,也是我国四大养殖贝类之一,它肉味鲜美,营养丰富,被称为“海洋牛奶”,牡砺肉中必需氨基酸完全程度和质量比例优于牛乳和人乳[1],同时因为它富含牛磺酸,所以又有着独特的药用价值[2]。但是,研究[3-4]表明,由于酶解过程中牡蛎脂质的氧化降解以及蛋白质降解,使得牡蛎酶解液的腥苦味较重,风味较差,影响食用。美拉德反应是非酶促褐变反应之一,主要是指羰基化合物(如葡萄糖)和氨基化合物(如氨、氨基酸、肽和蛋白质等)之间进行的一类氨基羰基的加成、缩合、环化和聚合等的非酶促反应,又称羰胺反应,它能赋予食品独特的风味和色泽[5]。张陆霞等[6]以鳕鱼排为原料,添加木糖、葡萄糖,在110 ℃加热90 min,制得的美拉德反应产物具有醇厚的海鲜风味;郑捷等[7]以虾下脚料为原料,采用风味蛋白酶和碱性蛋白酶1∶1复合,酶解后,以酶解液为原料,在pH 7.0、温度110 ℃条件下反应30 min,再经过与其他辅料调配,得到的复合调味料香味浓郁,虾味鲜美。然而,利用美拉德反应制备牡蛎风味调味品的研究还比较少,且美拉德反应受较多因素的影响,反应体系的pH值、温度、加热时间、各种物质的添加量都会对香味产生影响[8-9],所以本研究通过响应面法对影响牡蛎肽与还原糖美拉德反应产物风味的因素进行优化,得出最佳的美拉德反应条件,其次通过电子鼻和气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术对新鲜牡蛎(fresh oyster,FO)、牡蛎酶解产物(oyster enzymatic hydrolysates,OEH)、OEH与还原糖的美拉德反应产物(Maillard reaction products of OEH and reducing sugar,MRPs-OEH)的风味物质进行分析,旨在为新型牡蛎调味品的研究及开发利用提供参考。
1 材料与方法
1.1材料与试剂
太平洋牡蛎(软体组织平均质量(15±5) g)青岛齐东路水产市场;Alcalase酶美国Sigma公司;其他化学试剂均为分析纯。
1.2仪器与设备
DS-1高速组织捣碎机上海标本模型厂;GL-G-Ⅱ立式冷冻离心机上海安亭科学仪器厂;DF-101S恒温加热磁力搅拌器郑州长城科工贸有限公司;DU-20G电热恒温油浴锅金坛市天竟实验仪器厂;GC6890-
5973MSD GC-MS仪美国安捷伦公司;固相微萃取(solid phase micro extraction,SPME)萃取头30~50 μm聚二甲基硅氧烷/聚二乙烯基苯美国Supelco公司;PEN3型便携式电子鼻德国Asrinese公司。
1.3方法
1.3.1感官评定

表1 牡蛎美拉德反应产物风味评价标准Taabbllee 11 CCrriitteerriiaa ffoorr ffl l aavvoorr eevvaalluuaattiioonn ooff MMaaiillllaarrdd rreeaaccttiioonn pprroodduuccttss
8 位感官评定员(4 男4 女),23~25 岁之间,系统学习过感官评定课程,有丰富的感官评定经验,综合牡蛎肽美拉德反应产物的滋味、气味和外观,按表1标准给出评分。感官评价时温度为室温(25 ℃),样品随机编号,感官评价最后得分为平均值。
1.3.2OEH的制备[10]
牡蛎软体组织洗净后打浆,料液比为1∶3(g/mL),调节pH值至8.0,按蛋白含量的0.3%添加Alcalase蛋白酶,55 ℃酶解0.5 h后置于沸水中灭酶10 min。5 000 r/min离心10 min后取上清液,将上清液冷冻干燥,得到OEH粉末。
1.3.3单因素试验
1.3.3.1反应时间的影响
将油浴锅温度控制在115 ℃,按照木糖-葡萄糖质量比1∶1添加还原糖,OEH-还原糖质量比1∶1,调节反应初始pH 7.0,控制反应时间分别为10、20、30、40、50、60、70、80、90、120 min进行美拉德反应。
1.3.3.2反应温度的影响
按照木糖-葡萄糖质量比为1∶1添加还原糖,OEH-还原糖质量比为1∶1,调节反应初始pH 7.0,油浴锅温度为105、110、115、120 ℃和125 ℃,反应30 min。
1.3.3.3pH值的影响
将油浴锅温度控制在115 ℃,按照木糖-葡萄糖质量比1∶1添加还原糖,OEH-还原糖质量比为1∶1,调节反应初始pH值分别为6.0、6.5、7.0、7.5和8.0,控制反应时间30 min进行美拉德反应。
1.3.3.4OEH-还原糖质量比的影响
将油浴锅温度控制在115 ℃,按照木糖-葡萄糖质量比1∶1添加还原糖,使OEH-还原糖质量比分别为3∶1、2∶1、1∶1、1∶2和1∶3,调节反应初始pH 7.0,控制反应时间30 min进行美拉德反应。
1.3.3.5还原糖配比的影响
将油浴锅温度控制在115 ℃,使木糖-葡萄糖质量比分别为3∶1、2∶1、1∶1、1∶2和1∶3,OEH-还原糖质量比为1∶1,调节反应初始pH 7.0,控制反应时间30 min进行美拉德反应。
1.3.4Box-Behnken试验设计[11]
在单因素试验基础上,根据Box-Behnken试验设计原理,以感官风味评价分值为指标,设计三因素三水平响应面分析试验,数据用Design-Expert软件统计,确定最优美拉德反应的工艺参数。因素水平如表2所示。

表2 因素与水平表Taabbllee 22 FFaaccttoorrss aanndd lleevveellss uusseedd iinn rreessppoonnssee ssuurrffaaccee eexxppeerriimmeennttss
1.3.5电子鼻的分析测定[12-13]
取OEH和OMRPs-OEH 2 mL(绞碎后的FO 2 g)置于50 mL进样瓶中,20~25 ℃密封一段时间进行顶空气体生成,采用顶空抽样的方法进行取样并检测。电子鼻在取样的同时获取并记录数据,每秒记录1 个数据点,采样时间为60 s,采样后,WinMaster软件自动控制对传感器阵列进行清洗,清洗时间为90 s,电子鼻所获得的数据有2 种形式,其一为样品气体通过传感器阵列时各传感器的电阻值R;其二为样品气体通过传感器阵列时,传感器的电导率G0与基准气体通过时传感器的电导率G0的比值,即响应值G/G0。
1.3.6挥发性气体成分的测定[14]
顶空SPME条件:将4 mL OEH和2 mL OMRPs-OEH(或2 g FO)装在20 mL SPME专用瓶中,60 ℃萃取30 min。萃取结束后立即将萃取针插入进样口(250 ℃)中解吸4 min。萃取头在首次使用时需250 ℃老化1 h。
GC条件:HP-5毛细管色谱柱(5%苯基,95%聚二甲基硅氧烷)规格:30 m×0.32 mm,0.25 μm;载气为高纯氦气(99.999%),氦气流速1.0 mL/min;不分流进样,进样口温度:250 ℃;柱温:初温40 ℃恒温3 min,以6 ℃/min升至200 ℃,再以10 ℃/min升至250 ℃,保持10 min。
MS条件:电离源为电喷雾电离,离子阱温度150 ℃,GC-MS传输线温度250 ℃,质量扫描范围33~300 u,扫描速率0.220 s/scan。电喷雾电离电子能量70 eV。
利用Agilent G1701 MSD Productivity ChemStation增强型数据分析工作站NIST05a Libraries标准谱库自动检索各组分质谱数据,选择匹配度大于80(满分100)作为鉴定结果。用峰面积归一化法确定物质的相对含量。
1.3.7主成分分析(principal component analysis,PCA)法[15-16]
某一种物质是否对风味产生很大影响不仅要看其含量还要分析其阈值,即挥发性化合物对于样品总体风味的贡献由其在风味体系中浓度和阔值共同决定的,因此,本研究通过采用气味活度值(odor activity value,OAV)评价各化合物对样品总体风味的贡献,计算如式(1)所示:式中:C为物质含量/(mg/kg);T为感觉阈值/(mg/kg)。若OAV<l,说明该物质对总体风味无实际作用;OAV>1,说明该物质可能对总体风味有直接影响;且在一定范围内,OAV越大说明该物质对总体风味贡献越大。

由于所研究样品往往包含几十甚至上百种挥发性化合物,绝对定量几乎不可能。因此,食品风味研究领域一般用化合物的相对含量Cr代替绝对含量进行分析,即Cr≈C,各化合物的相对含量可以通过峰面积归一化法计算得到。
为了便于分析本实验通过计算化合物的相对气味活度值(relative odor activity value,ROAV)的方法来评价该物质对样品总体风味的贡献。计算如式(2)、(3)所示:

即:
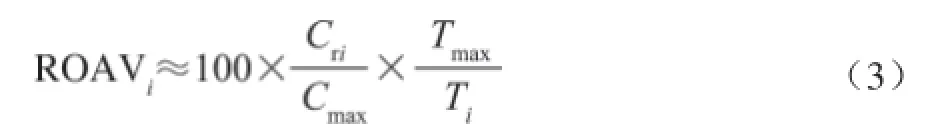
式中:Cri、Ti分别是各化合物的相对含量/(mg/kg)和感觉阈值/(mg/kg);Cmax、Tmax是对总体风味贡献最大的组分的相对含量/(mg/kg)和相应的感觉阈值/(mg/kg)。
显然,所有组分均满足0<ROAV≤100,且ROAV越大的组分对样品总体风味的贡献也越大,其中ROAV≥l的物质为所分析样品的主体风味成分,而0.1≤ROAV<l的物质对样品总体风味也具有比较重要的贡献。
2 结果与分析
2.1美拉德反应工艺参数的单因素试验结果
2.1.1反应时间的确定
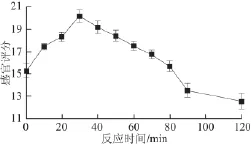
图1 反应时间对MRPs-OEH风味的影响Fig.1 Effect of reaction time on MRPs-OEH fl avor
由图1可知,当反应时间短于30 min时,由于反应不充分,产生的风味不够浓郁。当反应时间超过30 min,甚至更长时间时,产品产生明显的焦糊味和其他杂味。反应时间为30 min时,感官评分达20.18,产品的风味最好,因此确定最佳反应时间为30 min。反应时间是影响美拉德反应的重要因素之一,较短的反应时间内,生成的反应产物含量较少,而随着反应时间的延长,体系中产物的含量会增加,同时产生的风味物质的种类也会随之增加,但是当体系的反应温度过高时,反应会急速加快,使得体系中形成大量的终产物类黑精,甚至是致癌物质,因此要合理的控制反应温度[17-18]。
2.1.2反应温度的确定
反应温度是美拉德反应一个非常重要的因素[19-20]。从图2可看出,当反应温度为115 ℃时,感官评分达19.13,MRPs-OEH的风味最好。温度过低时,MRPs-OEH的腥苦味去除的不明显,这是由于反应程度不够,产生的香气不够浓郁,使得产品原有的腥味突显出来;随着温度的升高,反应速率加快,同时也会促成许多香味物质的生成。但温度过高时,MRPs-OEH带有明显的焦苦味,这是由于产物中杂味物质增多,带来了一些不利的风味。因此确定最佳反应温度为115 ℃。

反应温度对MRPs-OEH风味的影响Fig.2 Effect of reaction temperature on MRPs-OEH fl avor
2.1.3pH值的确定

图3 pH值对MRPs-OEH风味的影响Fig.3 Effect of pH on MRPs-OEH fl avor
pH值是影响美拉德反应的重要因素之一,它不仅影响到原料的离解状态和生成物种类,还会直接影响美拉德反应进程[21-22]。从图3可看出,当pH值为7.0时,感官评分达19.14,MRPs-OEH的风味最好。pH值过低会带来一定的酸味,这是因为在低pH值条件下氨基呈质子化,不能很好地与还原糖的羰基反应,阻碍了美拉德反应的进行,从而得不到大量的芳香类物质;反之,pH值过高反应速率过快,产品会产生明显的焦糊味。总之,pH值太高和太低,反应都向不利于风味物质形成的方向进行。因此确定最佳反应pH值为7.0。
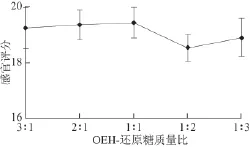
图4 OEH-还原糖质量比对MRPs-OEH风味的影响Fig.4 Effect of ratio of enzymatic hydrolysates to reducing sugar on MRPs-OEH fl avor
2.1.4OEH-还原糖质量比的确定OEH-还原糖质量比对MRPs-OEH的风味也有一定的影响[23],由图4可知,当其配比为1∶1时,感官评分达19.44,MRPs-OEH的风味最好,因此确定最佳的配比为1∶1。
2.1.5还原糖配比的确定

图5 还原糖配比对MRPs-OEH风味的影响Fig.5 Effect of xylose/glucose ratio on MRPs-OEH fl avor
热反应中还原糖是重要的反应物质,还原糖的种类不同美拉德反应液会呈现不同的风味,并且美拉德反应的速率也会不一样,一般情况下在能够发生美拉德反应的几种糖中反应速率最快的是戊糖,其次是己糖,二糖的速率最慢。核糖、木糖、葡萄糖与氨基酸发生美拉德反应均可以产生较好的风味[24-25]。由于核糖的价格较贵,而木糖和葡萄糖价廉易得,因此试验选择葡萄糖和木糖作为还原性糖。由图5可知,木糖-葡萄糖质量比在3∶1、2∶1和1∶1时,产品风味都比较好且相差不大,结合这3 个条件下产品的褐变程度最终决定最佳的还原糖配比为木糖-葡萄糖质量比2∶1,此时感官评分为19.80。
2.2响应面法优化美拉德反应工艺参数
用SPSS软件对各因素进行显著性分析,发现pH值、反应温度、反应时间这3 个因素存在显著性差异,利用软件Design-Expert,分别对其进行Box-Behnken试验设计,设计15 个试验,具体设计组合及试验结果如表3所示。
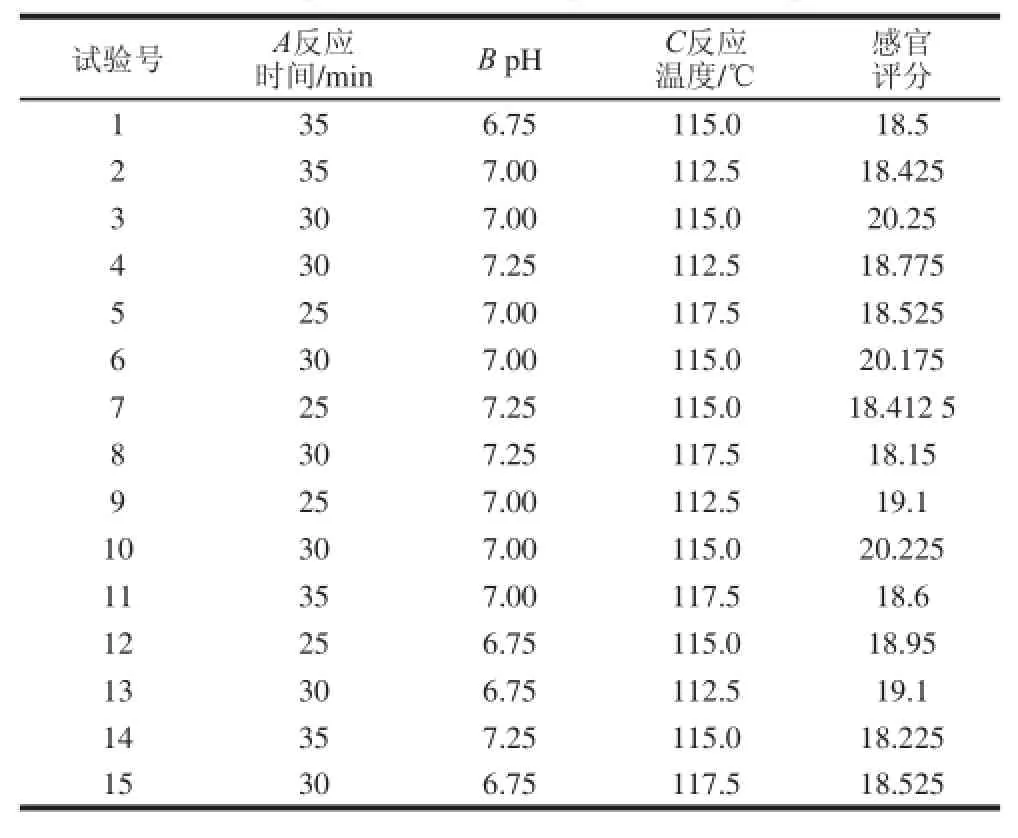
表3 响应面试验数据与结果Table 3 Design and results of response surface experiments

表 4 方差分析表Table 4 Analysis of variance of response surface experiments
由方差分析(表4)可以看出,试验选用的模型极显著(P=0.000 3<0.01),失拟项P=0.051 2>0.05,不显著;模型的校正系数RAdj=0.983 6,表明该模型可以解释98.36%的感官评分的变化;R=0.994 2,表明试验误差小,该模型适合分析美拉德反应条件对产品感官评分的影响。
Design-Expert软件进行三元二次回归拟合,获得响应面自然空间二次多项方程为:感官评分= -2 143.878 12-0.119 69A+192.585 42B+26.079 1C+ 0.052 500AB+0.015 000AC-0.020 000BC-0.033 396A2-13.758 33B2-0.115 08C2。
在回归模型方差分析结果的基础上,根据得到的回归二次方程,利用软件作响应面图,分析各因素的交互作用对感官评分的影响。


图 6 回归模型各因素相互作用的效应图及等高线图Fig.6 Response surface and contour plots showing the effect of reaction conditions on sensory evaluation of MRPs-OEH
如图6a所示,反应时间、pH值对感官评分都是非线性的,因为表面图发生弯曲,所以可以进一步优化,从等高线图看出,沿pH值方向等高线密度要大于沿反应时间方向,说明pH值对响应值峰值的影响大于反应时间。如图6b所示,反应时间、反应温度对感官评分都是非线性的,沿反应温度方向等高线密度要大于沿反应时间方向,说明反应温度对响应值峰值的影响大于反应时间。如图6c所示,pH值、反应温度对感官评分都是非线性的,沿反应温度方向等高线密度要大于沿pH值方向,说明反应温度对响应值峰值的影响大于pH值。
根据Box-Behnken设计原理,采用三因素三水平的响应面分析法,通过对各因素显著性和交互作用的分析,得出牡蛎肽美拉德反应条件为:反应时间29.43 min、反应温度114.62 ℃、反应初始pH 6.97,此时牡蛎肽美拉德反应产物的风味最好,感官评定得分为20.25。
为检验方法的可靠性,采用得到的最优反应条件进行美拉德反应,反应条件为:反应时间29.43 min、反应温度114.62 ℃、反应初始pH 6.97、OEH-还原糖质量比1∶1、还原糖配比(木糖-葡萄糖质量比)2∶1,进行3 组平行实验,得到该条件下的产品感官评分为20.88,和预测值20.25比,相对误差约为3.08%,说明响应面法能较好地对牡蛎美拉德反应的条件进行回归分析和参数优化。
2.3电子鼻的分析
2.3.1PCA结果

图 7 3 组样品的PCAA图Fig.7 Principal component analysis of sample 3
图7为FO、OEH和OMRPs-OEH的PCA,可以看出横轴的贡献率为92.89%,纵轴贡献率为7.08%,在横轴方向各组存在显著性差异,说明这3 种物质的主要挥发性成分显著不同,主要原因是美拉德反应产生了一些芳香性风味物质。
2.3.2传感器的G/G0响应值分析
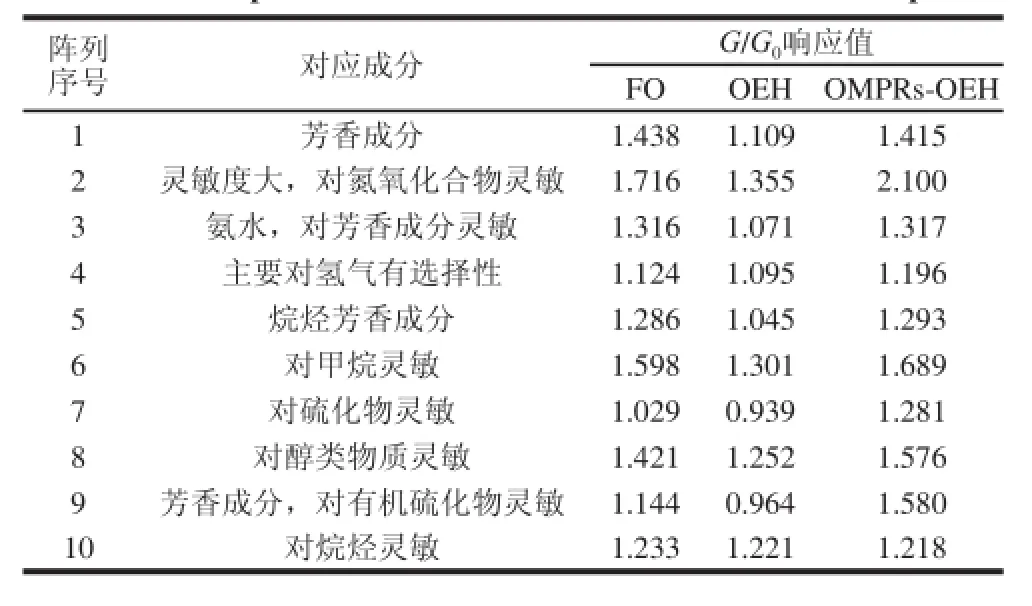
表5 3 组样品的G/G0响应值Taabbllee 55 RReessppoonnssee vvaalluuee ooff eelleeccttrroonniicc nnoossee ttoo tthhee ffl l aavvoorr ooff ssaammppllee 33
表5为3 组样品的G/G0响应值,为了进行更直观的分析以响应值作雷达图,如图8所示。通过分析各样品挥发性成分的响应值发现,对于1号和3号传感器的芳香成分,FO和OMRPs-OEH的差别不大,但均显著高于OEH;对于5号传感器的烷烃芳香成分,OMRPs-OEH的响应值略高于FO,显著高于OEH;对于9号传感器,对有机硫化物灵敏的芳香成分,OMRPs-OEH的响应值显著高于FO和OEH。说明美拉德反应产生了一些芳香性的风味物质,有助于改善牡蛎酶解液的风味。
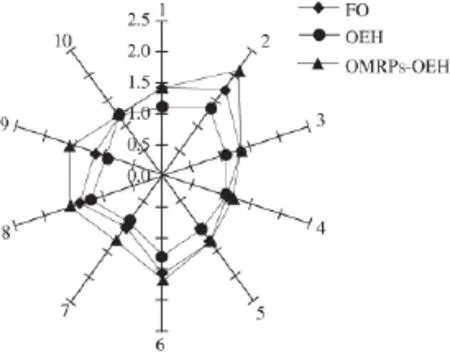
图 8 FO、OEH和OMRPs-OEH的响应值雷达图Fig.8 Response value radar chart of FL, OEH and OMRPs-OEH
2.4挥发性成分的SPME-GC-MS分析
2.4.1样品挥发性气体成分分析
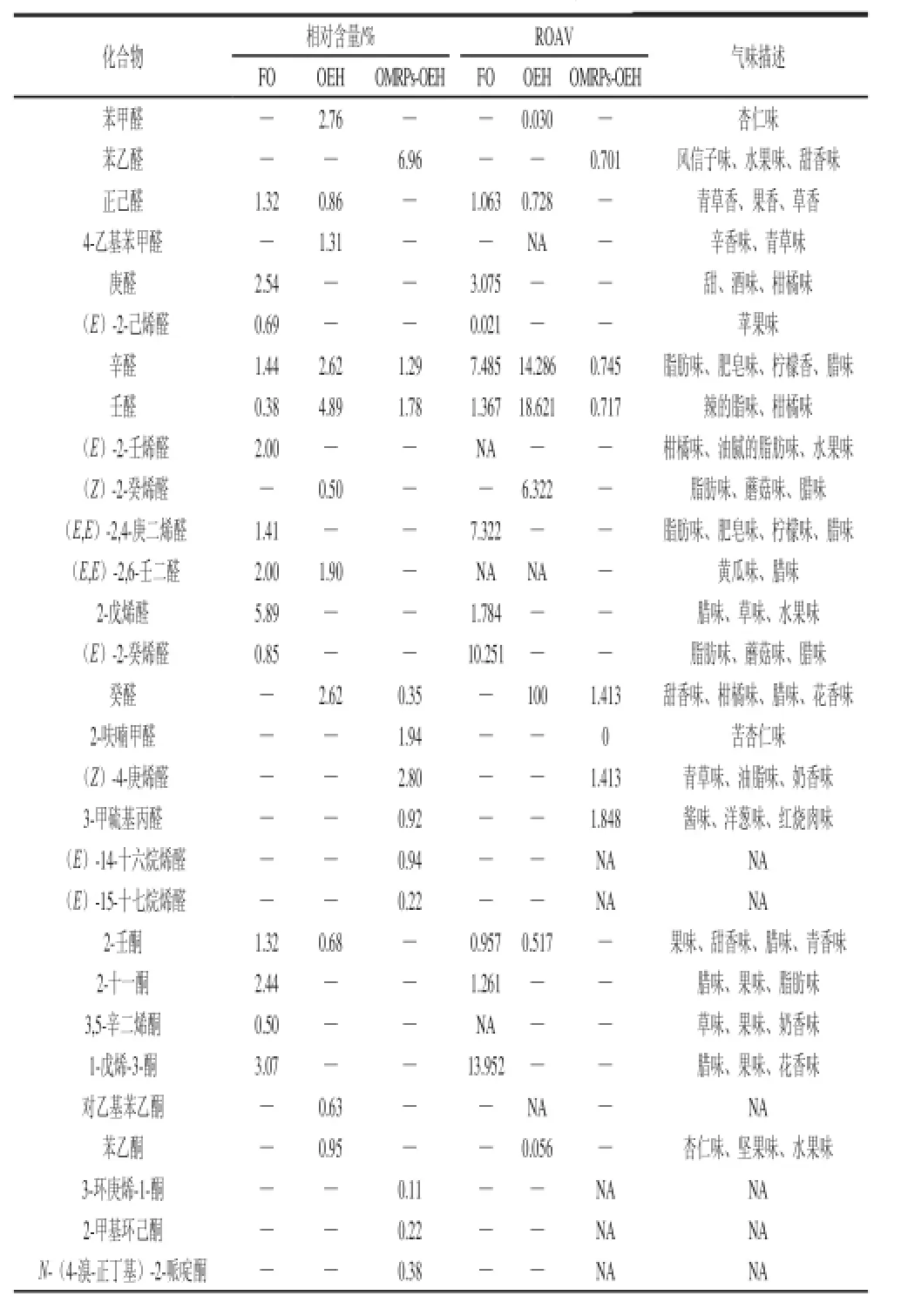
表 6 FO、OEH和OMRPs-OEH挥发性成分分析TTaabbllee 66 AAnnaallyyssiiss ooff vvoollaattiillee ccoommppoouunnddss ooff FFOO, OOEEHH aanndd OOMMRRPPss--OOEEHH
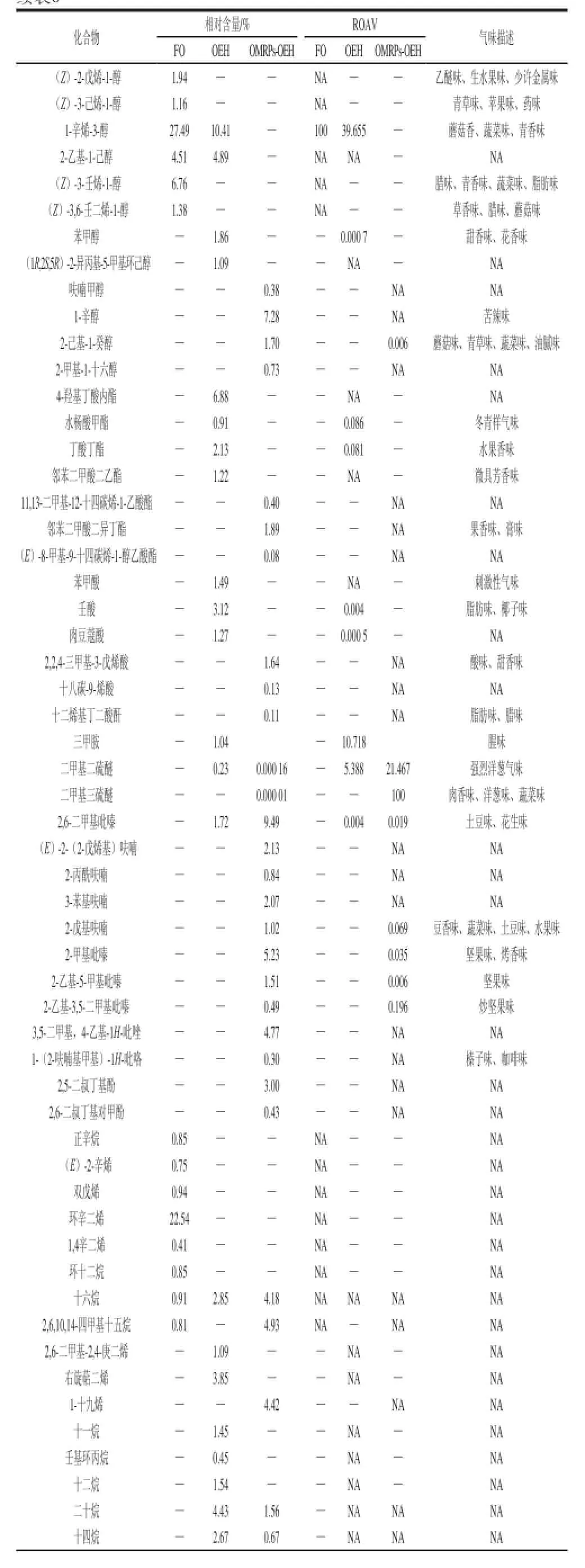
续表6
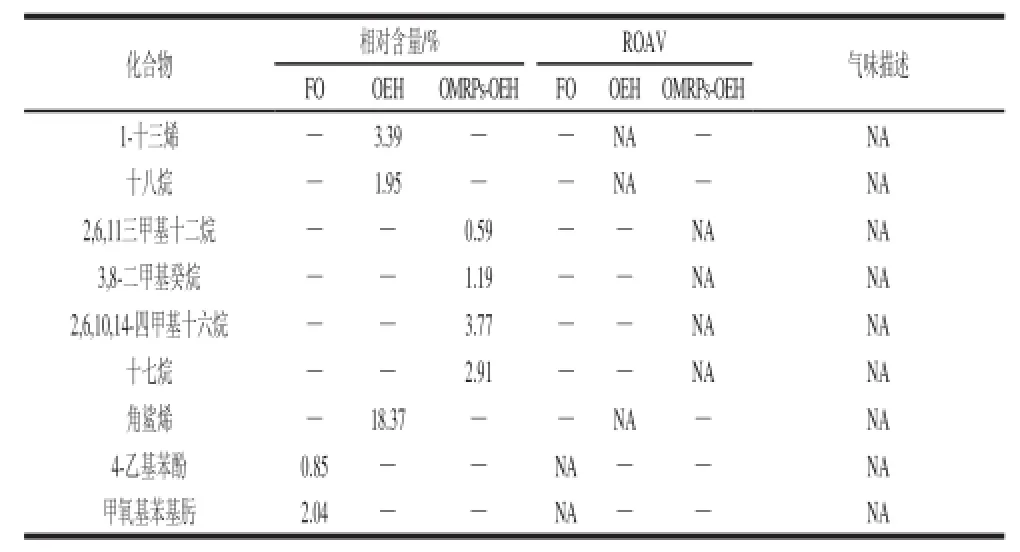
续表6
如表6所示,在FO中,检测到30 种化合物,其中醛类10 种、酮类4 种、醇类6 种、烃类8 种、其他物质2 种。在OEH中,检测到36 种化合物,其中醛类8 种、酮类3 种、醇类4 种、酯类4 种、酸类3 种、吡嗪硫醚类2 种、烃类11 种、其他物质1 种。在OMRPs-OEH中,检测到45 种化合物,其中醛类9 种、酮类3 种、醇类4 种、酯类3 种、酸类3 种、硫醚类2 种、呋喃类4 种、吡嗪类4 种、吡唑类2 种、酚类2 种、烃类9 种。
2.4.2样品主体挥发性成分分析

表 7 FO、OEH和OMRPs-OEH主体挥发性成分分析比较TTaabbllee 77 AAnnaallyyssiiss aanndd ccoommppaarriissoonn ooff tthhee mmaaiinn vvoollaattiillee ccoommppoonneennttss ooff FO, OEH and OMRPs-OEEHH
本实验认为ROAV≥l的物质为所分析样品的主体风味成分,但0.1≤ROAV<l的物质对样品总体风味也具有比较重要的贡献。如表7所示,对于FO而言,ROAV>1的挥发性成分包括1-辛烯-3-醇、1-戊烯-3-酮、(E)-2-癸烯醛、辛醛、(E,E)-2,4-庚二烯醛、2-戊烯醛、壬醛、2-十一酮和正己醛,它们综合体现了新鲜牡蛎特征气味中的类似植物的青草味、蘑菇味、花香、柑橘味;腊味、脂肪味等油脂味。对于OEH而言,ROAV>1的挥发性成分包括癸醛、1-辛烯-3-醇、壬醛、正辛醛、三甲胺、(Z)-2-癸烯醛、二甲基二硫醚,它们综合体现了牡蛎酶解液的腥味、哈喇味、油脂味、蘑菇味、腊味等风味。对于OMRPs-OEH而言,ROAV>1的挥发性成分包括二甲基三硫醚、二甲基二硫醚、3-甲硫基丙醛、(Z)-4-庚烯醛、葵醛,它们综合体现了MRPs-OEH的贝香味、肉香味、油脂味、奶香味和海鲜味,同时产生了一些吡嗪类物质,赋予了OMRPs-OEH一些坚果-肉香味。
OEH经过美拉德反应以后,显著改善了其腥味、哈喇味等不良风味,同时产生了肉香味、奶香味等令人愉悦的气味,这说明美拉德反应是水产调味料去腥增香提鲜的一个重要途径。
3 结 论
通过单因素试验和Box-Behnken试验设计以及响应面分析对牡蛎肽美拉德反应工艺进行了优化,确定其优化工艺条件为反应时间29.43 min、反应温度114.62 ℃、反应初始pH 6.97、OEH-还原糖质量比1∶1、还原糖配比(木糖-葡萄糖质量比)2∶1,并得到了牡蛎肽美拉德反应各因素变量的二次方程,该模型回归显著,对试验拟合良好,具有一定的应用价值。因此,利用响应面法对牡蛎肽美拉德反应进行优化,可获得最优反应条件。
进一步通过电子鼻技术和SPME-GC-MS分析了新鲜牡蛎、OEH和最优条件下的牡蛎美拉德反应产物的挥发性成分,发现OEH经过美拉德反应以后,有效去除了其腥味、哈喇味等不良风味,同时产生了肉香味、奶香味等令人愉悦的气味。本研究为新型牡蛎调味品的研究及开发利用提供了参考。
[1]梦瑶. 海底牛奶: 牡蛎[J]. 中国食品, 2012(21): 64-65.
[2]曾利荣, 张尔贤. 牡蛎的食用与药用价值及其开发利用[J]. 自然杂志, 2005, 20(6): 322-325.
[3]FU Xiangjin, XU Shiying, WANG Zhang. Kinetics of lipid oxidation and off-odor formation in silver carp mince: the effect of lipoxygenase and hemoglobin[J]. Food Research International, 2009, 42(1): 85-90.
[4]张洁, 董士远, 郭晓伟, 等. 美拉德反应用于牡蛎酶解液脱腥的研究[J].食品工业科技, 2009, 30(11): 215-217.
[5]朱国斌. 食品风味原理与技术[M]. 北京: 北京大学出版社, 1996: 75-89.
[6]张陆霞, 管与平, 姜玮, 等. 鳕鱼排蛋白水解及其营养风味美拉德反应产物的制备[J]. 食品与发酵工业, 2010, 36(10): 70-74.
[7]郑捷, 王平, 尹诗, 等. 酶解虾下脚料制备海鲜味复合调味料[J]. 中国调味品, 2011, 36(11): 48-51.
[8]MOTTRAM D S. Thermally generated fl avors[M]. Washington DC: American Chemical Society, 1995: 105-126.
[9]宋焕禄, 孙宝国. 天然肉味香精[J]. 食品与发酵工业, 1999, 25(1): 50-54.
[10] 郭玉华. 牡蛎乳酸菌发酵饮料研制及其免疫活性的研究[D]. 青岛:中国海洋大学, 2008.
[11] HUANG Zhonglian, LIANG Zhenyu, LI Guanjia, et al. Response surface methodology toextraction of dioscoreae polysaccharides and the effects on rat's bonequality[J]. Carbohydrate Polymers, 2011,83(1): 32-37.
[12] 谢安国, 王金水, 渠琛玲, 等. 电子鼻在食品风味分析中的应用研究进展[J]. 农产品加工: 学刊(下), 2011(1): 71-73.
[13] 赵梦醒, 曹荣, 殷邦忠, 等. 电子鼻在对虾新鲜度评价中的应用[J].渔业科学进展, 2012, 32(6): 57-62.
[14] FRATINI G, LOIS S, PAZOS M, et al. Volatile profile of Atlantic shellfish species by HS-SPME GC/MS[J]. Food Research Internat Ional, 2012, 48(2): 856-865.
[15] 刘登勇, 周光宏, 徐幸莲. 金华火腿主体风味成分及其确定方法[J].南京农业大学学报, 2009, 32(2): 173-176.
[16] 刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法: “ROA”法[J]. 食品科学, 2008, 29(7): 370-374.
[17] 吴惠玲, 王志强, 韩春, 等. 影响美拉德反应的几种因素研究[J]. 现代食品科技, 2010, 26(5): 441-444.
[18] 廖劲松, 齐军茹. 脂质对肉类风味的作用[J]. 中国食品添加剂,2002(6): 52-55.
[19] JOUSSE F, JONGEN W, AGTEROF W, et al. Simplified kinetic scheme of flavour formation by the Maillard reaction[J]. Chemistry and Toxicology, 2002, 67(7): 2534-2542.
[20] LAN Xiaohong, LIU Ping, XIA Shuqin, et al. Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system: further insights into thermal degradation and cross-linking[J]. Food Chemistry, 2010, 120(4): 967-972.
[21] AJANDOUZ E H, DESSEAUX V, TAZI S, et al. Effects of temperature and pH on the kinetics of caramelisation, protein crosslinking and Maillard reactions in aqueous model systems[J]. Food Chemistry, 2008, 107(3): 1244-1252.
[22] 孙丽平, 汪东风, 徐莹, 等. 初探pH和加热时间对美拉德反应挥发性产物的影响[J]. 食品工业科技, 2009, 30(4): 122-125.
[23] GU Fenglin, KIM J M, HAYAT K, et al. Characteristics and antioxidant activity of ultrafi ltrated Maillard reaction products from a casein-glucose model system[J]. Food Chemistry, 2009, 117(1): 48-54. [24] BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry, 2005, 93(2): 189-196.
[25] JALBOUT A F, SHIPAR M A H, NAVARRO J L. Density functional computational studies on ribose and glycine Maillard reaction: formation of the Amadori rearrangement products in aqueous solution[J]. Food Chemistry, 2007, 103(3): 919-926.
Optimization of Maillard Reaction for Oyster Enzymatic Hydrolysates and Reducing Sugar by Response Surface Methodology and Analysis of Volatile Flavor Compounds in Reaction Products
YUAN Lin, ZHA Fengchao, YAO Ye, HAN Kaining, LIU Min, DONG Shiyuan*
(High-Value Utilization of Seafood Laboratory, College of Food Science and Engineering,Ocean University of China, Qingdao266003, China)
Objective: To optimize the Maillard reaction conditions for oyster enzymatic hydrolysates and reducing sugar based on sensory evaluation of Maillard reaction products (MRPs). Methods: The optimization was carried out using response surface methodology based on Box-Behnken experimental design. Electronic nose and gas chromatography-mass spectrometry were employed to analyze the volatile fl avor compounds of fresh oyster (FO), oyster enzymatic hydrolysates (OEH), optimal Maillard reaction products from oyster enzymatic hydrolysates and reducing sugar (OMRPs-OEH). Results: The optimal reaction conditions were found as follows: extraction time, 29.43 min; temperature, 114.62 ℃; pH, 6.97; and ratio of enzymatic hydrolysates to reducing sugar (glucose:xylose = 1:2), 1:1. Under these conditions, the experimental value of sensory evaluation score was 20.88, compared to the predicted value of 20.25. The relative error between the experimental and predicted values was 3.08%. A total of 30, 36 and 45 components were identifi ed from FO, OEH and OMRPs-OEH by GC-MS, respectively. The main volatile compounds of OEH were octanal, nonanal, decanal and (Z)-2-decenal, which were responsible for the unpleasant smells such as fi shy, rancid, and oily. After the Maillard reaction, dimethyl disulfi de, trimethyl disulfide and (Z)-4-heptenal became the main volatile compounds, which contributed to the shellfish, meat and seafood fl avors. Meanwhile, pyrazine substances were formed, which were responsible for some nuts-meat fl avors. Conclusions: The Maillard reaction not only can improve fi shy odor of OEH, but also can develop a new oyster fl avoring agent, which has highly economic and social value.
oyster; Maillard reaction; response surface methodology; electronic nose; gas chromatography-mass
2015-04-28
国家自然科学基金面上项目(31270038)
袁林(1990—),女,硕士研究生,研究方向为水产品高值化利用。E-mail:1171652412@qq.com
董士远(1974—),男,副教授,博士,研究方向为水产品高值化利用。E-mail:dongshiyuan@ouc.edu.cn
S986.2
A
1002-6630(2015)24-0001-09
10.7506/spkx1002-6630-201524001

