促性腺激素释放激素抑制剂与促性腺激素释放激素激动剂用于IVF-ET 中正常反应患者的系统性评价及Meta分析
肖劲松,速存梅,曾宪涛
(1.湖北省十堰市湖北医药学院附属太和医院生殖中心,十堰 442000;2.湖北省十堰市湖北医药学院附属太和医院循证医学中心,十堰 442000;3.云南省人口和计划生育科学技术研究所生殖医学治疗中心,昆明 650051)
自从1999年促性腺激素释放激素拮抗剂(Gn-RH-ant)应用于临床已有15 年的经验,GnRH-ant与促性腺激素释放激素激动剂(GnRH-a)方案用于体外受精-胚胎移植(IVF-ET)的有效性及安全性的争论一直持续至今。
GnRH-ant与垂体促性腺激素释放激素受体特异性地结合,能迅速抑制LH 峰,较之GnRH-a长方案使用方便,促排时间短,用药少且无激发效应。Al-Inany 等[1]纳入45个随机对照试验(RCT)系统性评价结果显示:临床妊娠率GnRH-ant方案组显著低于GnRH-a长方案组,持续妊娠率、活产率两组差异无统计学意义;重度卵巢过度刺激综合征(OHSS)发生率GnRH-ant组显著降低。然而,Orvieto等[2]的综述认为持续妊娠率、活产率GnRH-a长方案组显著高于GnRH-ant组,激动剂方案仍然明显优于GnRH-ant方案。Pundir等[3]Meta分析结果显示:中度OHSS发生率GnRH-ant组显著低于GnRH-a长方案组,重度OHSS发生率无统计学差异。
控制性超排卵(controlled ovrian hyperstimulation,COH)是IVF-ET 技术的重要环节,不同COH方案对同一患者往往会产生不同的卵巢反应,卵巢对COH 的反应是影响妊娠结局的重要因素,不同的卵巢反应会对妊娠结局产生不同的影响。上述系统性评价中,仅Al-Inany等[1]对纳入的研究进行了所有患者、低反应、多囊卵巢综合征(PCOS)的亚组分析,在所有患者组中临床妊娠率GnRH-ant组显著低于GnRH-a长方案组,而在低反应、PCOS组中妊娠率两方案无明显差异,提示相同COH 方案对不同卵巢反应的患者可产生不同的妊娠结局。其余文章[2-3]并没有根据患者的不同卵巢反应类型进行分组。上述文章只关注GnRH-ant与GnRH-a方案比较,忽略了患者的特点、不同卵巢反应性对妊娠结局所产生不同影响,因此,难以达成共识。
从患者卵巢反应性预测出发,评价GnRH-ant与GnRH-a方案效果的差异,可能是解决争议的有效途径。本文纳入假定为卵巢正常反应患者的RCT,就 GnRH-ant 与 GnRH-a 长 方 案 用 于IVF-ET促排卵治疗的有效性及安全性进行系统性评价。
资料与方法
一、纳入及排除标准
逐篇阅读文献题目和摘要,剔出明显不符合纳入标准的文献。然后对拟纳入的文献,逐篇阅读全文,根据纳入排除标准确定纳入的文献。所有比较GnRH-ant与GnRH-a 在IVF-ET 中有效性的RCTs,不管是否采用盲法。语言限制在中文及英文。
假定为卵巢正常反应患者的定义:卵巢储备功能是卵巢对COH 的反应性的基础,其预测指标包括基础FSH 值、抗苗勒管激素、抑制素B、窦卵泡计数等。但目前仍然没有一个方法能够准确地测定卵巢储备功能。卵巢的反应性大致分为高反应、正常反应、低反应,3种反应类型目前仍然没有明确的诊断标准,因此,3种反应类型范围的界定是模糊的。另外,凭借目前的手段还难以对卵巢的反应性做出准确的预测。往往界定为正常反应类型的患者在COH 中可表现为上述三种不同反应类型,因此,界定本文所纳入研究中患者为正常反应存在某种程度的假定性。
排除既往有IVF周期卵巢低反应及高反应史,IVF周期数大于3,多囊卵巢综合征(PCOS)及严重子宫内膜异症患者的研究。排除GnRH-ant用于微刺激方案及供卵者的研究;GnRH-ant、GnRH-a与其它促排卵药物比较的研究;无对照的GnRH-ant的研究;与GnRH-ant使用效果无关的研究。
有效性结局指标包括:刺激天数:使用促性腺激素(Gn)的天数;Gn 量;HCG 日E2值;获卵数;HCG 日子宫内膜厚度;临床妊娠率:妊娠数/患者数,超声见宫腔内孕囊同时有胎心搏动确定为临床妊娠;持续妊娠率:超出12孕周的持续妊娠(Pregnancies progressing beyond the 12th week of gestation were considered to be ongoing.);活产率。安全性结局指标包括:OHSS发生率;流产率;周期取消率。
二、检索策略
以“GnRH antagonist,GnRH-ant,GnRHA,GnRH agonist,GnRHa,IVF,Normal responders,Normoresponder”为检索词,计算机检索PubMed(1997~2014 年)、Cochrane Library(~2014 年)、ProQust Medical Libraray(PML)(1997~2014年)、外文生物医学期刊文献数据库(FMJS,2000~2014年)、CBM(1979~2014 年)、CNKI(1994~2014年)。检索时间从建刊截止2014年12月底。并追索已纳入文献的参考文献。
三、资料提取与质量评价
文献数据提取与质量评价由至少两名经训练合格的评价员各自独立完成,并交叉核对,不同意见与第3位评价员讨论解决。
RCT 的质量评价按照Cochrane系统评价员手册5.1.0 版的风险偏倚评估标准[4],包括随机分配方法、隐蔽分组、盲法、结果数据的完整性、选择性报告研究结果、其他潜在影响真实性的因素等6 个方面。
四、统计分析
采用Revman5.1 软件。统计分析参照文献[4]。二分类变量则用比值比(OR)表示;连续变量则用均数差(MD)表示,所有评价指标都给出95%可信区间(CI),检验水准取α=0.05。当I2>50%时,纳入的研究将存在较大的异质性。无统计学异质性的数据采用固定效应模型;有统计学异质性者,采用亚组分析探索异质性产生的原因。如不存在临床或方法学异质性,用随机效应模型合并分析。如果研究间存在明显的临床异质性,则只对其进行描述性分析。必要时,采用敏感性分析检验结果的稳定性。通过漏斗图检验发表偏倚。
结 果
一、筛查结果
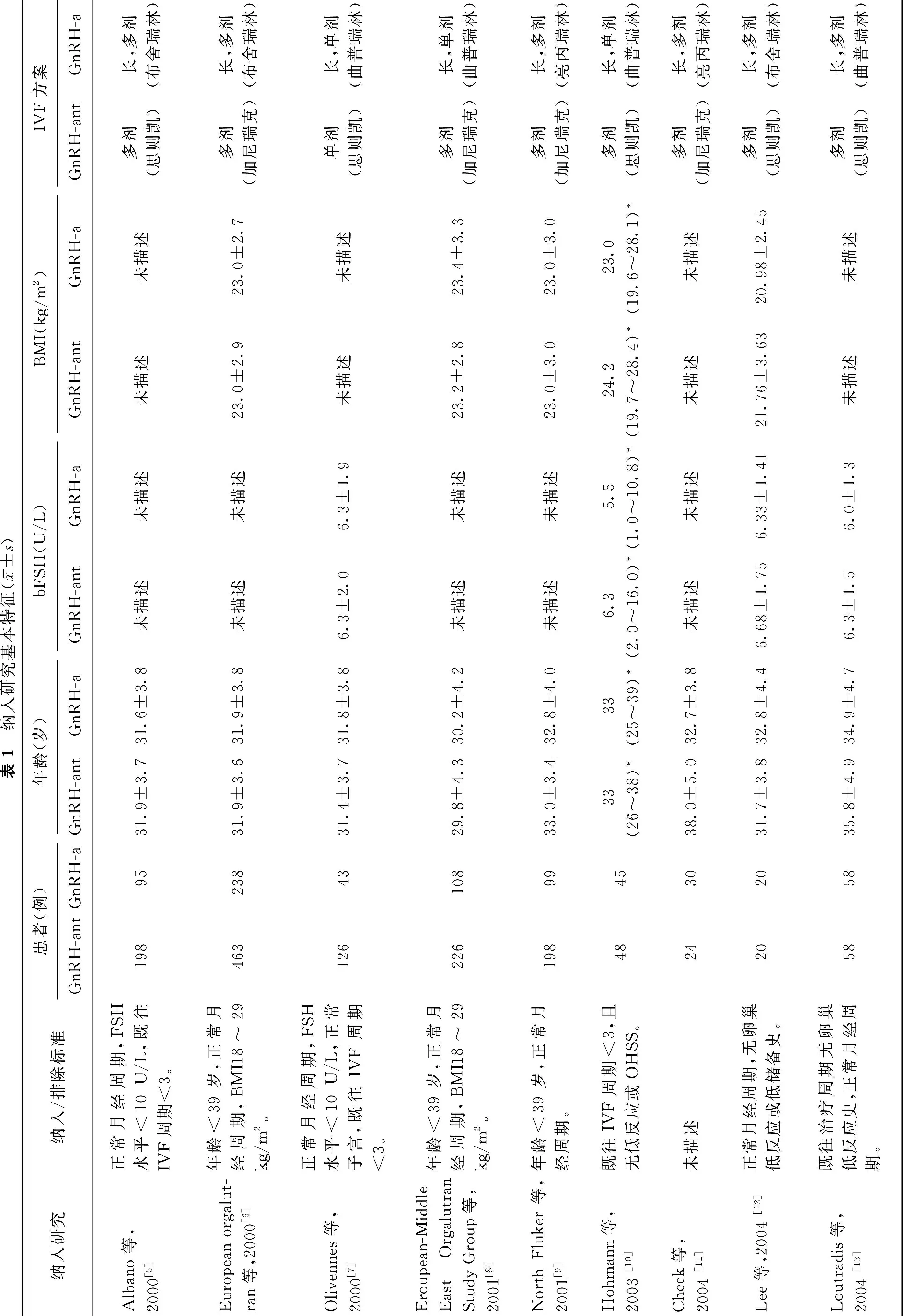
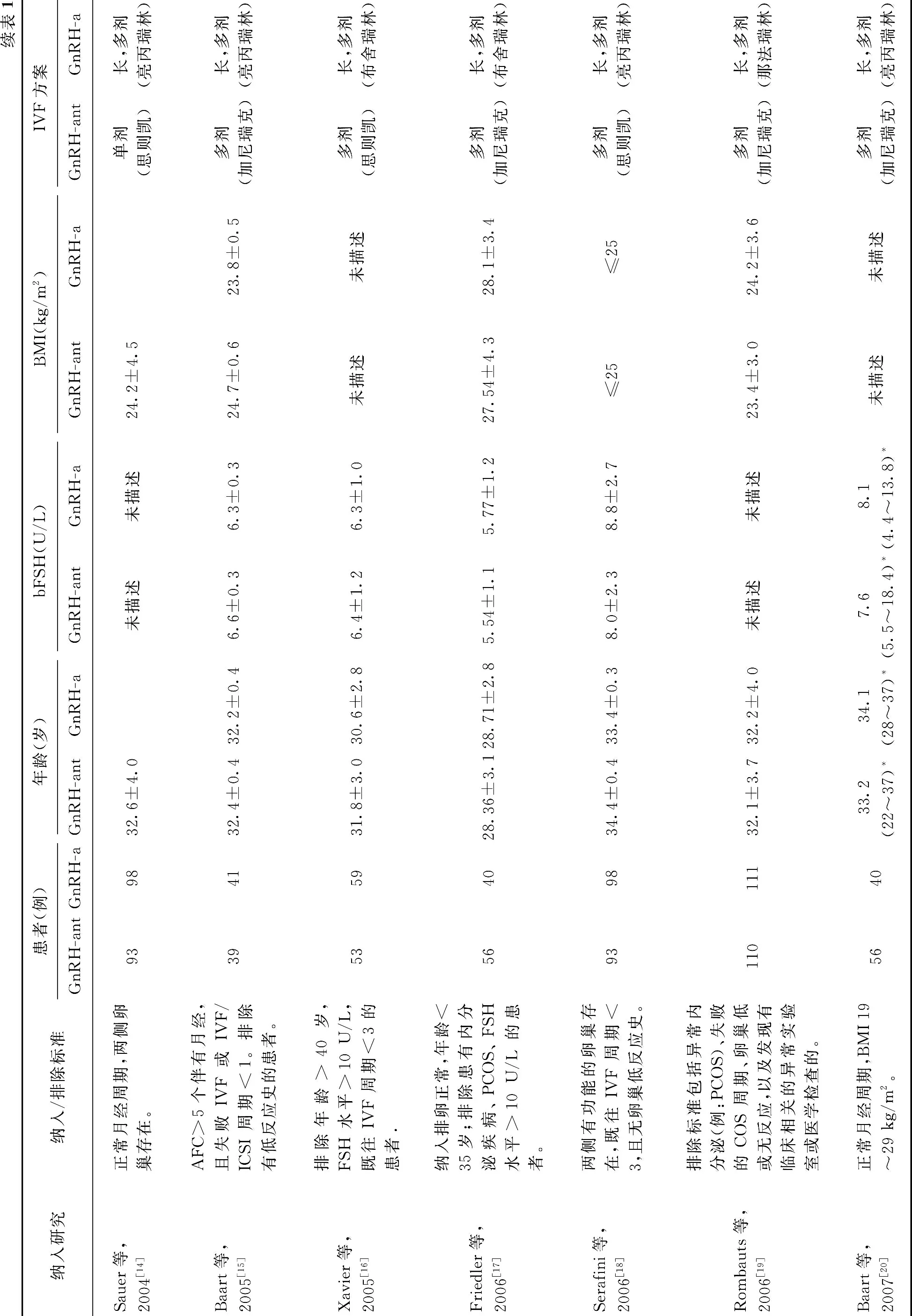
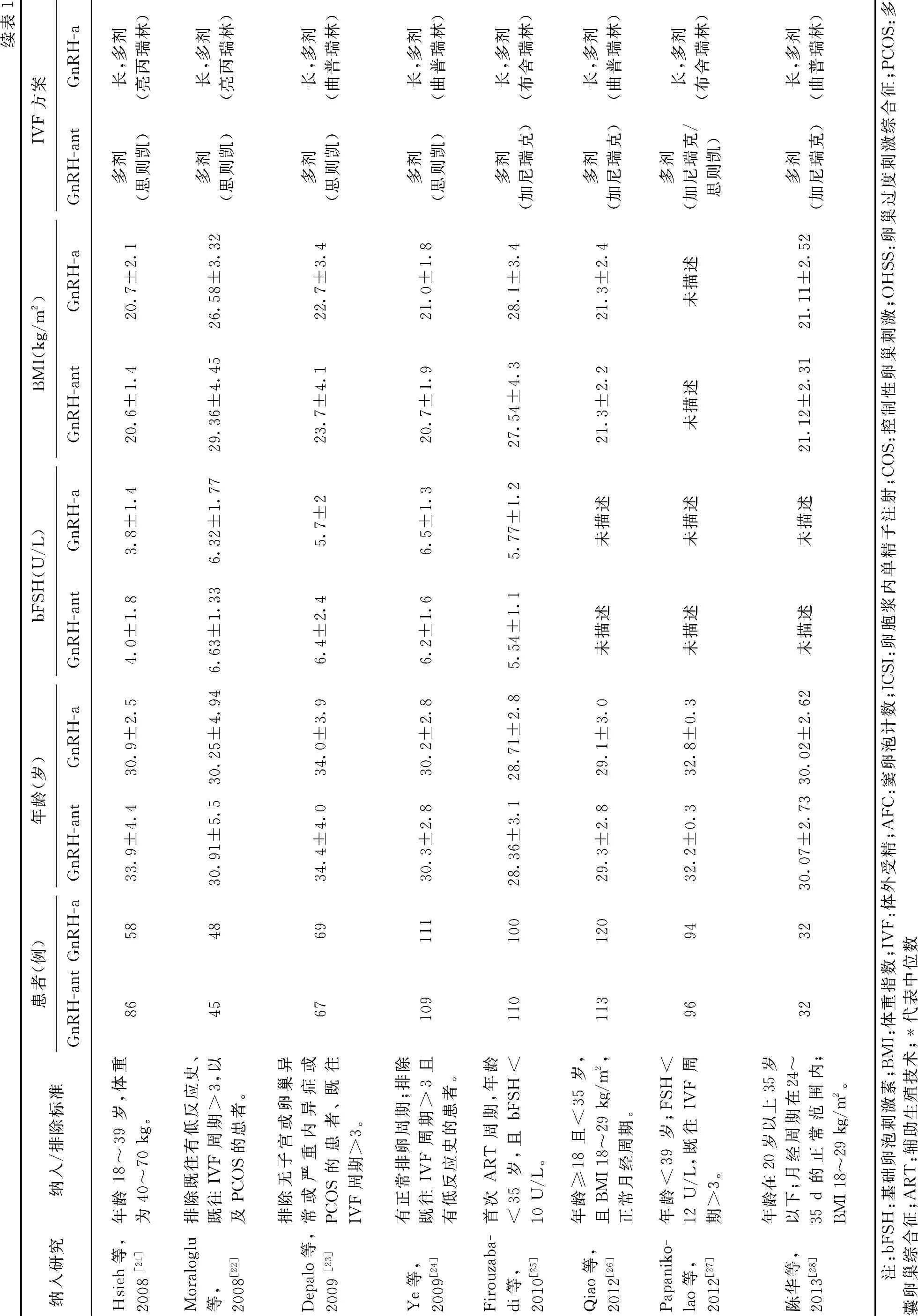
初检到文献1 849篇,通过阅读题目和摘要,排除不符合纳入标准和重复发表的文献1 798篇;再通过阅读全文,排除27 篇文献,最终纳入24 篇研究,均为已发表的研究。纳入研究基本特征,见表1。
二、质量评价
各项RCT 的质量评价标准均符合Cochrane系统评价员手册5.1.0 版[4]的风险偏倚评估标准。
三、有效性结局指标
1.刺 激 天 数:共 纳 入17 篇[5-9,12-17,19,22-24,27-28](3 182 例)文献,各试验间经检验有异质性(P<0.0001,I2=91%),故采用随机效应模型进行Meta分析,结果显示刺激天数GnRH-ant组明显小于GnRH-a组,两组差异有统计学意义(MD:-0.70,95%CI:-1.08~-0.32;P=0.003)(表2)。
2.Gn量:共纳入16篇文献[5,7,12-14,16-25,28](2 150例)文献,各试验间经检验有异质性(P<0.00001,I2=96%),故采用随机效应模型进行Meta分析,结果显示Gn量GnRH-ant组明显小于GnRH-a组,两组差异有统计学意义(MD:-2.94,95%CI:-4.9~-0.97;P=0.003)(表2)。
3.HCG日子宫内膜厚度:有6篇文献[12,16-17,24-25,28](719例)比较HCG 日子宫内膜厚度(mm),各试验间经检验无异质性(P=0.51,I2=0%),故采用固定效应模型进行Meta分析,结果显示HCG 日子宫内膜厚度GnRH-ant组与GnRH-a组比较,两组差异无统计学意义(MD:-0.07,95%CI:-0.25~0.12;P=0.47)(表2)。
4.HCG日E2值:有16篇文献[5-9,12-16,18,21-23,25,28](2 871例,统一采用国际标准单位pg/ml,换算为pmol/L时,换算系数为3.66)比较HCG 日E2值,各试 验 间 经 检 验 有 异 质 性(P <0.00001,I2=96%),故采用随机效应模型进行Meta分析,结果显示HCG 日E2值GnRH-ant组低于GnRH-a组,两组差异有统计学意义(MD:-353.75,95%CI:-530.60~-176.90;P=0.0001)(表2)。
?
?
?
5.获卵数:共纳入21篇文献[5-9,11-13,16-28](3 930例),各试验间经检验有异质性(P<0.00001,I2=87%),故采用随机效应模型进行Meta分析,结果显示获卵数GnRH-ant组小于GnRH-a组,两组差异有统计学意义(MD:-1.32,95%CI:-2.00~-0.64;P=0.0001)(表2)。
6.临 床 妊 娠 率:共 纳 入21 篇 文 献[5-18,21-28](3 678例),各试验间经检验无异质性(P=0.99,I2=0%),故采用固定效应模型进行Meta分析,结果显示临床妊娠率GnRH-ant组低于GnRH-a组,两组差异有统计学意义(OR:0.87,95%CI:0.75~1.00;P=0.05)(图1,表2)。
7.持 续 妊 娠 率:共 纳 入14 篇[5-10,15,19-20,23,25-28](2 983例)文献,各试验间经检验无异质性(P=0.99,I2=0%),故采用固定效应模型进行Meta分析,结果显示持续妊娠率GnRH-ant组与GnRH-a组比较,两组差异无统计学意义(OR:0.87,95%CI:0.74~1.03;P=0.11)(图2,表2)。
8.活 产 率:共 纳 入5 篇 文 献[5,15,24,27-28](809例),各 试 验 间 经 检 验 无 异 质 性(P =0.84,I2=0%),故采用固定效应模型进行Meta分析,结果显示活产率GnRH-ant组与GnRH-a组比较,两组差异无统计学意义(OR:0.89,95%CI:0.65~1.22;P=0.48)(图3,表2)。
四、安全性结局指标
1.OHSS 发 生 率: 共 纳 入 20 篇 文献[5-12,14,16,18-22,24-28](3 757例),各试验间经检验无异质性(P=0.28,I2=14%),故采用固定效应模型进行Meta分析,结果显示OHSS率GnRH-ant组低于GnRH-a组,两组差异有统计学意义(OR:0.57,95%CI:0.41~0.79;P=0.0007)(图4,表2)。
2.流 产 率:共 纳 入17 篇 文 献[5-11,15,17,19,21,23-28](3 009例),各试验间经检验无异质性(P=0.78,I2=0%),故采用固定效应模型进行Meta分析,结果显示流产率GnRH-ant组与GnRH-a组比较,两组差异无统计学意义(OR:1.18,95%CI:0.86~1.62;P=0.31)(表2)。
3.周期取消率:共纳入21 篇文献[5-11,14-20,22-28](3 887例),各试验间经检验无异质性(P=0.12,I2=27%),故采用固定效应模型进行Meta分析,结果显示周期取消率GnRH-ant组与GnRH-a组比较,两组差异无统计学意 义(OR:1.10,95%CI:0.89~1.35;P=0.35)(表2)。
五、敏感性分析与发表偏倚
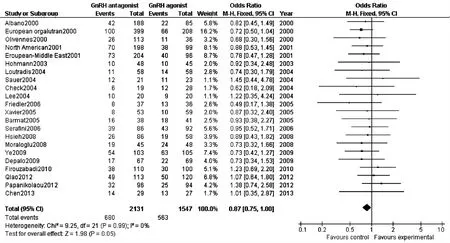
图1 GnRH-ant组与GnRH-a组临床妊娠率比较的森林图

图2 GnRH-ant与GnRH-a组持续妊娠率比较的森林图
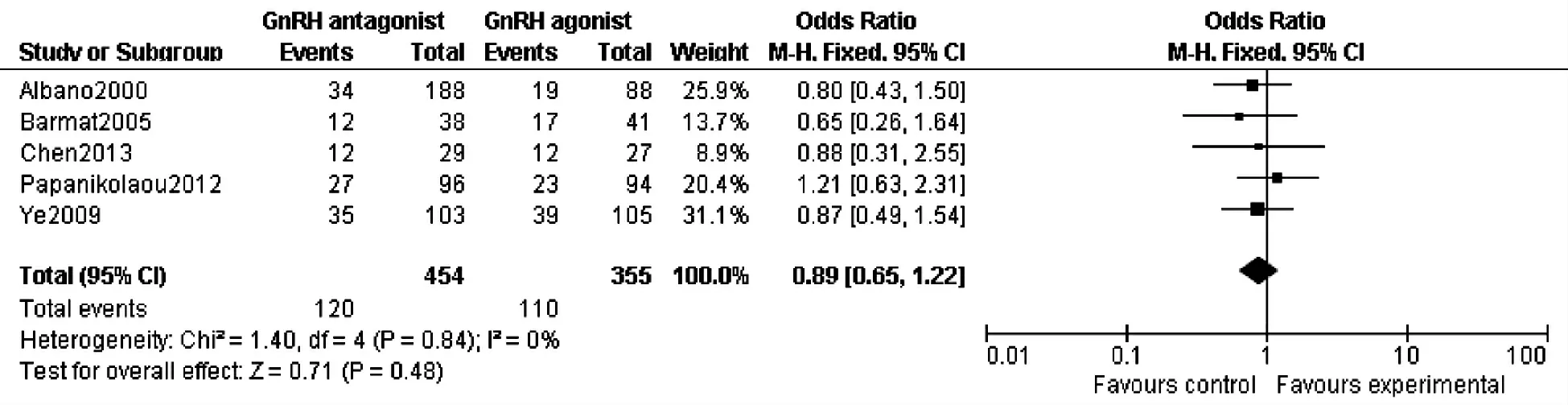
图3 GnRH-ant与GnRH-a组活产率比较的森林图

图4 GnRH-ant与GnRH-a组OHSS发生率比较的森林图
在下述结局指标中分别剔除权重最大的研究[6,15,18,24-25,27]进行 敏 感 性 分 析,结 果 显 示 临 床 妊 娠率GnRH-ant组与GnRH-a组比较,两组差异无统计学意义(OR:0.89,95%CI:0.77~1.04;P=0.16),刺激天数(MD:-0.77,95%CI:-1.16~-0.37;P=0.0001)、Gn 量(MD:-0.3.23,95%CI:-5.48~-0.98;P=0.005)、HCG 日E2值(MD:-296.99,95%CI:-422.73~171.26;P<0.00001)、HCG 日子宫内膜厚度(MD:-0.18,95%CI:-0.48~0.12;P=0.24)、获卵数(MD:-1.51,95%CI:-2.28~-0.74;P <0.0001)、持 续 妊 娠 率(OR:0.90,95%CI:0.75~1.09;P=0.28)、活产率(OR:0.90,95%CI:0.62~1.32;P=0.60)、OHSS率(OR:0.61,95%CI:0.43~0.87;P=0.007)、流产率(OR:1.25,95%CI:0.88~1.77;P=0.22)、周期取 消 率(OR:0.99,95%CI:0.79~1.24;P =0.92)结果稳定。漏斗图对称,纳入文献无明显发表偏倚。
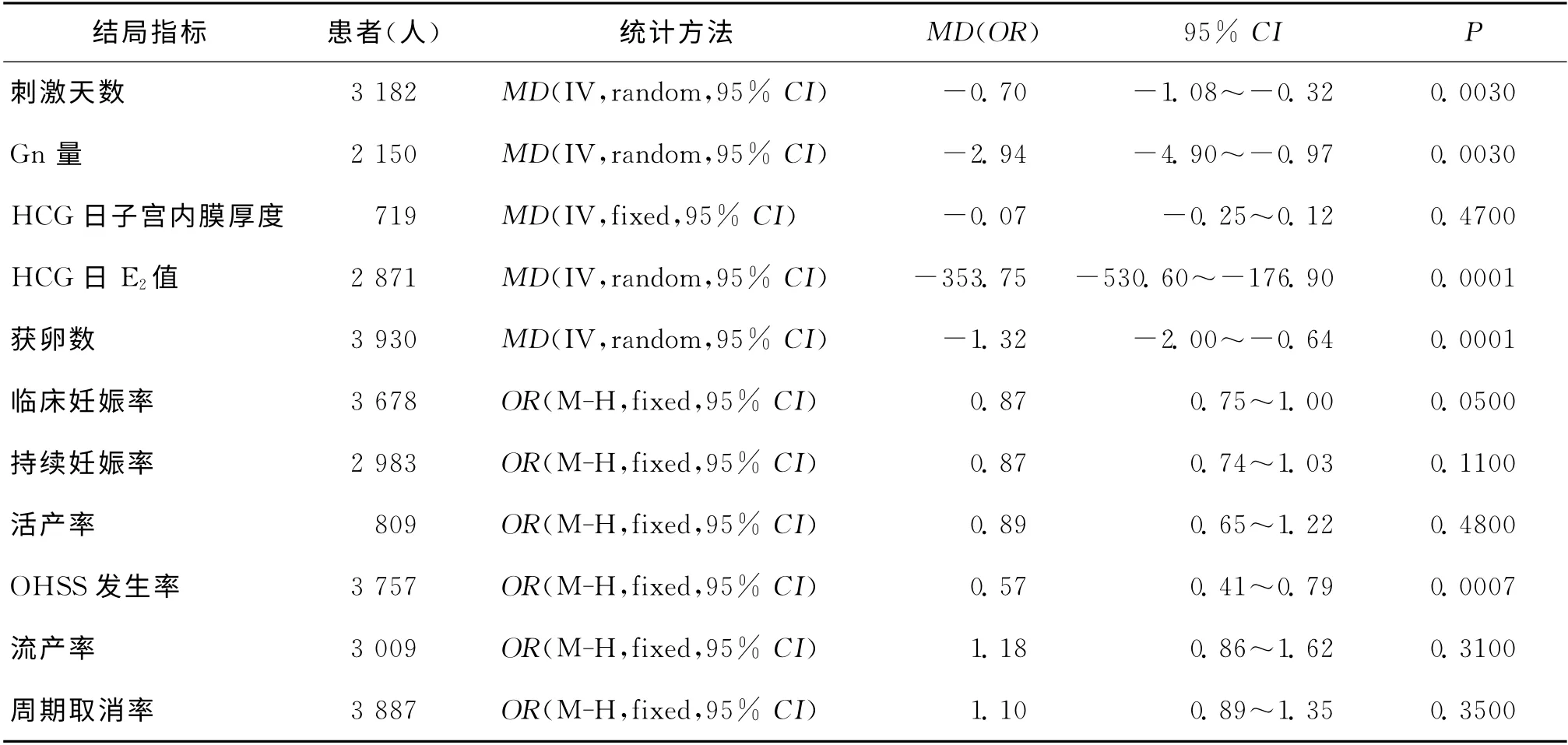
表2 纳入研究中两个方案有效性及安全性结局指标的Meta分析
讨 论
本系统评价结果显示在IVF-ET 假定为正常反应患者中,刺激天数、Gn 量、HCG 日E2值、获卵数、OHSS率GnRH-ant方案显著低于激动剂长方案。HCG 日子宫内膜厚度、持续妊娠率、活产率、流产率、周期取消率两组结果相似。临床妊娠率两组差异尚不确定。
一、本研究结果的解释
PCOS、抗苗勒管激素水平高、年龄较小(<35岁)被认为是OHSS 发生的原发性高危因素;COH 过程中血E2值高、取卵日卵泡数过多被认为是OHSS发生的继发性高危因素。由于GnRH-ant 较之GnRH-a方案刺激时间短、所需Gn量少、获卵数及HCG 日E2值较低,故OHSS率较低。
在低反应患者中,GnRH-ant较之GnRH-a方案临床 妊 娠 率 相 似[1,28];在PCOS 患 者 中,GnRHant较之GnRH-a方案临床妊娠率相似[1,29];本文假定所纳入的患者为正常反应,GnRH-ant方案临床妊娠率显著低于GnRH-a方案,但敏感性分析显示临床妊娠率两组差异无统计学意义,因此,尚不能认为GnRH-ant方案临床妊娠率低于GnRH-a方案;当所有反应类型的患者合并分析,GnRH-ant方案临床妊娠率显著低于GnRH-a方案[1],提示在不同反应类型患者之间,两组临床妊娠率可能存在差异。持续妊娠率、活产率两组差异无统计学意义,提示无论采用GnRH-ant或者GnRH-a方案妊娠的最终结局相似。流产率、周期取消率两组差异无统计学意义,提示上述两个指标并不是导致两组方案妊娠率差异的原因。
GnRH-ant与GnRH-a 方案对子宫内膜的影响,至今没有阐明[30,31]。本文两组HCG 日子宫内膜厚度差异无统计学意义,但不足以表明两组方案对子宫内膜影响的差异。
二、与现有系统性评价的比较
Al-Inany等[1]纳入45RCT(n=7 511),但是其Meta分析中没有剔除PCOS、低反应的研究,且研究的患者包含了所有反应类型。本文的研究对象是假定为正常反应的患者,剔除了低反应及高反应(PCOS)的研究;剔除了GnRH-ant用于微刺激方案、供卵者的研究。而且增加了自2011年后的2篇RCT[26-27]。另外,Al-Inany等[1]的研究中没有对刺激天数、Gn量、HCG 日E2值、获卵数、HCG 日子宫内膜厚度这些结局指标进行分析。
三、本研究的证据强度及局限性
本Meta分析纳入研究采用严格的筛选标准,研究对象为假定为卵巢正常反应的患者,并对治疗对象的年龄、BMI、FSH 等因素进行了基线一致性分析,24篇随机对照试验组和对照组具有可比性,基线一致。漏斗图对称,纳入文献无明显发表偏倚。GnRH-ant组采用单剂或多剂方案,GnRH-a组均为激动剂标准长方案,两组方案对等一致。但是由于部分研究没有明确的随机和隐藏方法;部分研究未采用盲法,以及临床用药方案的不完全相同,可能会导致偏倚。
四、对临床及科研的启示
从有效性来看,GnRH-ant与GnRH-a标准长方案最终临床效果相似,GnRH-ant方案具有刺激时间短、所需Gn 总量少的特点;从安全性来看,OHSS率GnRH-ant显著低于GnRH-a标准长方案。总之,临床上在确定治疗方案之前,应考虑到患者卵巢对COH 的反应性,根据生物指标制定个性化方案。
一方面,对同一反应类型GnRH-ant与GnRHa标准长方案之间的差异需进一步阐明;另一方面,目前还缺少根据患者不同反应类型设计,比较GnRH-ant与GnRH-a标准长方案的RCT。
五、结论
总之,在假定为正常反应患者行IVF-ET 治疗中,GnRH-ant方案较之GnRH-a标准长方案,持续妊娠率、活产率相似;采用GnRH-ant方案能显著降低OHSS发生率。尚不确定临床妊娠率两组方案是否存在差异。对于不同卵巢反应类型,GnRHant方案与GnRH-a标准长方案之间差异的进一步阐明,有待于今后设计严谨、多中心的RCT。
[1] Al-Inany HG, Aboulghar M . Gonadotrophin-releasing hormone antagonists for assisted conception[DB].Cochrane Database Syst Rev,2001:4:CD001750.
[2] Orvieto R,Patrizio P.GnRH agonist versus GnRH antagonist in ovarian stimulation:an ongoing debate[J/OL].Reprod Biomed Online,2013,26:4-8.
[3] Pundir J,Sunkara SK,El-Toukhy T,et al.Meta-analysis of GnRH antagonist protocols:do they reduce the risk of OHSS in PCOS?[J/OL].Reprod Biomed Online,2012,24:6-22.
[4] Higgins JPT,Green S.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0[EB/OL].The Cochrane Collaboration 2011.http://hand book cohrane.org/.
[5] Albano C,Felberbaum RE,Smitz J,et al.Ovarian stimulation with HMG:results of a prospective randomized phase III European study comparing the luteinizing hormone-releasing hormone(LHRH)-antagonist cetrorelix and the LHRHagonist buserelin.European Cetrorelix Study Group[J].Hum Reprod,2000,15:526-531.
[6] The European Orgalutran Study Group,Borm G,Mannaerts B.Treatment with the gonadotrophin-releasing hormone antagonist ganirelix in women undergoing ovarianstimulation with recombinant follicle stimulating hormoneis effective,safe and convenient:results of a controlled,randomized,multicentre trial[J].Hum Reprod,2000,15:1490-1498.
[7] Olivennes F,Belaisch-Allart,Emperare J,et al.Prospective randomized,controlled study of in vitro fertilization-embryo transfer with a single dose of a luteinizing hormone-releasing hormone(LHRH)antagonist(cetrorelix)or a depot formula of an LHRH agonist(triptorelin)[J].Fertil Steril,2000,73:314-320.
[8] European and Middle East Orgalutran Study Group.Comparable clinical outcome using the GnRH antagonist ganirelix or a long protocol of the GnRH agonist triptorelin for the prevention of premature LH surges in women undergoing ovarian stimulation[J].Hum Reprod,2001,16:644-651.
[9] Fluker M,Grifo J,Leader A,et al.North American Ganirelix Study Group.Efficacy and safety of ganirelix acetate versus leuprolide acetate in women undergoing controlled ovarian hyperstimulation[J].Fertil Steril,2001,75:38-45.
[10] Hohmann FP,Macklon NS,Fauser BC.A randomized comparison of two ovarian stimulation protocols with gonadotropin-releasing hormone (GnRH ) antagonist cotreatment for in vitro fertilization commencing recombinant follicle-stimulating hormone on cycle day 2 or 5 with the standard long GnRH agonist protocol[J].J Clin Endocrinol Metab,2003,88:166-173.
[11] Check ML,Check JH,Choel JK,et al.Effect of antagonists vs agonists on in vitro fertilization outcome[J].Clin Exp Obstet Gynecol,2004,31:257-259.
[12] Lee TH,Wu MY,Chen HF,et al.Ovarian response and follicular development for single-dose and multiple-dose protocols for gonadotropin-releasing hormone antagonist administration[J].Fertil Steril,2005,83:1700-1707.
[13] Loutradis D,Stefanidis K,Drakakis P,et al.A modified gonadotropin-releasing hormone(GnRH)antagonist protocol failed to increase clinical pregnancy rates in comparison with the long GnRH protocol[J].Fertil Steril,2004,82:1446-1448.
[14] Sauer MV,Thornton MH,Schoolcraft W,et al.Comparative efficacy and safety of cetrorelix with or without mid-cycle recombinant LH and leuprolide acetate for inhibition of premature LH surges in assisted reproduction[J/OL].Reprod Biomed Online,2004,9:487-493.
[15] Baart EB,Martini E,Eijkemans MJ,et al.Milder ovarian stimulation for in-vitro fertilization reduces aneuploidy in the human preimplantation embryo:a randomized controlled trial[J].Hum Reprod,2007,22:980-988.
[16] Xavier P,Gamboa C,Calejo L,et al.A randomised study of GnRH antagonist(cetrorelix)versus agonist(busereline)for controlled ovarian stimulation:effect on safety and efficacy[J].Eur J Obstet Gynecol Reprod Biol,2005,120:185-189.
[17] Friedler S,Gilboa S,Schachter M,et al.Luteal phase characteristics following GnRH antagonist or agonist treatment-a comparative study[J/OL].Reprod Biomed Online,2006,12:27-32.
[18] Serafini P,Yadid I,Motta EL,et al.Ovarian stimulation with daily late follicular phase administration of low-dose human chorionic gonadotropin for in vitro fertilization:aprospective,randomized trial[J].Fertil Steril,2006,86:830-838.
[19] Rombauts L,Healy D,Norman RJ.A comparative randomized trial to assess the impact of oral contraceptive pretreatment on follicular growth and hormone profiles in GnRH antagonist-treated patients[J].Hum Reprod,2006,21:95-103.
[20] Barmat LI,Chantilis SJ,Hurst BS,et al.A randomized prospective trial comparing gonadotropin releasing hormone(GnRH)antagonist/recombinant follicle-stimulating hormone(rFSH)versus GnRH-agonist/rFSH in women pretreated with oral contraceptives before in vitro fertilization[J].Fertil Steril,2005,83:321-330.
[21] Hsieh YY,Chang CC,Tsai HD.Comparisons of different dosages of gonadotropin-releasing hormone (GnRH )antagonist,short-acting form and single,half-dose,long acting form of GnRH agonist during controlled ovarian hyperstimulation and in vitro fertilization[J].Taiwan J Obstet Gynecol,2008,47:66-74.
[22] Moraloglu O,Kilic S,Karayalçin R,et al.Comparison of GnRH agonists and antagonists in normo-responder IVF/ICSI in Turkish female patients[J].Adv Ther,2008,25:266-273.
[23] Depalo R,Lorusso F,Palmisano M,et al.Follicular growth and oocyte maturation in GnRH agonist and antagonist protocols for in vitro fertilisation and embryo transfer[J].Gynecol Endocrinol,2009,25:328-334.
[24] Ye H,Huang G,Zeng P,et al.IVF/ICSI outcomes between cycles with luteal estradiol(E2)pre-treatment before GnRH antagonist protocol and standard long GnRH agonist protocol:aprospective and randomized study[J].J Assist Reprod Genet,2009,26:105-111.
[25] Firouzabadi RD,Ahmadi S,Oskouian H,et al.Comparing GnRH agonist long protocol and GnRH antagonist protocol in outcome the first cycle of ART[J].Arch Gynecol Obstet,2010,281:81-85.
[26] Qiao J,Lu G,Zhang HW,et al.A randomized controlled trial of the GnRH antagonist ganirelix in Chinese normal responders:high efficacy and pregnancy rates[J].Gynecol Endocrinol,2012,28:800-804.
[27] Papanikolaou EG,Pados G,Grimbizis G,et al.GnRH-agonist versus GnRH-antagonist IVF cycles:is the reproductive outcome affected by the incidence of progesterone elevation on the day of HCG triggering?A randomized prospective study[J].Hum Reprod,2012,27:1822-1828.
[28] 陈华,彭献东,韩金兰,等.GnRH 激动剂长方案和GnRH 拮抗剂方案对IVF-ET 结局的影响:一项前瞻性随机对照研究[J].生殖医学杂志,2013,22:8-11.
[29] Xiao J,Chang S,Chen S.The effectiveness of gonadotropinreleasing hormone antagonist in poor ovarian responders undergoing in vitro fertilization:a systematic review and metaanalysis[J].Fertil Steril,2013,100:1594-1601.
[30] Xiao J,Chen S,Zhang C,et al.Effectiveness of GnRH antagonist in the treatment of patients with polycystic ovary syndrome undergoing IVF:a systematic review and meta analysis[J].Gynecol Endocrinol,2013,29:187-191.
[31] Haouzi D,Assou S,Dechanet C,et al.Controlled ovarian hyperstimulation for in vitro fertilization alters endometrial receptivity in humans:protocol effects[J].Biol Reprod,2010,82:679-686.
[32] Kuc′P,Kuczyńska A,Topczewska M,et al.The dynamics of endometrial growth and the triple layer appearance in three different controlled ovarian hyperstimulation protocols and their influence on IVF outcomes[J].Gynecol Endocrinol,2011,27:867-873.

