干细胞治疗缺血性心肌病研究进展
余红 朱锦云 王建安
缺血性心肌病,因心肌长期缺血导致心肌纤维化,常伴心律失常和心力衰竭的发生,具有较高的病死率。目前,临床上采用药物、介入手术等方法进行治疗,虽然能减缓疾病进展,改善心脏功能,但因心肌细胞缺血坏死,预后大多不良。虽然有不少证据表明心脏受损伤后心肌细胞更新的速率会增快,但这种反应较轻微且增殖的细胞不足以代替缺失的心肌细胞数,仍会导致心力衰竭的发生。随着对干细胞基础及临床研究的日益深入及干细胞研究技术的成熟,近年来发现干细胞移植可促进缺血梗死局部血管新生和心肌再生,通过多重机制修复心脏,成为目前最有前景的治疗手段之一。本文主要对目前干细胞治疗缺血性心肌病的研究进展进行总结,为进一步基础和临床研究提供参考。
1 干细胞类型
目前,干细胞移植在修复受损心肌、改善心功能方面逐渐显示出优势。在缺血性心肌病研究中,已经有多种干细胞应用于临床研究。移植的干细胞种类多样,包括骨髓来源干细胞、心脏干细胞(cardiac stem cells,CSCs)、胚胎干细胞(embryonic stem cells,ESCs)、诱导多能干细胞(induced pluripotent stem cells,iPSCs)、脐血干细胞、骨骼肌干细胞、内皮祖细胞(endothelial progenitor cells,EPCs)等,现大体介绍前面几种细胞。
1.1 骨髓来源干细胞
骨髓中存在着许多功能各异的前体细胞,包含造血干细胞(hematopoietic stem cells,HSCs)、EPCs 及骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)等[1],这类细胞来源简便,可以直接从自身骨髓获得,因而较多应用于临床试验中。BMSCs 相对容易分离和扩增,免疫原性低,在缺血性心肌病中,BMSCs 已被证实能改善心肌功能,促进血管新生,并减少心肌纤维化。Hare 等[2]在30 例左心室功能不全的缺血性心肌病患者中,首次证实了BMSCs 的疗效。经心内注射自体和异体BMSCs 后均能减少心肌梗死面积和左心室舒张末期容积。自体BMSCs 移植后反映心功能的指标[6 min 步行试验、明尼苏达心力衰竭评分量表评分(MLHFQ 评分)]均显著改善;异体BMSCs 移植未见明显免疫排斥反应。C-CURE 研究[3]结果表明,将BMSCs 经心脏内注射给予慢性心力衰竭患者(21 例),试验组的NYHA 心功能分级、生活质量、存活率等均高于对照组。最新一项研究显示,对缺血性心肌病患者(LVEF <50%)行BMSCs 和骨髓单核细胞(bone marrow mononuclear cells,BMMNCs)治疗30 d 后,BMSCs 组患者心肌梗死面积显著减少。该试验初步证明了经心脏左心室注射BMSCs 和BMMNCs 治疗缺血性心肌病和左心功能不全是安全有效的[4]。本中心在国内较早开展运用BMSCs 治疗临床心肌梗死患者,同样显示无论是自体还是异体BMSCs 移植都能改善心肌重构和心脏功能,提高生活质量[5]。近几年,关于BMMNCs 对急性心肌梗死或充血性心力衰竭的治疗效果存在质疑。BOOST[6]、REPAIR-AMI[7]等研究结果显示BMMNCs 治疗的有效性,而TIME 研究[8]、Late-TIME 研究[9]和ASTAMI 研究[10]却显示BMMNCs 未能明显改善心脏功能(表1)。FOCUS-CCTRN 研究[11],将153 例患者(LVEF≤45%)随机分为BMMNCs 组(61 例)和安慰剂组(31 例)。6 个月后,与安慰剂组比较,BMMNCs 组患者左心室收缩末期容积(LVESV)、最大耗氧量以及其他临床疗效差异均无统计学意义。这可能与现阶段所进行的BMMNCs 研究采用自体干细胞分离、注入途径和治疗剂量等存在很大差异及入选患者基线心功能水平不同有关,仍需临床研究进一步明确其治疗的有效性。目前,已在ClinicalTrials. gov 上注册,正在进行中的BMSCs 治疗缺血性心肌病的研究有NCT01913886、NCT01759212、NCT01076920,应用BMMNCs 治疗的研究有NCT00869024、NCT01693042 等。
1.2 心脏干细胞
传统观点认为心肌细胞是永久细胞,出生后逐渐失去再生能力,但近年的研究表明胎儿和成熟心脏均具有一定再生潜能,心脏中存在CSCs,能分化为心肌细胞、平滑肌细胞和内皮细胞,参与损伤修复,移植后可减少梗死面积[20]。根据CSCs 表面标志物结合生物学特性,大致包括以下类型:c-Kit+CSCs、Scal-1+CSCs、心 肌 球 衍 生 细 胞(cardiospherederived cells,CDCs)、侧群细胞和Islet1+等[20]。有研究显示,将心力衰竭小鼠的CSCs去除后心脏会停止再生和修复,重新注入CSCs 后通过归巢到心脏得以修复受损的部位,表明c-kit+CSCs 对于心脏损伤过程起到重要的作用[21]。CSCs治疗缺血性心肌病的I 期临床试验SCIPIO 研究[18]将心肌梗死后左心室射血分数(LVEF)≤40%的患者分为2 组:CSCs组(16 例)和对照组(7 例),经冠状动脉内注射(1 ×106ml-1)自体CSCs。4 个月后心脏磁共振成像(MRI)显示,CSCs 能显著提高心肌梗死伴心力衰竭患者心室收缩功能并减少梗死面积,1 年后结果更明显,且经CSCs 治疗的患者MLHFQ 评分明显升高。CDCs 是另一个心脏干细胞类型,能向其他心肌祖细胞亚群转化。CADUCEUS 研究[19]将心肌梗死后2 ~4 周心力衰竭患者(25%≤LVEF≤45%)分为CDCs组(17 例)和对照组(8 例)。CDCs 组将自体CDCs(1.25 ×107~2.5 ×107个)输入心肌梗死相关冠状动脉。结果6 个月和12 个月后观察瘢痕面积减少,且存活心肌、收缩力、室壁厚度明显增加,CDCs 组未见不良心血管事件发生。上述结果表明经冠状动脉内注射CDCs 治疗缺血性心肌病基本是安全可靠的。针对近300 例患者的大型ALLSTAR 试验也正在进行中,用以观察自体CDCs 治疗的有效性。虽然内源性c-kit+CSCs 一直被认为是受损后新生成心肌细胞的主要来源,但最新研究利用谱系示踪技术表明,在衰老或损伤的情况下,内源性c-kit+细胞不能产生足够的心肌细胞用以修复心脏,来自内源性c-kit+细胞的心肌细胞仅占少数,而大部分c-kit+细胞分化生成心脏内皮细胞。c-kit+形成心肌细胞的速度极慢,在生理学缺乏实际意义,所以c-kit+CSCs 并不是缺血心脏生成心肌细胞的主要来源,其可能是通过旁分泌机制促进心脏增殖和再生,而非直接分化作用[22]。现在关于c-kit+细胞的来源及其心肌再生能力仍存在争议,因此上述问题仍有待研究解决。近年来,通过免疫磁珠细胞分选技术能从心肌组织中,分离出另一类Sca-1+干细胞,机体内多种来源(骨髓、心肌、骨骼肌、血管)的祖细胞均可表达Sca-1[23]。Sca-1+细胞可改善小鼠心肌梗死后心功能,敲除小鼠Sca-1 基因可造成心脏收缩和修复功能缺陷,从而影响CSCs 活化、增殖和分化。还有研究发现,在新生哺乳动物心脏有1/3 的干细胞型是源自胚胎细胞群,这些细胞除表达心脏转录因子外,还表达Isl-1。Isl-1 细胞是第二生心区特有的标志物,是心脏内未分化的细胞群。当Isl-1 细胞分化成心肌细胞,可形成绝大部分右心室、心房及流出道细胞,出生后Isl-1 细胞则极少能检测到[24]。目前,正在进行的CSC 治疗缺血性心肌病临床试验有TICAP 研究(NCT01273857)、ALCADIA 研究(NCT00981006)和NCT01758406。
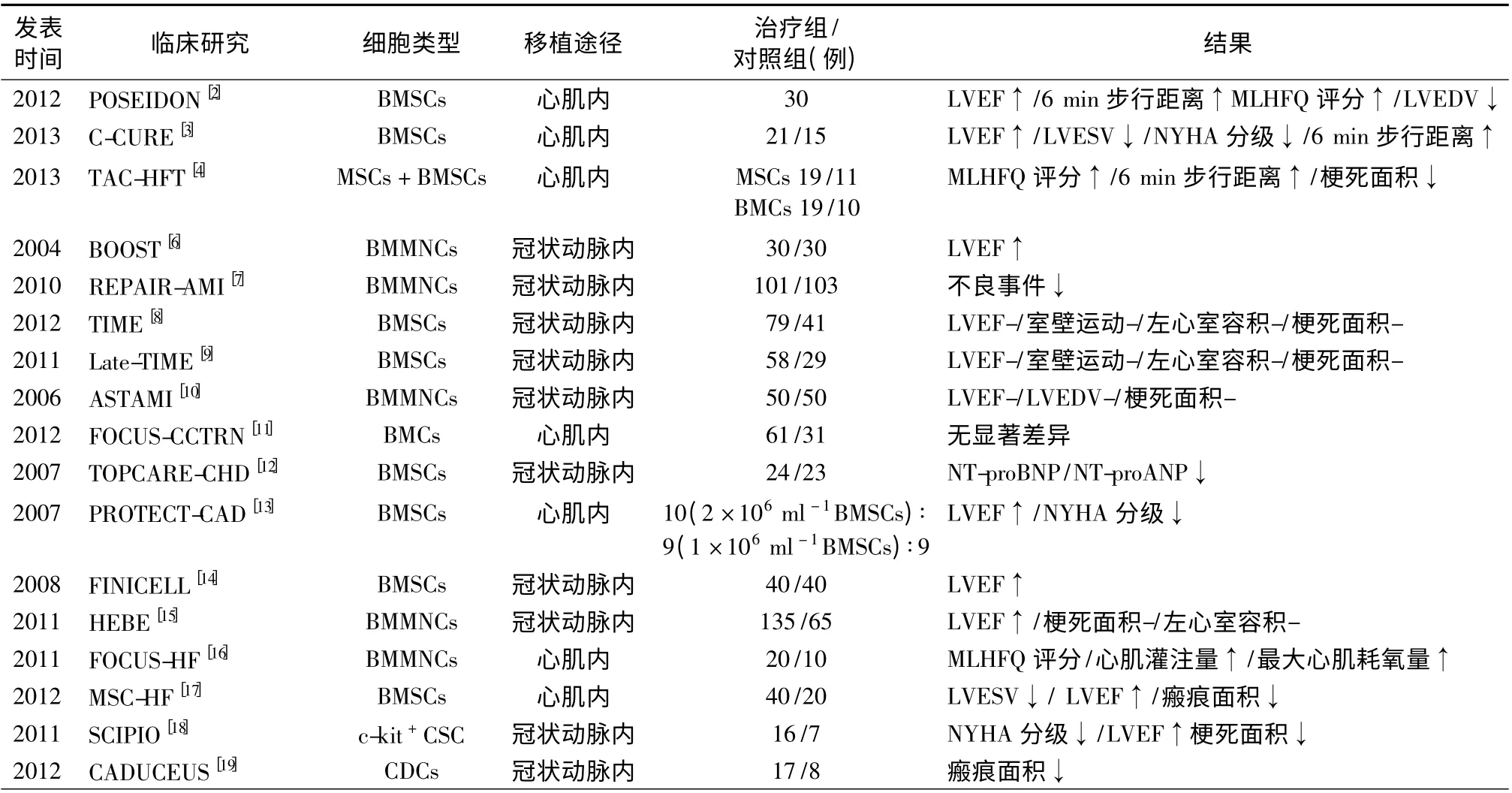
表1 干细胞治疗部分临床试验
1.3 胚胎干细胞(ESCs)
ESCs 可通过直接分化为心肌细胞或通过旁分泌作用显著改善心肌缺血后的心脏功能。在体外培养条件下ESCs 可诱导分化为心肌细胞,这种心肌细胞具有早期心肌细胞的结构与功能特点,能够与宿主心肌细胞形成偶联。因而,直接分化人胚胎干细胞(hESCs)或者iPSCs 可成为心肌细胞的重要来源。最近研究利用hESCs 生成的心脏细胞(数量提高了10 多倍),成功修复了心肌梗死猴子受损的心肌,并且能与宿主心肌细胞电机械偶联,实现心肌再生。首次在灵长类动物身上成功完成了此实验,受损组织的修复成功率平均可达约40%[25]。在此之前,已有研究报道在其他动物身上成功利用ESCs 分化出心肌细胞,且ESCs 来源的心肌细胞移植到心肌梗死动物后,能显著改善心脏功能[26]。但研究也发现,新形成的心肌细胞仅部分是成熟的,大部分更像是未成熟胎儿心肌细胞,可观察到有非致死性室性心律失常出现。因此,在真正用于临床研究之前,ESCs 分化而来的心肌细胞仍存在治疗安全性和有效性的问题。
1.4 诱导多能干细胞
与ESCs 相比,iPSCs 来自自身重编程的体细胞,具有自我更新和多向分化潜能。有研究表明,来自缺血性心肌病患者的皮肤成纤维细胞,通过慢病毒转导Oct-4、Sox2 和klf4 基因后转变为iPSCs,能诱导分化为功能性心肌细胞,将其移植到体内能与心脏组织融合[27]。iPSCs 技术避免了伦理和免疫排斥等方面的问题,这指引我们能够从患者体细胞获取组织相容性的干细胞,达到修复和再生组织的目的。受到iPSCs 技术的启发,近年来研究者采用直接重编程的方法,将成纤维细胞直接重编程为心肌样细胞,整个过程未经历多能状态阶段,不形成中间前体细胞,而直接从完全分化的细胞转换为另一种成熟细胞类型[28]。Ieda 等[29]通过在成纤维细胞内加入转录因子Gata4、Mef2c 和Tbx5(GMT),成功地诱导其转变为心肌样细胞。心肌样细胞具有与成熟心肌细胞相似的基因表型和结构。其他研究在GMT 基础上,添加1 ~2 个转录因子或微小RNA(miRNA)也能诱导直接重编程过程。例如Song 等[30]在GMT 基础上添加Hand2(GHMT),转导30 d 后促使心脏成纤维细胞有效地转变为心肌样细胞,并出现少量跳动的细胞。尽管这为修复受损心脏提供了一种新的方法,但直接重编程和iPSCs 一样都存在安全性和心肌诱导分化效率低等问题。
2 干细胞的作用机制
2.1 直接分化作用
越来越多的研究表明,多种不同类型的干细胞能够分化成为心肌细胞、平滑肌细胞和内皮细胞,尽管这种直接分化的细胞百分比很小。不管是在体外培养还是体内移植,BMSCs 能诱导分化为心肌细胞,移植入梗死区能够表达心肌标志物如肌钙蛋白T、α-肌动蛋白以及连接蛋白等。BMSCs移植后也能表达平滑肌细胞、血管内皮细胞特异性蛋白,提示BMSCs 向平滑肌细胞或内皮细胞直接分化,促进毛细血管再生,改善心肌缺血[31]。
2.2 旁分泌作用机制
移植的干细胞可通过释放生长因子和细胞因子发挥旁分泌作用,抑制炎症反应和凋亡,增加毛细血管密度,减少心肌梗死瘢痕形成,促进心脏修复和心肌再生。现已知干细胞旁分泌作用可通过如下方面发挥作用:(1)可募集激活内源性干细胞,增加内源性心肌修复。有研究表明,多种生长因子和信号途径能激活内源性干细胞。如在心肌缺血情况下,移植外源性BMSCs 可通过释放细胞因子等激活心脏CSCs,活化后向心肌细胞定向分化,激活后的内源性干细胞可归巢到受损缺血部位。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)系统激活能诱导CSCs 分化为心肌细胞、增加端粒酶活性、维持端粒长度、延缓衰老等[32]。干细胞因子(stem cell fator,SCF)可通过磷脂酰肌醇-3-激酶(PI3K)和基质金属蛋白酶-2/9(MMP-2/9)途径,诱导CSCs 的趋化和迁移,当用PI3K/丝苏氨酸蛋白激酶(AKT)抑制剂LY294002后,可观察到阻碍SCF 诱导的CSCs 迁移[33]。移植干细胞也可通过释放其他因子促使CSCs 增殖,例如神经调节蛋白-1(NRG-1)、成纤维细胞生长因子-1(FGF-1)和血管内皮生长因子(VEGF)等[34]。此外,有研究证明在缺血损伤条件下,BMSCs 也可通过分泌大量直径在50 ~100 nm 的膜性囊泡,被称为exosome,发挥旁分泌作用。exosome 包含多种成分,如细胞因子、分子蛋白、信使RNA(mRNA)、miRNA 等,不仅可以减轻组织损伤,还可以提高内源性干细胞修复能力[35]。(2)抗炎作用。干细胞移植能够调节炎症因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1(IL-1)等的表达,影响免疫细胞的功能,从而保护受损心肌细胞[36]。(3)调控纤维化过程,减少瘢痕面积,改善心肌收缩能力。干细胞移植也能够改善心肌梗死后心肌收缩功能。有研究表明,干细胞改善心肌功能是通过增加转化生长因子-1β(TGF-1β),减少TNF-α 和白细胞介素-1β(IL-1β)的表达来实现的[37]。干细胞移植后心肌细胞最大收缩力、收缩和舒张的最大速率显著改善。本中心进行的研究表明,对心肌梗死后的SD 大鼠注射2 ×106人经血间充质细胞,结果与对照组相比,术后7 d 治疗组能显著减少梗死面积,降低心脏胶原沉积,具有抗纤维化作用。人经血间充质细胞通过抑制内皮细胞向间充质细胞转化(endothelial-to-mesenchymal transition,EndMT)过程,抑制其来源的成纤维细胞生成,调节EndMT 相关转录因子的表达,并且可能是通过抑制TGF-β1/Smad 信号通路实现的[38]。
2.3 血管生成作用机制
移植的干细胞除了分化为心肌细胞外,也可直接分化为内皮细胞和平滑肌细胞。在损伤部位形成新生血管,为缺血心肌提供更多的氧和营养物质,起到保护心脏的作用。研究显示,移植后干细胞上标记内皮细胞黏附分子(CD31)和血管性血友病因子(vWF)及血管平滑肌细胞肌动蛋白(SMactin)表达显著增加。除了少部分细胞直接分化外,干细胞促进血管生成主要通过分泌细胞因子如VEGF 和碱性成纤维细胞生长因子(bFGF)等,募集内源干细胞或骨髓来源的EPC 分化成内皮细胞,可促进心肌毛细血管密度增加[39]。
2.4 免疫调节作用
BMSCs 具有免疫豁免,通过分泌某些因子能抑制局部免疫反应。有研究表明,自体或异体BMSCs 移植用于治疗缺血性心肌病,均能取得相似的效应,移植后组织中TNF-α、IL-1β 和IL-6 炎症因子显著减少[40]。Di Trapani 等[41]研究也显示,多种来源的干细胞(包括CSCs)移植能调节宿主的免疫反应,尤其通过调节炎症反应来实现。
3 问题和展望
目前,已有大量的干细胞基础和临床研究在全球范围内开展,虽然得到的结果并未完全一致,但以干细胞作为心血管疾病临床治疗的手段,治疗缺血性心肌病基本上是安全和有效的。多种类型干细胞移植均显示出其修复受损心肌、改善心功能方面的作用。最近几年采用CSCs、ESCs 和iPSCs修复心脏再生成为研究热点,但CSCs 对心肌细胞再生与修复的作用机制还需要深入探索,明确其修复心脏的有效性和安全性。iPSCs 也面临细胞重编程效率低、致癌风险较大等问题。因此,研究和开发各种不同重编程技术来诱导更有效和更安全的iPSCs 或直接分化细胞,是今后需要解决的。
干细胞治疗缺血性心肌病仍存在一些其他问题,主要体现为移植后细胞归巢到损伤组织局部的细胞数量少,且移植后细胞存活率较低,这些因素使得干细胞移植疗效不理想,成为干细胞修复心肌的瓶颈。已有报道利用基因修饰和缺氧预处理等方法能提高干细胞移植疗效,改变细胞因子等释放。基因修饰干细胞存在致瘤性和免疫源性等风险,使其在临床上应用受限,移植前对干细胞进行预处理可望克服上述弊端。本中心的前期研究已经证实,缺氧预处理MSCs 24 h,可提高MSCs 的体外存活、迁移和对共培养心肌细胞的保护能力,缺氧预处理过的MSCs 移植到体内后,可募集到梗死周边区,血管密度增高。而且这些功能改善与缺氧预处理后瘦素(Leptin)的表达提高相关[42]。此外,许多小分子或细胞因子,如miRNA、转录因子等,可通过影响心脏干细胞/祖细胞调节心脏再生过程,所以继续寻找这些可扩散的细胞因子,为内源性CSCs 提供调节信号,将成为目前研究的一个方向。其中miRNA 成为近年来的研究热点,通过调节特定基因的表达,参与对内源性干细胞的募集、分化、生存和凋亡等功能调控。研究发现miR-499、miR-126 和miR-210 均能通过调节靶基因的表达,增加心脏祖细胞的存活,使小鼠心肌梗死后心脏功能显著改善。注入联合miRNAs(miR-1、miR-133、miR-208、miR-499)能有效地重编程成纤维细胞,将其转变为心肌细胞,表明miRNAs 不仅是恢复正常心功能的调节因子,也能调节决定细胞命运,在细胞分化、转分化等过程中可能起作用[43]。但同时miRNA 调节是一个复杂的过程,涉及多种因子和信号途径的共同作用。大多数miRNA 是非特异性的,在多种组织和细胞类型中广泛表达,miRNA 治疗可能会带来系统性应用的不良反应,因而应进一步加强心脏特性miRNA 的研究,并研究miRNA 调节干细胞功能涉及哪些信号途径和细胞因子,影响了哪些相关基因的表达,需要在大型动物模型中进行验证。
根据目前的临床研究(表1),大部分治疗缺血性心肌病的临床试验仍处于临床Ⅰ期或Ⅱ期,规模有限,缺乏长期观察结果,也存在临床应用问题:采用何种干细胞类型和途径更有效、每种干细胞的剂量反应关系和注射频率、干细胞治疗的细胞数量和移植时间点的选择等,同时缺乏明确标准的治疗方案。仅少数研究直接比较了不同干细胞类型的治疗效果,且联合治疗可能比单一干细胞治疗效果更显著,但不同干细胞之间共同调控再生过程的具体机制尚不清楚。因此,需要开展更多深入研究的基础实验和设计严谨的临床试验,为临床应用做好准备。开展Ⅲ期临床试验可进一步证实干细胞在缺血性心肌病中的应用价值,完善干细胞治疗缺血性心肌病的策略。
[1] van Ramshorst J,Rodrigo SF,Schalij MJ,et al. Bone marrow cell injection for chronic myocardial ischemia:the past and the future. J Cardiovasc Transl Res,2011,4:182-191.
[2] Hare JM,Fishman JE,Gerstenblith G,et al. Comparison of allogeneic vs autologous bone marrow-derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy:the POSEIDON randomized trial.JAMA,2012,308:2369-2379.
[3] Bartunek J,Behfar A,Dolatabadi D,et al. Cardiopoietic stem cell therapy in heart failure:the C-CURE (Cardiopoietic stem Cell therapy in heart failURE)multicenter randomized trial with lineage-specified biologics. J Am Coll Cardiol,2013,61:2329-2338.
[4] Heldman AW,DiFede DL,Fishman JE,et al. Transendocardial mesenchymal stem cells and mononuclear bone marrow cells for ischemic cardiomyopathy: the TAC-HFT randomized trial.JAMA,2014,311:62-73.
[5] 王建安,谢小洁,孙勇,等. 骨髓间质干细胞冠脉内移植治疗近期陈旧性心肌梗死伴心功能不全. 中华急诊医学杂志,2005,14:996-999.
[6] Wollert KC,Meyer GP,Lotz J,et al. Intracoronary autologous bone-marrow cell transfer after myocardial infarction:the BOOST randomised controlled clinical trial. Lancet,2004,364:141-148.
[7] Assmus B,Rolf A,Erbs S,et al. Clinical outcome 2 years after intracoronary administration of bonemarrow-derived progenitorcells in acutemyocardial infarction. Circ Heart Fail,2010,3:89-96.
[8] Traverse JH,Henry TD,Pepine CJ,et al. Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction:the TIME randomized trial.JAMA,2012,308:2380-2389.
[9] Traverse JH,Henry TD,Ellis SG,et al. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function:the Late TIME randomized trial. JAMA,2011,306:2110-2119.
[10] Lunde K,Solheim S,Aakhus S,et al. Intracoronary injection of mononuclear bone marrow cells in acute myocardial infarction. N Engl J Med,2006,355:1199-1209.
[11] Perin EC,Willerson JT, Pepine CJ, et al. Effect of transendocardial delivery of autologous bone marrow mononuclear cells on functional capacity,left ventricular function,and perfusion in chronic heart failure:the FOCUS-CCTRN trial.JAMA,2012,307:1717-1726.
[12] Assmus B,Fischer-Rasokat U,Honold J,et al. Transcoronary transplantation of functionally competent BMCs is associated with a decrease in natriuretic peptide serum levels and improved survival of patients with chronic postinfarction heart failure:results ofmthe TOPCARE-CHD Registry. Circ Res,2007,100:1234-1241.
[13] Tse HF,Thambar S,Kwong YL,et al. Prospective randomized trial of direct endomyocardial implantation of bone marrow cells for treatment of severe coronary artery diseases (PROTECT-CAD trial). Eur Heart J,2007,28:2998-3005.
[14] Huikuri HV,Kervinen K, Niemel? M, et al. Effects of intracoronary injection of mononuclear bone marrow cells on left ventricular function,arrhythmia risk profile,and restenosis after thrombolytic therapy of acute myocardial infarction. Eur Heart J,2008,29:2723-2732.
[15] Hirsch A,Nijveldt R,van der Vleuten PA,et al. Intracoronary infusion of mononuclear cells from bone marrow or peripheral blood compared with standard therapy in patients after acute myocardial infarction treated by primary percutaneous coronary intervention:results of the randomized controlled HEBE trial.Eur Heart J,2011,32:1736-1747.
[16] Perin EC,Silva GV,Henry TD,et al. A randomized study of transendocardial injection of autologous bone marrow mononuclear cells and cell function analysis in ischemic heart failure (FOCUSHF). Am Heart J,2011,161:1078-1087.
[17] Mathiasen AB,Jrgensen E,Qayyum AA,et al. Rationale and design of the first randomized,double-blind,placebo-controlled trial of intramyocardial injection of autologous bone-marrow derived Mesenchymal,Stromal Cells in chronic ischemic Heart Failure (MSC-HF Trial). Am Heart J,2012,164:285-291.
[18] Bolli R,Chugh AR,D'Amario D,et al. Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO):initial results of a randomised phase 1 trial. Lancet,2011,378:1847-1857.
[19] Makkar RR,Smith RR,Cheng K,et al. Intracoronary cardiosphere-derived cells for heart regeneration after myocardial infarction (CADUCEUS):a prospective,randomised phase 1 trial.Lancet,2012,379:895-904.
[20] Bergmann O,Bhardwaj,RD,Bernard S,et al. Evidence for cardiomyocyte renewal in humans. Science,2009,324:98-102.
[21] Ellison GM,Vicinanza C,Smith AJ,et al. Adult c-kit(pos)cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair. Cell,2013,154:827-842.
[22] van Berlo JH,Kanisicak O,Maillet M,et al. c-kit+cells minimally contribute cardiomyocytes to the heart. Nature,2014,509:337-341.
[23] Ye J,Boyle A,Shih H,et al. Sca-1+cardiosphere-derived cells are enriched for Isl1-expressing cardiac precursors and improve cardiac function after myocardial injury. PLoS One,2012,7:e30329.
[24] Laugwitz KL,Moretti A, Lam J, et al. Postnatal isl1+cardioblasts enter fully differentiated cardiomyocyte lineages.Nature,2005,433:647-653.
[25] Chong JJ,Yang X,Don CW,et al. Human embryonic-stem-cellderived cardiomyocytes regenerate non-human primate hearts.Nature,2014,510:273-277.
[26] Glass C,Singla DK. Overexpression of TIMP-1 in embryonic stem cells attenuates adverse cardiac remodeling following myocardial infarction. Cell Transplant,2012,21:1931-1944.
[27] Zwi-Dantsis L,Huber I,Habib M,et al. Derivation and cardiomyocyte differentiation of induced pluripotent stem cells from heart failure patients.Eur Heart J,2013,34:1575-1586.
[28] Savla JJ,Nelson BC,Perry CN,et al. Induced pluripotent stem cells for the study of cardiovascular disease. J Am Coll Cardiol,2014,64:512-519.
[29] Ieda M,Fu JD,Delgado-Olguin P,et al. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors.Cell,2010,142:375-386.
[30] Song K,Nam YJ,Luo X,et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature,2012,485:599-604.
[31] Toma C,Pittenger MF,Cahill KS,et al. Human mesenchymal stem cells differentiate to a cardiom yocyte phenotype in the adult murine heart. Circulation ,2002,105:93-98.
[32] D'Amario D,Cabral-Da-Silva MC,Zheng H,et al. Insulin-like growth factor-1 receptor identifies a pool of human cardiac stem cells with superior therapeutic potential for myocardial regeneration.Circ Res,2011,108:1467-1481.
[33] Guo J,Jie W,Shen Z,et al. SCF increases cardiac stem cell migration through PI3K/AKT and MMP-2/-9 signaling.Int J Mol Med,2014,34:112-118.
[34] Zacchigna S,Giacca M.Extra-and intracellular factors regulating cardiomyocyte proliferation in postnatal life. Cardiovasc Res,2014,102:312-320.
[35] Lai RC,Chen TS,Lim SK. Mesenchymal stem cell exosome:a novel stem cell-based therapy for cardiovascular disease. Regen Med,2011,6:481-492.
[36] Wen Z,Zheng S,Zhou C,et al. Repair mechanisms of bone marrow mesenchymal stem cells in myocardial infarction. J Cell Mol Med,2011,15:1032-1043.
[37] Kobayashi T,Hamano K, Li TS,et al. Enhancement of angiogenes is by the implantation of self bone marrow cells in a rat ischemic heart model. J Surg Res,2000,89:189-195
[38] Zhang Z,Wang JA,Xu Y,et al. Menstrual blood derived mesenchymal cells ameliorate cardiac fibrosis via inhibition of endothelial to mesenchymal transition in myocardial infarction.Int J Cardiol,2013,168:1711-1714.
[39] Guo S,Cheng Y,Ma Y,et al. Endothelial progenitor cells derived from CD34 + cells form cooperative vascular networks.Cell Physiol Biochem,2010,26:679-688.
[40] Fang J,Chen L,Fan L,et al. Enhanced therapeutic effects of mesenchymal stem cells on myocardial infarction by ischemic postconditioning through paracrine mechanisms in rats. J Mol Cell Cardiol,2011,51:839-847.
[41] Di Trapani M,Bassi G,Ricciardi M,et al. Comparative study of immune regulatory properties of stem cells derived from different tissues. Stem Cells Dev,2013,22:2990-3002.
[42] Hu X,Wu R,Jiang Z,et al. Leptin signaling is required for augmented therapeutic properties of mesenchymal stem cells conferred by hypoxia preconditioning. Stem cells,2014,32:2702-2713.
[43] Fu JD,Stone NR,Liu L,et al. Direct reprogramming of human fibroblasts toward a cardiomyocyte-like State. Stem Cell Reports,2013,1:235-247.

