完全血运重建有助于改善多支病变ST 段抬高心肌梗死患者运动后心率恢复
刘燕娥 赵威 祖凌云 白瑾 郭丽君 张福春 高炜
近年来,心血管疾病成为威胁人类健康的重要疾病之一,尤其是急性心肌梗死(acute myocardial infarction,AMI)发病突然,预后差。急诊经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)尽早开通梗死相关血管(infarct-related artery,IRA),可挽救濒死心肌,改善急性ST 段抬高心肌梗死 (ST-segment elevation myocardial infarction,STEMI)患者的预后。40% ~65%的STEMI 患者合并多支血管病变(multivessel coronary artery disease,MVD),相对单支病变患者而言预后不良[1]。对于合并MVD 的STEMI 患者,是否需要处理非IRA,目前尚存在争议。
自主神经功能紊乱与AMI 的发生、发展及预后密切相关[2]。运动后心率恢复(heart rate recovery,HRR)是临床上常用的评估自主神经功能的指标,异常HRR 是预测AMI 后心原性死亡的独立危险因素[3]。目前,关于是否完全血运重建(complete revascularization,CR)对AMI 后自主神经功能影响的研究尚少。本研究拟应用心肺运动试验(cardiopulmonary exercising testing,CPET)评 价STEMI 患者运动后心率恢复情况,并以此评估CR对AMI 后自主神经功能的影响,为合并MVD 的STEMI 患者介入治疗策略的选择提供参考依据。
1 对象与方法
1.1 研究对象
纳入2010 年7 月至2014 年10 月就诊于北京大学第三医院心内科接受急诊PCI、符合入选标准且资料完整的STEMI 患者。入选标准:(1)发病12 h 内就诊的STEMI 患者;(2)急诊PCI 成功,治疗后即刻IRA 残余狭窄<20%,达到TIMI 血流分级Ⅲ级;(3)年龄40 ~70 岁;(4)STEMI 急性期心功能为Ⅰ~Ⅱ级(Killip 分级),恢复期心功能Ⅰ级(NYHA 分级);(5)发病30 d 内接受CPET。STEMI诊断标准:(1)缺血性胸痛持续≥30 min。(2)心电图至少2 个相邻胸前导联ST 段抬高≥0.2 mV 或下壁导联ST 段抬高≥0.1 mV。(3)血清心肌坏死标志物浓度升高且具有动态改变。以上3 条均满足或满足(1)+(2)或(2)+(3)。
排除标准:(1)伴有急性肺水肿、严重心律失常及心原性休克等严重并发症。(2)合并其他系统严重疾病如恶性肿瘤、严重肝肾原发疾病及慢性肺病者。(3)病例资料不完整。
1.2 基线资料收集
回顾性收集患者相关临床资料,包括年龄、性别、身高、体重、高血压病、糖尿病、高脂血症、吸烟、早发冠心病家族史、心肌梗死部位、就诊时生命体征、心肌梗死急性期血脂、高敏C 反应蛋白、肌酸激酶同工酶(CK-MB)峰值、高敏肌钙蛋白T(TnT)峰值、N 末端B 型脑钠肽前体(NT-proBNP)、药物治疗情况、超声心动图等基线资料,并计算体质量指数(body mass index,BMI)。
1.3 血运重建方式
由两位经验丰富的心内科冠状动脉介入医师判断狭窄程度。冠状动脉及其主要分支血管管腔内径减少≥50%为有意义病变,即冠状动脉狭窄。全部患者均行急诊PCI 成功开通IRA。合并MVD 患者,发病14 d 内择期处理非IRA,根据冠状动脉病变严重程度、心肌缺血症状及患者意愿等予CR 及不完全血运重建(incomplete vascularization,IR)。
PCI 成功标准:TIMI 血流Ⅲ级,冠状动脉残余狭窄<20%。MVD 定义为直径超过2 mm 的主要冠状动脉和(或)主要分支中有≥2 支血管狭窄≥50%。CR 是指PCI 术后主要冠状动脉和(或)其分支血管未见狭窄≥70%的病变;IR 是指PCI 术后冠状动脉和(或)主要分支仍有血管狭窄≥70%,但未再次行介入治疗[4-5]。对无禁忌证患者术后常规应用双联抗血小板药物、他汀类药物、血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂及β 阻滞剂等二级预防药物治疗。
1.4 心肺运动试验
所有患者均在发病30 d 内接受CPET。测试方案采用改良BRUCE 方案,应用电动跑台进行运动测试,整个过程在心电监护及专业医师陪同下进行。应用运动心肺测试系统(Medgraphics,USA)测定静息心率、峰值心率(peak heart rate,HR)、最大摄氧量(peak oxygen uptake,VO2peak)。运动负荷试验终止后所有患者均在无负荷状态下继续观察5 min,记录患者每分钟的症状、心率、血压和心电图。分别计算心率储备、预测心率储备[6]、运动停止后1 min、2 min 心 率 恢 复(HRR1、HRR2)[7]、HRR 相 对 值(relative decline of heart rate recovery,% HRR1,%HRR2)[8]。
心率储备=运动中峰值心率-静息心率,单位:次/min
预测心率储备=164-(0.72 ×年龄)-静息心率,单位:次/min
HRR1=峰值心率-运动停止后1 min 心率,单位:次/min
HRR2=峰值心率-运动停止后2 min 心率,单位:次/min
%HRR1=HRR1/峰值心率×100%
%HRR2=HRR2/峰值心率×100%
采用症状限制运动试验,运动终止是指在运动过程中出现以下情况而停止,包括(1)运动中血压升高,收缩压大于 220 mmHg (1 mmHg =0.133 kPa)。(2)收缩压较静息时升高小于10 mmHg 或较静息时下降。(3)二级以上心绞痛(加拿大心绞痛分级)。(4)运动中出现恶性心律失常,包括室性心动过速、多源性室性早搏或Ⅱ度Ⅱ型以上房室传导阻滞、窦性停搏等。(5)出现心肌缺血性改变,即2 个连续肢体导联或胸导联ST 段水平或下斜型压低≥0.2 mV,或2 个连续导联(非梗死区)一过性ST 段抬高≥0.1 mV。(6)走路不稳、双下肢乏力、眩晕、头晕、面色苍白、疲劳、呼吸短促、喘息或患者要求休息等。
1.5 统计学分析
所有数据采用SPSS 20. 0 统计软件进行处理。对计量资料进行正态性检验,正态分布数据以 珋x ±s 表示,均数比较采用单因素方差分析,组间比较采用SNK 法,非正态分布数据以中位数(四位位间距)表示,组间比较采用Kruskal-Wallis检验,组间两两比较采用Mann-Whitney U 检验;多重比较时采用bonferroni 对检验水准进行调整;计数资料以例(百分比)表示,组间比较采用χ2检验;多因素分析采用多重线性回归分析。以P <0. 05 为差异有统计学意义。
2 结果
2.1 基线资料
本研究共纳入240 例STEMI 患者,其中男212 例(88.3%),平均年龄(55.5 ±10.9)岁。所有患者Killip 心功能分级为Ⅰ~Ⅱ级,且均接受标准冠心病二级预防治疗。根据冠状动脉病变情况将入选患者分为3 组:单支病变(SVD)组89 例(37.1%);完全血运重建多支病变(CR)组77 例(32.1%)。不完全血运重建多支病变(IR)组74 例(30.8%)。CR 组和IR 组统称为MVD 组。
与SVD 组相比,MVD 组合并糖尿病患者更多(P=0.034),但CR 组与IR 组比较,差异无统计学意义(P >0.05)。IR 组年龄显著高于SVD 组[(58.6 ±9.8)岁比(52.7±11.5)岁,P=0.001],但IR 组与CR组、SVD 组与CR 组间比较,差异无统计学意义(P >0.05)。CR 组置入多枚支架患者最多(62.3%),IR组次之(35.1%),SVD 组最少(10.1%),3 组间比较,差异有统计学意义(P <0.001)。与SVD 组相比,IR组VO2peak显著降低[(22.1 ±5.0)ml/(kg·min)比(24.5±5.1)ml/(kg·min),P =0.003],但SVD 组与CR 组、CR 组与IR 组间比较差异无统计学意义(P >0.05)。240 例患者中21 例(8.8%)运动后伴有缺血性ST 段改变,但3 组间比较,差异无统计学意义(P >0.05)。3 组间其他临床资料、生化指标、超声心动图指标及用药情况差异均无统计学意义(P >0.05,表1 和表2)。
2.2 HRR 相关指标的比较
统计分析显示,SVD 组、CR 组、IR 组3 组间HRR2(P=0.014)、%HRR2(P =0.026)、心率储备比较(P=0.025),差异具有统计学意义,其中CR组HRR2[(44.7 ± 14.0 )次/min 比 (40.1 ±11.6)次/min,P=0.036]、%HRR2[46.7 ±17.2)比(42.4 ± 14.7),P = 0.048]、心率储备[(66.0 ±17.0)次/min 比(60.7 ±15.4)次/min,P =0.039]显著高于IR 组,IR 组HRR2[(40.1 ±11.6)次/min比(46.1 ± 13.8)次/min,P = 0.005]、% HRR2[(42.4 ±14.7)比(50.2 ±21.6),P =0.007]、心率储 备 [(60.7 ± 15.4 )次/min 比 (67.2 ±14.6)次/min,P =0.010]显著低于SVD 组,而CR组与SVD 组比较差异无统计学意义(P >0.05)。3 组间HRR1、%HRR1、静息心率、峰值心率、血压、运动时间等比较,差异均无统计学意义(P >0.05)(表3)。
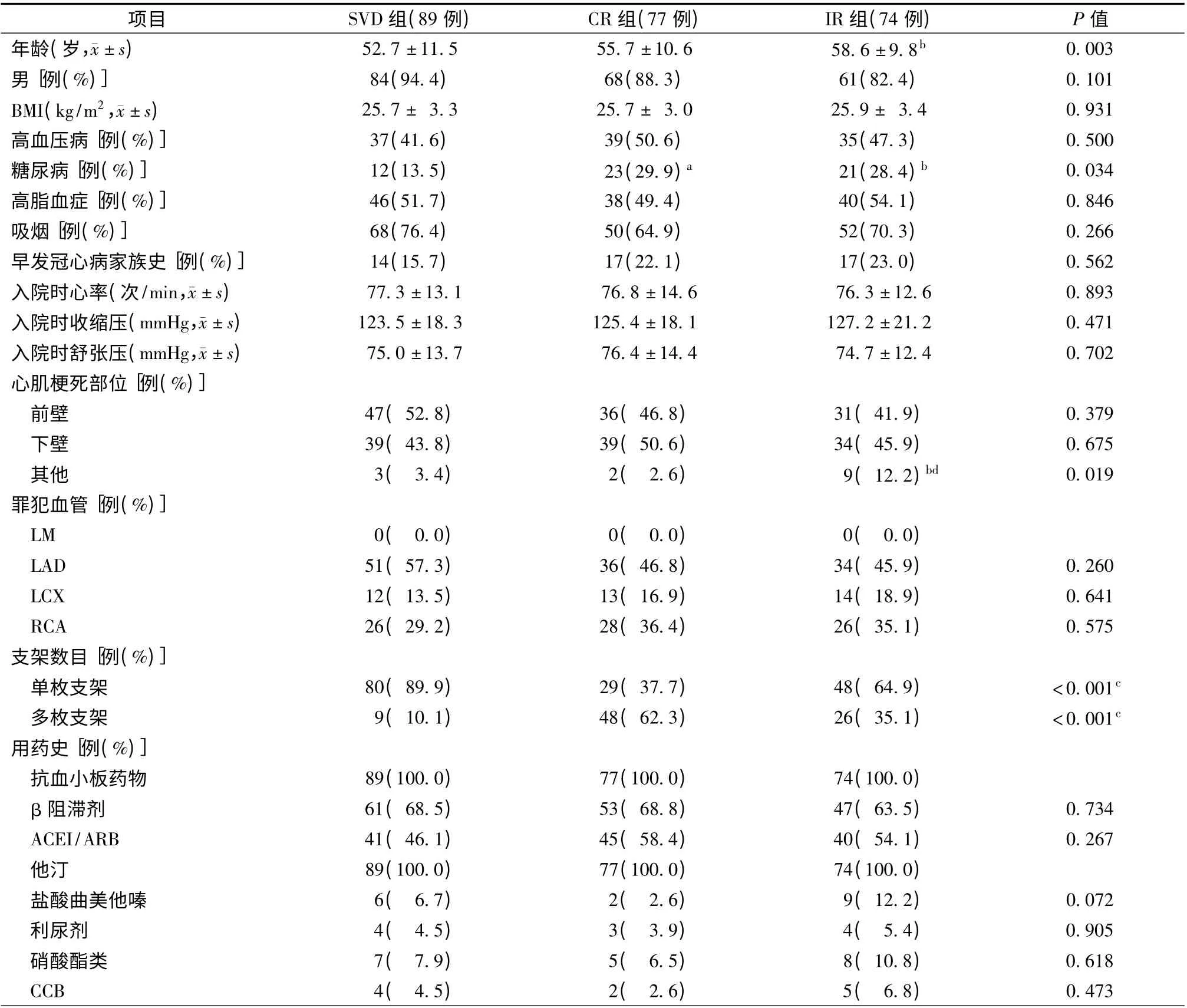
表1 三组患者临床资料比较
以是否CR、年龄、性别、BMI、冠心病危险因素、心肌梗死部位、CK-MBmax、NT-proBNP、舒张早期二尖瓣血流速度/二尖瓣环舒张早期峰值速度(E/Em)、左心室射血分数(LVEF)、静息心率、VO2peak、缺血性ST 改变、β 阻滞剂等为自变量,分别以HRR2、%HRR2、心率储备为因变量对MVD 患者作多元线性回归分析,结果显示,CR、VO2peak与HRR2呈独立正相关,E/Em、缺血性ST 改变与HRR2呈独立负相关;E/Em 与%HRR2、心率储备呈独立负相关,而CR 与%HRR2、心率储备均无相关(表4)。
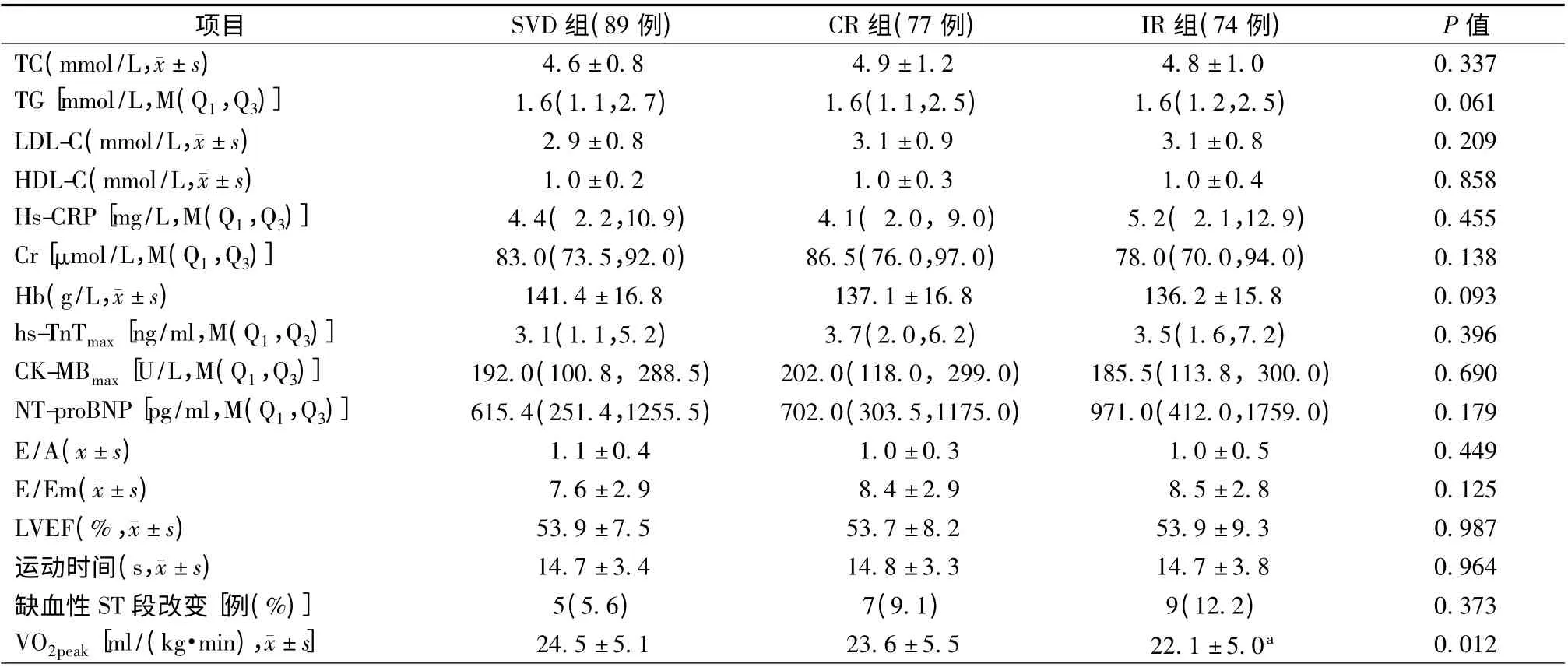
表2 三组患者生化、超声心动图、CPET 等相关指标的比较
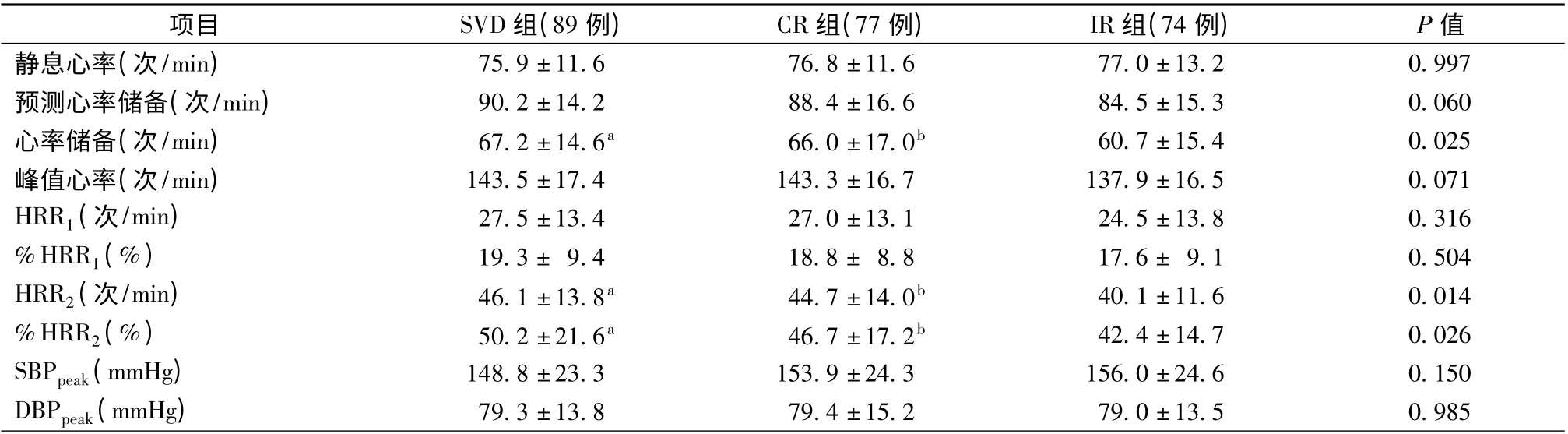
表3 三组患者HRR 等相关指标比较(珋x±s)
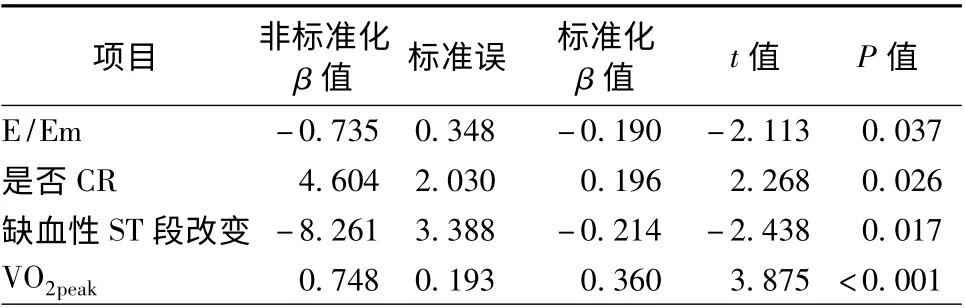
表4 HRR2 的多元线性回归分析
3 讨论
CR 和IR 作为MVD 的两种介入治疗策略,各有利弊,是目前学术界讨论的热点。2013 年美国心脏病学会基金会/美国心脏协会的STEMI 指南指出,对于无心原性休克的STEMI 患者急诊PCI 时仅处理IRA,有自发的心肌缺血症状(Ⅰc 类证据)或无创检查提示中高危心肌缺血患者(Ⅱa 类证据),推荐择期处理非IRA[1]。直接PCI 是STEMI 患者首选的再灌注疗法,对合并MVD 的患者,直接PCI 时原则上仅对IRA 治疗,但出院前完全血运重建有助于改善临床预后[9]。
AMI 后自主神经不均一重构[10]、心肌节段运动异常、心脏几何形状改变及室壁机械和化学感受器传入冲动的影响等[11]产生的总效应导致自主神经功能紊乱,主要表现为交感神经兴奋、迷走神经活性受抑制。心率是评估心脏自主神经功能的常见指标,而运动前后心率的变化受交感神经与迷走神经相互作用的影响,反映自主神经系统的平衡状态。运动停止后第1 个30 s 内心率的快速下降,可能主要归因于迷走神经系统再次被激活,而运动停止后2 min 心率下降,亦有交感神经撤退的参与[12]。HRR 是运动结束后各个时段即时心率与运动中峰值心率的差值,异常HRR 与迷走神经张力减弱、交感神经活性增强有关[6],是心血管事件的独立预测因子,且这种预测价值不受研究人群、药物治疗情况及基础健康状况的影响[13]。
本研究发现,CR 组和SVD 组HRR2显著高于IR 组,差异具有统计学意义;多元线性回归亦显示CR 是HRR2的独立影响因素,这提示CR 可改善STEMI 患者自主神经功能失衡状态。IR 组缺血性ST 段改变发生率高于CR 组和SVD 组,提示IR 组运动负荷状态心肌缺血发生率高,但3 组间比较差异无统计学意义,这可能与本研究样本量少有关。本研究中同时发现,缺血性ST 段改变是HRR2的独立影响因素。既往研究亦表明,异常HRR 与心肌缺血密切相关,可作为评估心肌缺血严重程度的指标[14]。故IR 组较CR 组自主神经功能受损严重的机制可能与IR 组仅开通罪犯血管、未能达到CR、长期缺血缺氧可损伤心脏迷走神经反射中枢、刺激心室壁的机械或化学感受器、发放神经冲动到延髓孤束核,从而影响自主神经平衡等有关[15-16]。CR 组HRR2显著高于IR 组,而HRR1两组间差异无统计学意义,推测这可能与CR 后STEMI 患者交感神经兴奋受抑制,而CR 对由于心肌缺血、缺氧所致的迷走神经损伤和坏死的修复影响较小有关,也可能与样本量少有关。
本研究发现,CR 可能对改善AMI 患者自主神经功能具有一定有益作用,这对于合并MVD 的STEMI 患者介入治疗策略的选择具有一定的参考价值,但由于本研究为小样本回顾性研究,仍需进一步对其相关性及机制进行前瞻性研究证实。
[1] O'gara PT,Kushner FG,Ausheim DD,et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction A Report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines.J Am Coll Cardiol,2013,61:485-510.
[2] Rizas KD,Nieminen T,Barthel P,et al. Sympathetic activityassociated periodic repolarization dynamics predict mortality following myocardial infarction. J Clin Invest,2014,124:1770-1780.
[3] Hai JJ,Siu CW,Ho HH,et al. Relationship between changes in heart rate recovery after cardiac rehabilitation on cardiovascular mortality in patients with myocardial infarction. Heart Rhythm,2010,7:929-936.
[4] Kalarus Z,Lenarczyk R,Kowalczyk J,et al. Importance of complete revascularization in patients with acute myocardial infarction treated with percutaneous coronary intervention. Am Heart J,2007,153:304-312.
[5] Meliga E,Fiorina C,Valgimigli M,et al. Early angio-guided complete revascularization versus culprit vessel PCI followed by ischemia-guided staged PCI in STEMI patients with multivessel disease. J Interv Cardiol,2011,24:535-541.
[6] Fletcher GF,Ades PA,Kligfield P,et al. Exercise standards for testing and training:a scientific statement from the American Heart Association. Circulation,2013,128:873-934.
[7] Morshedi-Meibodi A,Larson MG,Levy D,et al. Heart rate recovery after treadmill exercise testing and risk of cardiovascular disease events (The Framingham Heart Study). Am J Cardiol,2002,90:848-852.
[8] Maeder MT,Ammann P,Rickli H,et al. Impact of the exercise mode on heart rate recovery after maximal exercise. Eur J Appl Physiol,2009,105:247-255.
[9] 沈迎,张瑞岩,沈卫峰,等.急性ST 段抬高心肌梗死介入治疗策略:争议与思考. 中国介入心脏病学杂志,2015,23:121-124.
[10] Hannan EL,Samadashvili Z,Walford G,et al. Culprit vessel percutaneous coronary intervention versus multivessel and staged percutaneous coronary intervention for ST-segment elevation myocardial infarction patients with multivessel disease. JACC Cardiovasc Interv,2010,3:22-31.
[11] Cao JM,Chen LS,KenKnight BH,et al. Nerve sprouting and sudden cardiac death. Circ Res,2000,86 :816-821.
[12] Verrier RL,Zhao SX. The enigmatic cardiac fat pads:critical but under appreciated neural regulatory sites. J Cardiovasc Electrophysiol,2002,13:902-903.
[13] Okutucu S,Karakulak UN, Aytemir K,et al. Heart rate recovery:a practical clinical indicator of abnormal cardiac autonomic function. Expert Rev Cardiovasc Ther,2011,9:1417-1430.
[14] Fletcher GF,Ades PA,Kligfield P,et al. Exercise standards for testing and training:a scientific statement from the American Heart Association. Circulation,2013,128:873-934.
[15] Ghaffari S,Kazemi B,Aliakbarzadeh P,et al. Abnormal heart rate recovery after exercise predicts coronary artery disease severity. Cardiol J,2011,18:47-54.
[16] 李国彰,张志雄,何承敏,等. 神经生理学. 北京:人民卫生出版社,2007:310-311.

