Toll样受体4在成骨细胞共培养体系中对干细胞向破骨细胞分化的影响及机制
朱华荣,徐晓峰,陈奇,吴巍,魏长宝,曹学书
(1.江苏大学附属医院骨科,江苏镇江212001;2.华中科技大学同济医学院附属同济医院骨科,湖北武汉430030)
Toll样受体4在成骨细胞共培养体系中对干细胞向破骨细胞分化的影响及机制
朱华荣1,徐晓峰1,陈奇1,吴巍2,魏长宝1,曹学书1
(1.江苏大学附属医院骨科,江苏镇江212001;2.华中科技大学同济医学院附属同济医院骨科,湖北武汉430030)
目的:探索Toll样受体(Toll like receptor,TLR)-4在成骨细胞共培养体系中对干细胞向破骨细胞分化的影响及机制。方法:Percoll密度梯度离心法分离原代大鼠骨髓间充质干细胞(bonemarrow mesenchymal stem cells,BMSCs),流式细胞术鉴定细胞表面标志物CD34、CD44、CD54、CD90。用Transwell小室建立干细胞(上室)-成骨细胞(下室)共培养体系,在此体系下对BMSCs进行破骨细胞诱导培养。将共培养体系分为TLR-4激活组和空白组,前者以TLR-4激动剂LPS(10 ng/mL)激活,后者加入等体积PBS。在诱导培养第6天,对上室细胞行抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色,计数并比较各组破骨细胞数。同时,蛋白质印迹检测各组下室细胞悬液中核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)的蛋白表达,观察电泳条带并行定量分析。结果密度离心法获得原代大鼠BMSCs,流式细胞分析检测显示CD34阴性、CD44、CD54和CD90阳性。TRAP染色阳性细胞为破骨细胞,细胞计数显示,TLR-4激活组破骨细胞数明显多于空白组(t=13.556,P<0.05)。蛋白质印迹结果显示,TLR-4激活组RANKL的表达明显多于空白组(t=17.630,P<0.05)。结论:在成骨细胞共培养体系下,激活TLR-4能够促进BMSCs向破骨细胞分化,其机制可能与TLR-4促进成骨细胞分泌RANKL有关。
干细胞;Toll样受体-4;破骨细胞;核因子κB受体活化因子配体
干细胞定向分化的调节是近年来的研究热点之一,许多信号分子参与其中,Toll样受体(Toll like receptor,TLR)就是其中之一。TLR不仅能调节干细胞的增殖[1],还能调节干细胞向成骨方向的分化[2]。我们前期实验结果表明,TLR-4作为干细胞表面主要的TLR亚型之一,在大鼠骨髓间充质干细胞(bonemarrow mesenchymal stem cells,BMSCs)成骨过程的不同阶段所起的作用也不同[3]。脂多糖是革兰阴性菌细胞壁的成分,能够通过抗原抗体反应特异性地激活TLR-4,是TLR-4的特异性激动剂。LPS激活的TLR-4能够促进BMSCs分化为成骨细胞,但在成骨细胞矿化形成骨细胞的阶段,激活的TLR-4则起抑制作用,推测可能与TLR-4参与调节破骨细胞的分化有关。为了证实该假设,我们设计了本实验,研究在成骨细胞共培养体系下,TLR-4对BMSCs向破骨细胞分化的影响及其可能的机制。
1 材料与方法
1.1 材料
成年SD大鼠(清洁级)8只,雌雄不限,90~100 g,由江苏大学动物实验中心提供,合格证号:SCXK(苏)2013-0036。L-DMEM、H-DMEM(Hyclone,美国),脂多糖(Sigma,美国),大鼠成骨细胞株(ATCC,美国),胎牛血清(Gibco公司,美国),胰蛋白酶(Amersco,美国),双抗(1∶1的青霉素和链霉素,华北制药),Percoll细胞分层液(Pharmacia公司,美国),多聚赖氨酸玻片(Fisher公司,美国),羊抗大鼠CD34、CD44、CD54、CD90抗体(Santa Cruz公司,美国),SABC免疫组化试剂盒、DAB显色试剂盒(武汉博士德),Trizol试剂盒(Invitrogen公司,美国),逆转录试剂盒(ToYoBo公司,日本),酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒、DMSO、DEPC、溴化乙啶、溴酚蓝、琼脂糖(Sigma公司,美国),Transwell小室(12孔,8μm,Corning公司,美国);CO2恒温培养箱(Thermo公司,美国),DMI4000B倒置相差荧光显微镜(Leica公司,德国),凝胶成像分析系统(Bio-Rad公司,美国)。
1.2 实验方法
1.2.1 BMSCs的分离、培养及传代 取清洁级SD大鼠,颈椎脱位法处死,于75%乙醇中浸泡15 min。无菌条件下解剖并取出四肢长管骨。以L-DMEM培养液(10%胎牛血清)将骨髓组织冲出髓腔后,均匀吹打制成悬液,加入含Percoll分层液(1.077 g/ mL)的离心管,体积比为1∶1,1 500 r/min离心20 min。吸取离心管中层白色细胞带中的细胞,PBS冲洗3次。将细胞置于培养皿中,加入培养液,调整细胞密度至2×105/mL,分别接种于培养瓶中,放入培养箱中,37℃,5%CO2孵育。每3 d更换1次培养液,直至细胞长满瓶底80%时传代。传至第3代,备用。
1.2.2 BMSCs的鉴定 取第3代BMSCs,以0.1 mmol/L胰酶消化后制成单细胞悬液,密度为107/ mL,加入EP管(100μL),分别加入异硫氰酸荧光素(FITC)标记的抗鼠单克隆抗体CD34、CD44、CD54、CD90;同型对照管分别加入同量的抗鼠FITC-IgG,冰上避光孵育30 min,PBS洗涤3次,1 000 r/min离心5 min,分别加入500μL PBS重新制成细胞悬液,流式细胞仪分析。
1.2.3 BMSCs和成骨细胞的共培养、分组及破骨细胞诱导 取Transwell小室(12孔/板,孔径为8 μm,未铺基质胶),以无血清L-DMEM平衡1 h。下室加入成骨细胞悬液50μL(1×106/mL),上室加入BMSCs悬液50μL(1×104/mL)。分为TLR-4激活组和空白组,每组12孔,其中TLR-4激活组在下室中加入TLR-4激动剂脂多糖(Sigma公司,L2630-10MG 10 ng/mL)50μL。空白组加入等体积PBS。两组均在上室中加入破骨细胞诱导培养液培养[胎牛血清20%,25 ng/mL GM-CSF,10-8mol/L 1,25(OH)2D3]。
1.2.4 TRAP染色检测破骨细胞 在培养第6天,分别取2组上室细胞悬液制成细胞爬片,固定液固定(37℃,30 s),37℃去离子水漂洗1 min。将配置好的染色液(快速石榴石型碱溶液5μL,亚硝酸盐溶液5μL,萘酚AS-BI磷酸溶液5μL,醋酸盐溶液20μL,37℃预热的去离子水450μL,酒石酸盐溶液10μL)加入培养皿中预热至37℃,放入细胞爬片,37℃避光孵育1 h,去离子水漂洗1 min。碱性自来水冲洗3~5 min,直至核呈蓝色。自然晾干,甘油明胶封片,显微镜观察,细胞计数仪计数,定量分析。
1.2.5 共培养体系中RANKL检测 在培养第6天,分别取2组下室细胞悬液,以β-肌动蛋白作为内参,蛋白质印迹法检测核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)的蛋白表达,蛋白条带用FluorChem FC3软件分析。
1.3 统计学分析
以SPSS 16.0进行统计学分析,实验数据以均数±标准差表示,两组间均数比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs的鉴定
原代BMSCs形态较为一致,呈短梭形或多边形,5~7 d后有明显集落形成,10 d左右细胞出现融合,呈成纤维细胞样,漩涡状或螺旋状排列。传代培养的BMSCs呈长梭形,形态更均一。见图1。细胞生长旺盛,4 d左右细胞融合达90%,7 d左右生长减缓。实验中第3代细胞活性最佳,第5代以后逐渐老化,故选择第3代细胞研究。
流式细胞分析结果显示,细胞表面CD34呈阴性,CD44、CD54、CD90呈阳性(图2),证实分离培养所得细胞为BMSCs。
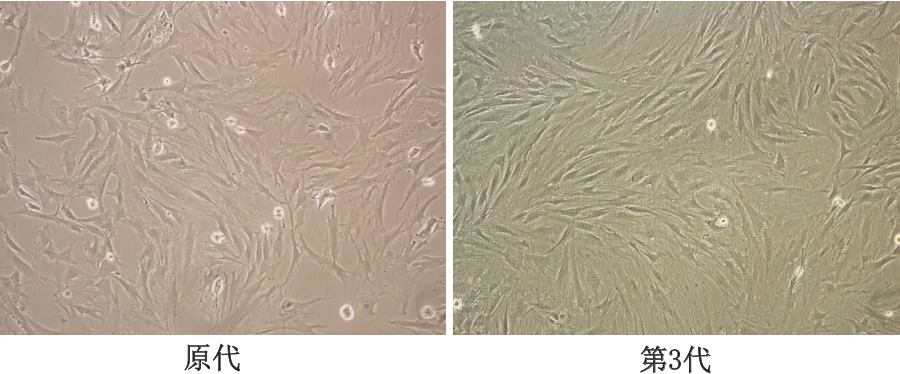
图1 大鼠BMSCs的形态(×40)
2.2 破骨细胞的TRAP染色及计数分析
TRAP染色结果呈阳性,胞质中出现红色沉淀,提示为破骨细胞(图3)。定量计数各组每孔破骨细胞数目,TLR-4激活组平均破骨细胞数(55.83± 2.44)明显多于空白组(37.50±2.20),差异具有统计学意义(t=13.556,P<0.05)。由此表明,在成骨细胞共培养环境下,激活TLR-4能够促进BMSCs分化为破骨细胞。

图2 流式细胞术鉴定大鼠BMSCs
2.3 共培养体系中RANKL的蛋白表达
蛋白质印迹结果表明,TLR-4激活组的RANKL表达明显强于空白组(t=17.630,P<0.05),说明在成骨细胞共培养体系中,激活TLR-4能够促进RNAKL的表达。见图4。
3 讨论
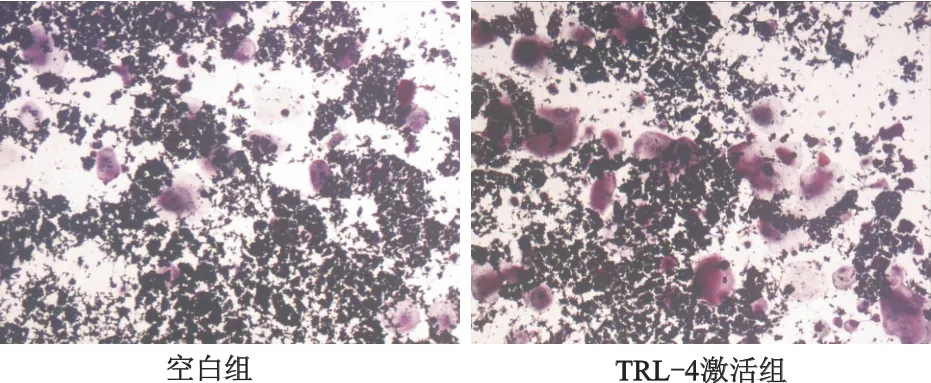
图3 破骨细胞的鉴定(TRAP染色×200)
骨改建是成熟骨组织形成过程中的重要环节,由成骨细胞和破骨细胞协同完成。破骨细胞主要起骨吸收作用,溶解不成熟以及老化凋亡的骨细胞,成骨细胞起成骨作用,形成新的骨细胞。成骨细胞和破骨细胞相互作用,共同维持骨代谢的动态平衡。TLR是细胞表面一类重要的模式识别受体,属于I型跨膜蛋白,参与免疫启动、炎性调节、细胞增殖等许多生理机能的调节,TLR-4是人类干细胞表面主要表达的主要亚型之一[4]。在成骨细胞和破骨细胞协同参与的骨代谢过程中,TLR-4起重要作用。一方面,TLR-4抑制破骨细胞中Wnt/β-certin通路,从而抑制成骨细胞的矿化[5],这与我们前期研究的结果相一致[3];另一方面,TLR-4能够下调破骨细胞前体细胞上的RANK的表达,抑制破骨细胞的形成[6]。

图4 各组RANKL蛋白的表达
但骨代谢的过程并非在破骨细胞单独存在的孤立微环境中完成的,TLR-4对成骨细胞的作用可能影响破骨细胞的分化。Vijayan等[7]研究发现,抑制破骨细胞前体细胞的TLR-4/MyD88/NF-κB通路能够降低骨丢失引起的骨质疏松。而Grevers等[8]研究发现激活TLR-4能够增强破骨细胞的骨吸收作用。本实验结果显示,在成骨细胞共培养的环境中,TLR-4激活组TRAP染色阳性的破骨细胞较空白组明显增多(P<0.05),说明在成骨细胞共培养体系中,激活TLR-4能够促进BMSCs向破骨细胞分化,其机制可能与RANKL/RANK通路的活化有关。RANKL/RANK通路是调节破骨细胞分化、激活和凋亡的重要信号通路[9],可以通过NF-κB,JNK以及p38等下游信号通路促进破骨细胞的分化[10]。而骨保护素(osteoprotegerin)则通过竞争性结合RANKL抑制RANKL/RANK通路,从而抑制破骨细胞的形成[11-12]。激活的TLR-4能够诱导干细胞分泌IL-6、IL-8和TNF-β等炎性因子[13],而这些炎性因子能促进成骨细胞分泌RANKL,从而促进干细胞向破骨细胞分化[14]。本实验构建的成骨细胞共培养体系中,TLR-4激活组的RANKL表达明显强于空白组(P<0.05),说明激活TLR-4能够提高成骨细胞共培养环境中RANKL的蛋白表达量。
综上所述,在成骨细胞共培养环境下,激活TLR-4能够促进BMSCs向破骨细胞分化,其机制可能与激活TLR-4促进成骨细胞分泌RANKL,从而活化RANKL/RANK通路有关。
[1] 何晓霞,白海,杨国嵘,等.Toll样受体3和4在人骨髓间充质干细胞中的表达和活化对细胞增殖的影响[J].中国医科大学学报,2012,41(2):162-165.
[2] Raicevic G,Najar M,Pieters K,et al.Inflammation and Toll-like receptor ligation differentially affect the osteogenic potential of human mesenchymal stromal cells depending on their tissue origin[J].Tissue Eng Part A,2012,18(13/14):1410-1418.
[3] 徐晓峰,王晓光,陈奇,等.Toll样受体对大鼠骨髓间充质干细胞成骨的影响[J].中华实验外科杂志,2014,31(7):1416-1418.
[4] Liotta F,Angeli R,Cosmi L,et al.Toll-like receptors 3 and 4 are expressed by human bone marrow-derived mesenchymal stem cells and can inhibit their T-cell modulatory activity by impairing Notch signaling[J].Stem Cells,2008,26(1):279-289.
[5] 白庆霞,杨博,张艳,等.Toll样受体4与经典Wnt信号在破骨样细胞中作用机制的初步研究[J].牙髓牙周病杂志,2013,23(3):157-161.
[6] Ji JD,Park-Min KH,Shen Z,et al.Inhibition of RANK expression and osteoclastogenesis by TLRs and IFN-γin human osteoclast precursors[J].J Immunol,2009,183(11):7223-7233.
[7] Vijayan V,Khandelwal M,Manglani K,et al.Methionine down-regulates TLR4/MyD88/NF-κB signalling in osteoclast precursors to reduce bone loss during osteoporosis[J].Br JPharmacol,2014,171(1):107-121.
[8] Grevers LC,de Vries TJ,Vogl T,et al.S100A8 enhances osteoclastic bone resorption in vitro through activation of Toll-like receptor 4:implications for bone destruction inmurine antigen-induced arthritis[J].Arthritis Rheum,2011,63(5):1365-1375.
[9] Kostenuik PJ.Osteoprotegerin and RANKL regulate bone resorption,density,geometry and strength[J].Curr Opin Pharmacol,2005,5(6):618-625.
[10] Liu W,Xu D,Yang H,et al.Functional identification of three receptor activator of NF-κB cytoplasmic motifs mediating osteoclast differentiation and function[J].J Biol Chem,2004,279(52):54759-54769.
[11] Khosla S.Minireview:the OPG/RANKL/RANK system[J].Endocrinology,2001,142(12):5050-5055.
[12] 徐晓峰,陈海宁,陈琛,等.骨质疏松症大鼠股骨节段性骨缺损边缘区域骨保护素基因的表达[J].中国组织工程研究,2012,16(37):6847-6850.
[13] Lepperdinger G.Inflammation and mesenchymal stem cell aging[J].Curr Opin Immunol,2011,23(4):518 -524.
[14] Krisher T,Bar-Shavit Z.Regulation of osteoclastogenesis by integrated signals from toll-like receptors[J].J Cell Biochem,2014,115(12):2146-2154.
Effects and mechanism of Toll like receptor-4 in osteoclastgenesis of stem cells in co-culture system w ith osteoblast
ZHU Hua-rong1,XU Xiao-feng1,CHEN Qi1,WUWei2,WEIChang-bao1,CAO Xue-shu1
(1.Department of Orthopedics,Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001;2.Department of Orthepeadic,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan Hubei430030,China)
Objective:To investigate the effect of Toll like receptor(TLR)-4 to osteoclastgenesis of stem cells to osteoclasts in co-culture system with osteoblast,and to research the probably mechanism.M ethods:Bonemarrow mesenchymal stem cells(BMSCs)of ratwere abstracted with percoll density gradient centrifugationmethod.Surfacemaker CD34,CD44,CD54,and CD90 were identified with flow cytometry.BMSCs(upper cell)-osteoblasts(lower cell)co-culture system was established with Transwell cells,BMSCswere induced to osteoblasts in this system.Co-culture system were divided into TLR-4 activated group and blank group.Cells in TLR-4 activated group were activated by LPS(10 ng/mL),cells in blank group were treated with PBS of the same volume.After 6 days culture,tartrate resistant acid phosphatase(TRAP)stainingwas performed to examine osteoclasts in the lower cell.Osteoclasts numbers in each group were counted and compared.Meanwhile,western blotting was performed to investigate the expression of receptor activator for nuclear factor-κB ligand(RANKL).Results:BMSCs of ratwere abstracted with density gradient centrifugation method.Surfacemaker CD34 was negative,while CD44,CD54,and CD90 were positive.TRAP staining positive cell was osteoclasts.Osteoclasts numbers in each group were counted,itwas obviously higher in TLR-4 activated group than that in blank group(t=13.556,P<0.05).Results of western blotting showed RANKL expression in TLR-4 activated group was higher than that in blank group(t =17.630,P<0.05).Conclusion:In“BMSCs-osteoblasts”co-cultured system,activation of TLR-4 is benefit to the osteoclastgenesis of stem cells.The promotion of TLR-4 to the secretion of RANKLmay be the mechanism.
stem cells;Toll like receptor-4;osteoclast;receptor activator for nuclear factor-κB ligand
R329.2 [文献标志码] A [文章编号] 1671-7783(2015)03-0221-04
10.13312/j.issn.1671-7783.y140318
朱华荣(1984—),男,硕士研究生;陈奇(通讯作者),主治医师,E-mail:jackiechanoth@163.com
2014-12-09 [编辑] 刘星星

