基于银纳米增强的化学发光法检测对苯二酚
曹俊涛,王 辉,刘启祥,刘彦明
(信阳师范学院 化学化工学院, 河南 信阳 464000)
0 引言
对苯二酚(HQ)是一种重要的化工原料和有机合成中间体.其作为还原剂、抗氧化剂、聚合抑制剂以及其他化学中间体已被广泛使用.由于对苯二酚毒性较高且在生态系统中降解困难,其正成为一种重要的环境污染物,对人类健康产生威胁.因此,建立简单、快速、灵敏检测对苯二酚的新方法具有重要意义.目前测定对苯二酚的主要方法有分光光度法[1]、高效液相色谱法[2]、荧光法[3]、局部表面等离子体共振光散射[4]、电化学法[5]等.这些方法均有其独特的优点,但也存在一些不足之处,如灵敏度不高、装置价格昂贵、耗时、难以实现自动化和连续分析等.
流动注射分析(FI)是溶液自动在线处理及测定的现代分析技术,具有分析速度快、准确度和精密度高、设备和操作简单、通用性强、试样和试剂用量少等特点.化学发光分析方法(CL)具有检测灵敏度高、线性范围宽、仪器设备价格低等诸多优点受到研究者的青睐.将CL检测技术与FI分析法联用形成的FI-CL不仅具有FI的各种优点还保存了CL的特点,已越来越多的应用于样品在线分析[6-12].近年来,纳米材料以其优良的光、电、磁或催化性能在电化学、荧光、表面等离子共振光散射、化学发光等检测当中应用广泛[13-14].我们发现,银纳米粒子(AgNPs)对化学发光体系具有优良的催化性能,对提高CL反应灵敏度具有显著增强作用.基于此,我们构建luminol-K3Fe(CN)6-AgNPs CL体系,而HQ对luminol- K3Fe(CN)6-AgNPs 化学发光体系具有显著的抑制作用,结合流动注射技术提出了luminol-K3Fe(CN)6-AgNPs化学发光灵敏检测对苯二酚的新方法.
1 实验部分
1.1 仪器装置
IFFM-E型FI-CL分析仪(西安瑞迈分析仪器有限公司);聚四氟乙烯管(内径0.8 mm);Cary Eclipse型荧光分光光度计(Varian,美国),使用前关闭激发光源;UVmini-1240型紫外可见分光光度计(Shimadzu,日本);JEM-2100F型200 kV场发射透射电子显微镜(TEM,日本电子株式会社JEOL,日本).
1.2 试剂与溶液
对苯二酚、K3Fe(CN)6、NaBH4、Na3C6H5O7·2H2O和AgNO3均购于国药集团化学试剂有限公司;1.0 × 10-2mol · L-1鲁米诺(luminol,苏州亚科化学试剂股份有限公司)储备液用0.1 mol · L-1NaOH配制;所用其他试剂均为分析纯.实验溶液均由18.2 MΩ·cm纯水(台湾艾柯-成都康宁实验专用纯水设备厂)配制.所有储备液保存于4 ℃冰箱中.实验中所需各种工作溶液均由储备液当天稀释后配制而成.
1.3 实验方法
基于AgNPs对luminol-K3Fe(CN)6化学发光的强增强作用构建化学发光体系,利用对苯二酚对该体系的强烈抑制作用实现对苯二酚的灵敏检测.化学发光反应线路如图1所示,luminol(c管)和K3Fe(CN)6(d管)溶液预先经P2泵入FI发光测量仪,而对苯二酚(或空白)样品(a管)溶液和AgNPs(b管)经P1泵入,样品进入流通池后与反应溶液发生反应,并产生CL信号,最后由计算机记录数据.未注入对苯二酚样品时,测得信号的相对发光强度记为I0,为发光体系的空白信号;当注入对苯二酚样品时,所测信号为抑制的CL信号,记为Is,则该样品对的发光强度抑制量ΔICL=Is-I0,样品的浓度与ΔICL呈正比关系,据此可得到标准曲线,然后以同样的测定方法再结合标准曲线就能测定对苯二酚的含量.

a.对苯二酚; b.AgNPs; c.luminol 溶液; d.K3Fe(CN)6溶液; P1.主蠕动泵; P2.副蠕动泵; Y1和Y2.混合器; S.六通阀进样器; F.流通池; W.废液; PMT.光电倍增管; NHV.光电倍增管的负高压; PC.计算机.图1 FI-CL检测系统示意图Fig.1 Schematic diagram of the FI-CL system
1.4 AgNPs的合成
AgNPs采用文献[15]方法制备.首先,称取0.004 25 g AgNO3和0.007 35 g Na3C6H5O7· 2H2O溶于100 mL水中(二者浓度均为0.25 mmol · L-1),搅拌30 s.然后将新配制的3 mL,1.0 mmol ·L-1NaBH4快速加入上述混合溶液中,溶液颜色立即变为黄色,持续搅拌60 s.所制备AgNPs溶液于4 ℃冰箱中保存.
2 结果与讨论
2.1 AgNPs的表征
AgNPs的粒径大小、形态和分散性通过透射电子显微镜进行表征.如图2a所示,AgNPs的平均粒径约为5 nm, 浓度约6.5 × 10-8mol ·L-1[16].紫外可见光谱表明,所制备的AgNPs在390 nm处有一个强表面等离子共振峰(见图2b).

图2 AgNPs的TEM图(a)和UV-vis吸收光谱(b)Fig.2 TEM image (a) and UV-vis spectrum (b) of AgNPs
2.2 CL检测条件优化
2.2.1 NaOH浓度的影响
鲁米诺的化学发光反应通常在碱性介质(如NaOH)中进行.考察了NaOH浓度在0.01~0.2 mol· L-1范围内对ΔICL的影响.结果表明,ΔICL随着NaOH浓度的增加而增强,在0.15 mol ·L-1时ΔICL达到最大,之后逐渐降低.所以,选择0.15 mol · L-1NaOH作为稀释luminol储备液的缓冲介质.
2.2.2 Luminol浓度的影响
作为发光剂,luminol的浓度有重要影响.考察了luminol在1.0 × 10-6~1.0 × 10-5mol · L-1浓度范围内对ΔICL的影响.ΔICL随着luminol浓度的增加而增强,至8.0 × 10-6mol ·L-1后逐渐降低.因此,选取luminol的浓度为8.0 × 10-6mol ·L-1.
2.2.3 K3Fe(CN)6浓度的影响
考察了氧化剂K3Fe(CN)6浓度在1.0 × 10-6~1.0 × 10-5mol ·L-1范围内对ΔICL的影响.在1.0 × 10-6~5.0 × 10-5mol ·L-1内ΔICL随浓度增加而增强,当K3Fe(CN)6浓度高于1.0 × 10-5mol ·L-1后ΔICL逐渐减弱.K3Fe(CN)6的最佳浓度选择为1.0 × 10-5mol ·L-1.
2.2.4 AgNPs浓度的影响
在luminol-K3Fe(CN)6-AgNPs发光体系中,作为增强信号的AgNPs的浓度对CL信号也有重要的影响.考察了6.5 × 10-10~6.5 × 10-8mol ·L-1浓度范围内AgNPs的影响.ΔICL随着AgNPs浓度的增加而增强,当浓度高于3.2 × 10-8mol ·L-1时,ΔICL增强较小.选择AgNPs 的浓度为3.2 × 10-8mol ·L-1.
2.3 FI-CL运行参数优化
为了获得高的检测灵敏度和好的重现性,对采样和测量的运行时间及P1和P2的流速进行了优化,结果列于表1.
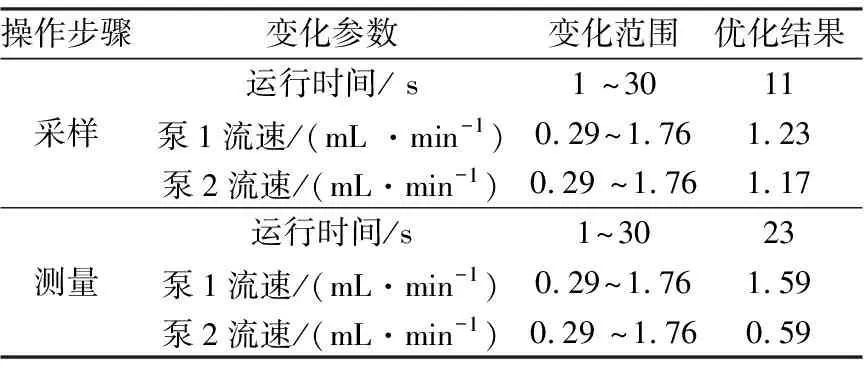
表1 FI-CL系统运行参数优化及结果Tab.1 Effect of running parameters of FI-CL system and the optimum values
由表1可知,所提出的FI-CL方法测定一个HQ样品的时间为34 s,即样品的测定速率约为105 个/h.
2.4 线性范围、检出限和重现性
在优化实验条件下,对HQ进行检测,发现线性范围在1.0 × 10-10~1.0 × 10-7mol ·L-1,线性方程为ΔICL= 3 889.1 + 1.1 × 1011C(C为HQ浓度, mol ·L-1),相关系数r= 0.996,检出限为3.0 × 10-11mol ·L-1.对5.0 × 10-9mol ·L-1HQ平行测定11次,RSD为1.4%.
2.5 干扰实验
在选定实验条件下,考察了一些可能共存物质对HQ测定的影响.选用5.0 × 10-9mol ·L-1HQ 溶液,当干扰水平不超过± 5 %时,认为基本不干扰.结果表明,1 000倍的Na+、K+、Cl-、Br-、Ac-、CO32-,500倍的淀粉、葡萄糖、柠檬酸、SO32-、C2O42-,100倍的Ca2+、Mg2+、Zn2+、Al3+,10 倍的Cr3+、Cu2+、NO2-,1倍的多巴胺、抗坏血酸、苯酚基本不干扰.
2.6 实际样品分析
将提出的方法应用于信阳某一河水和自来水中HQ的测定.结果表明,在河水和自来水中均未检出HQ.又进行了3个不同浓度水平HQ的加标回收实验,结果见表2.

表2 提出的FI-CL方法测定不同浓度水平HQ在河水和自来水中的回收率Tab.2 Recovery for HQ at different spiked levels in river water and tap water samples by the FI-CL method
由表2可知,HQ的加标回收率为98.0%~100.8%(河水)和99.1%~100.4%(自来水),峰高的RSD不大于2.5%,结果令人满意.
2.7 机理研究
实验表明,AgNPs对luminol-K3Fe(CN)6化学发光体系具有增强作用,HQ对luminol-K3Fe(CN)6-AgNPs体系具有抑制效应,结果见图3.为了探讨反应机理,进行了CL光谱实验(见图4).CL光谱表明,luminol-K3Fe(CN)6、luminol-K3Fe(CN)6-AgNPs和luminol-K3Fe(CN)6-AgNPs-HQ体系的最大发光波长均为425 nm,与3-aminophthalate(luminol的氧化产物)的发光光谱一致,说明上述3个CL反应体系均应是3-aminophthalate发光.文献[13-14]报道AgNPs作为催化剂可催化溶解氧生成含有活性氧的反应中间体如OH·、O2·-等,据此推导AgNPs增强luminol-K3Fe(CN)6体系的可能反应机理如下:
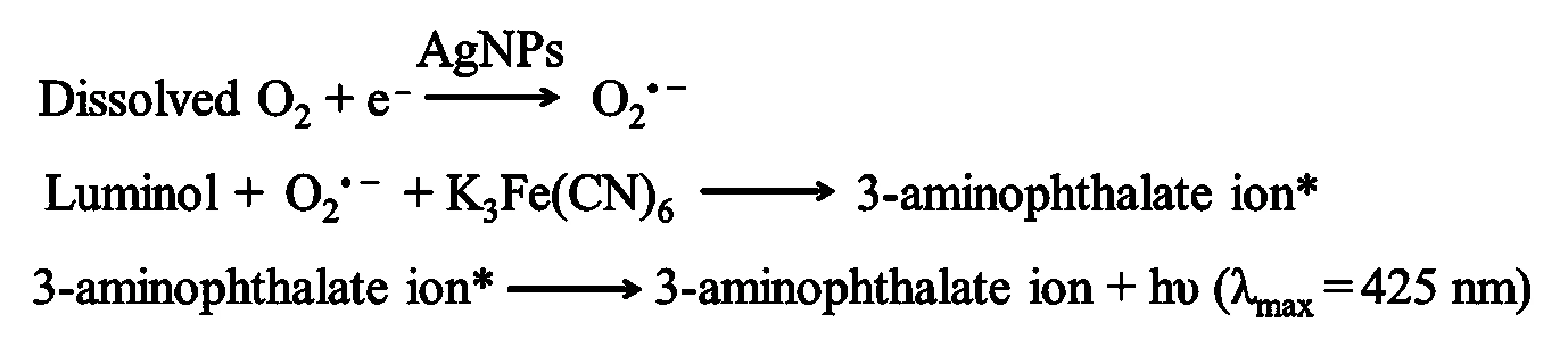
当HQ引入luminol-K3Fe(CN)6-AgNPs体系时,HQ分子结构中的羟基和luminol中间体发生反应从而抑制CL信号.

图3 HQ对luminol-K3Fe(CN)6-AgNPs化学发光反应的抑制作用Fig.3 HQ inhibition on luminol-K3Fe(CN)6-AgNPs CL reactionConditions: a. luminol-K3Fe(CN)6;b. luminol-K3Fe(CN)6-AgNPs;c. b + 1.0 × 10-9 mol ·L-1 HQ;d. b +1.0 × 10-7 mol ·L-1 HQ

图4 化学发光光谱 Fig.4 Chemiluminescence spectrum of reactions(1) luminol-K3Fe(CN)6; (2) (1) + AgNPs; (3) (2) + HQ.
Condition:luminol, 8.0 × 10-6mol·L-1(0.15mol·L-1NaOH);K3Fe(CN)6, 1.0 × 10-5mol·L-1;AgNPs, 3.2 × 10-8mol·L-1;andHQ, 2.0 × 10-7mol·L-1
3 结论
基于在碱性介质中HQ对luminol-K3Fe(CN)6-AgNPs化学发光体系的显著抑制作用,建立了一种简单、快速、灵敏的FI-CL测定HQ的新方法,并应用于河水和自来水的测定.结合化学发光光谱探讨了反应机理.该方法在环境样品中HQ检测具有应用前景.

