榨菜叶中RNA提取及硫苷酶基因序列测定与分析
张燕,侯坤兰
(1.长江师范学院生命科学与技术学院,重庆,408100;2.重庆长江师范学院)
榨菜叶中RNA提取及硫苷酶基因序列测定与分析
张燕,侯坤兰
(1.长江师范学院生命科学与技术学院,重庆,408100;2.重庆长江师范学院)
采用Trizol试剂法从榨菜叶中提取RNA,采用RT-PCR技术扩增得到硫苷酶基因保守序列,利用DNAman7生物信息分析软件对测得的保守序列与菜心硫苷酶基因保守序列进行比对,翻译核苷酸和蛋白质序列与芸薹属油菜、菜心、甘蓝、芥菜等序列进行相应的比对。结果表明,采用Trizol试剂法能获得320 bp的基因保守序列;与甘蓝、菜心硫苷酶基因保守序列比对结果的Identity为97.12%;与芸薹属油菜、菜心、甘蓝等进行相应的翻译核苷酸和翻译成蛋白质序列比对分析,发现序列的覆盖度与相似度均达到较高的水平。
榨菜;硫苷酶基因;保守序列
硫苷酶即硫代葡萄糖苷酶,主要存在于十字花科植物中,能催化硫代葡萄糖苷即硫苷,水解产生异硫代氰酸盐、葡萄糖、硫代氰酸盐等物质,有较好的防癌和抗菌功效[1,2]。同时,硫苷—硫苷酶系统作为植物本身来说是一个很好的自我防备体[3],此体系在探究防御病虫害方面目前已进入热潮。研究发现,硫苷酶是一类非组织型表达蛋白,通常在植物体内含量较少,因此,从植物获取较多的硫苷酶很难实现[4,5]。重庆涪陵盛产榨菜,利用此优势,对榨菜硫苷酶基因进行研究,加大对榨菜叶的充分利用,为生产优质榨菜产品的创新过程提供一定依据,具有广大的社会、经济和生态效益。
目前对于硫苷酶基因的研究大多是以油菜、萝卜、芥蓝、大白菜等十字花科植物为材料[6~9],而对榨菜中硫苷酶基因的研究却十分匮乏[10]。根据前人对植物组织中总RNA提取方面研究可知主要存在以下几个方面的原因:首先是植物材料的影响;其次是植物组织里的多酚、多糖或次级代谢产物等也会对RNA提取产生一定的影响;再次是RNA酶对RNA的降解作用[11,12]。国内在研究获得不同的硫苷酶基因时采用多种不同方法进行引物设计[13]。迄今为止,从白芥芥子酶基因cDNA的分离的第1编码基因[14],国内外的研究者陆续从甘蓝、油菜、萝卜、西兰花[15]等十字花科植物中提取出了硫苷酶基因并将其基因进行克隆和原核表达。比如,2007年谢丽雪从幼嫩的芥蓝叶片中分离克隆出硫苷酶基因并进行序列分析;2009年梁锦峰从西兰花幼叶中分离克隆出硫苷酶基因并进行序列分析。
根据多次实践比较,采用最佳的Trizol试剂法从榨菜叶中提取RNA和设计相应的RT-PCR扩增反应的引物而得到榨菜硫苷酶基因的保守序列[16]。分析榨菜硫苷酶基因在十字花科植物芸薹属中的油菜、甘蓝、菜心等序列的相似程度。榨菜硫苷酶基因的研究为榨菜叶中硫苷酶基因的原核表达及cDNA全长序列的获得奠定基础,对榨菜叶以及榨菜中硫苷酶得以充分利用,提高榨菜硫苷酶含量、活性等有重要意义,可为生产优质榨菜产品的创新提供一定依据。
1 材料与方法
1.1 试验内容
采用Trizol试剂法从榨菜叶中提取RNA,通过在线设计程序NCBI的Primer Blast以及http:// www.yeastgenome.org/cgi-bin/web-primer等得到所需的上、下游引物[17]。由生工生物工程(上海)股份有限公司进行引物合成。榨菜中硫苷酶基因保守序列的获得,首先以植物总RNA为模板合成第1链cDNA,接着再以第1链cDNA为模板对硫苷酶基因进行RT-PCR扩增,再通过凝胶电泳检测其扩增结果并进行序列测定,最后结合DNAman7、NCBI等进行序列分析。
1.2 试验材料
①植物材料榨菜Brassica juncea(L.)Czern. et Coss.var.tumidaTsen et Lee,试验采用永安小叶(地方发掘品种),购于重庆涪陵绿源农业科技发展公司。
②主要试剂液氮、Trizol试剂、异丙醇、氯仿、0.1%的DEPC水溶液、蒸馏水、超纯水、5 mol/L NaCl溶液、75%乙醇溶液、Oligo dT(0.5 μg/μL)、RNase free H2O、5×Reacetion Buffer、RNase Inhibitor(20 U/μL)、DNTP Mix(10 mmol/L)、AMV RT(10 U/L)、液体石蜡、琼脂糖粉、1×TAE溶液、GoldviewTM核酸染料、10× PCR Buffer、DNTP Mixture Solution、MgCl2溶液、Taq DNA聚合酶、DNA Marker 2 000、6×Glycerol DNA loading Buffer、0.5×TBE溶液等。
③主要仪器离心管(15 mL、1.5 mL)、制冰机、高速冷冻离心机、高压蒸汽灭菌锅、恒温干燥器、电泳仪、PCR仪、低温冰箱(4℃、-20℃)、超低温冰箱(-72℃)、恒温培养箱等。
1.3 榨菜叶中提取总RNA和电泳检测
选取榨菜种子数粒在25℃恒温培养箱中培养1周,待到榨菜幼苗长到2叶期,即可用于RNA提取。榨菜叶中总RNA的提取采用的是根据实际情况改良后的Trizol试剂一步分离总RNA法,反复多次提取。
方法如下:称量0.5g新鲜榨菜叶片在液氮中快速研磨至粉末,放入盛有5mL Trizol试剂的RNase-free离心管中(置于冰上),充分混匀;将混匀的组织室温放置约10 min,使其中核酸蛋白复合体物完全分离(此过程可适当延长);将混合物4℃,7200r/min离心20min,并取上清到新的离心管2号中;再向离心管2号加1 mL氯仿,5 mol/L NaCl溶液1mL,剧烈振荡15 s,室温放置2 min(或直接离心);将离心管2号在4℃,离心20min,7500r/min,样品会分3层(RNA存在于上层水样),取上层无色水样到离心管3号里(不要吸取中间界面);向离心管3号中加异丙醇2.5 mL并充分混匀,放在室温10min,再进行4℃,离心20 min,7 200 r/min,去上清液,管底部管壁有胶状沉淀即为RNA;加75%乙醇4mL,并在4℃离心5min,7200r/min条件下洗涤沉淀,去上清液后再重复1次;吹干(或空气干燥)约10min;加0.5mL 0.1%DEPC水溶液(经高温高压灭菌后的),(若发现沉淀难溶时)用65℃溶解10min,-72℃保存。
电泳检测时用移液枪取2μL RNA溶解液与1 μL loading Buffer在PCR管中混匀;后用移液枪吸取混合物上样于1%琼脂糖凝胶中,调整电压100 V、电流50 mA,进行电泳30 min;在紫外光下观测到28S RNA∶18S RNA大约为2∶1,且条带清晰、明亮则可用于后续的试验。
1.4 第1链cDNA链合成
在冰浴的1.5mL离心管里依次加入总RNA3μL、Oligo dT(0.5 μg/μL)1 μL,再加RNase-free H2O定容至10 μL。后将上述反应混合物混匀,2 000 r/min下离心10 s,反应混合物在65℃水浴锅中温育5 min后,冰浴30 s,接着2 000转/min离心5 s后将离心管放于冰盒上。第1链cDNA合成反应体系见表1。
接着将上述反应混合物混匀后,2 000 r/min离心5 s。然后将上述反应混合物全部转移至PCR管中,并向PCR管中加入25 μL液体石蜡,再将其置于PCR仪进行反转录反应,反应程序见表2,完成上述反应后,将PCR管置于冰盒上。
1.5 引物的设计与合成
根据Genbank上已经有的植物硫苷酶基因序列和相关参考文献,再根据引物设计的一般规则分别设计上游引物和下游引物,用http://seq.yeastgenome.org/ cgi-bin/web-primer在线设计软件设计引物,然后用DNAman7进行引物评估,设计好的引物由生工生物工程(上海)有限公司合成。设计的引物如下:上游引物MS-up:5'-CCTCAAACACTCCAAGATG-3';下游引物MS-down:5'-CTTGTAATCATCACAGGTCCA-3'。
1.6 RT-PCR扩增得到硫苷酶基因保守区域
先做4个平行反应准备,向冰上的每个离心管中逐次加入试剂,从-20℃冰箱中取出酶立即置于冰上,吸取所需量加入PCE管后再立即放回-20℃冰箱中,根据PCR反应体系再加入相应的试剂。

表1 第1链cDNA合成的反应体系

表2 第1链cDNA合成的PCR反应程序
其次,在离心管中分别加入2 μL模板DNA,并加入DEPC处理水使终体积均为50 μL,在各管中加入适量灭菌石蜡油,2 000 r/min离心60 s,再将溶液分别转移至PCR管中。PCR反应体系见表3,RT-PCR反应程序见表4。
1.7 序列测定与分析
此次试验测得的是榨菜中硫苷酶基因的保守序列,将扩增产物交由生工生物工程(上海)股份有限公司进行序列测定。该保守序列主要通过NCBI及DNAman7进行分析。

表3 RT-PCR反应体系
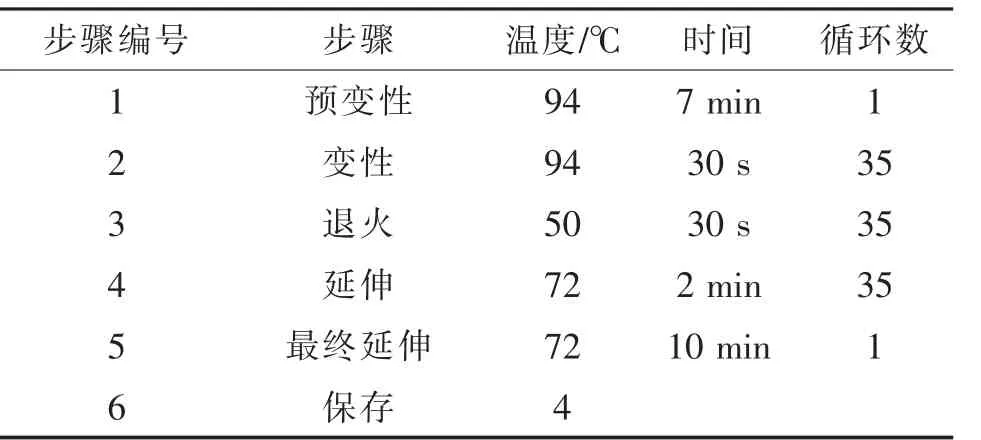
表4 RT-PCR反应程序
2 结果与分析
2.1 榨菜叶总RNA提取
由图1可知,榨菜总RNA样品电泳结果在紫外光下观察到28S RNA、18S RNA、5S RNA三个特征性条带,且条带间没有明显的弥散现象。28S RNA和18S RNA两条带比较明亮、清晰,亮度高于低分子量的5S RNA。其中28S RNA∶18S RNA亮度比约为1.5∶1而没有完全达到2∶1。

图1 总RNA电泳

图2 RT-PCR产物的电泳
经分析,这可能是在RNA提取过程中更换手套不及时导致接触到可能污染了RNA酶的物品[11],另外也可能由于在电泳过程中将冷冻的RNA解冻后没能及时点样,受到温度和空气中的RNase的影响;同时电泳时因电泳槽未能清洗干净而使得TAE缓冲液有所污染,最终使得RNA有轻微降解,但从电泳图也可得出RNA质量还是较高的,没有明显降解,可用于合成第1链cDNA[11]。因为cDNA的稳定性远高于RNA,易于保存。
2.2 硫苷酶基因保守序列的RT-PCR扩增与分析
由图2可知,提取的RNA样品的第1链cDNA合成后,通过用硫苷酶基因保守序列的一对上、下游引物进行RT-PCR技术扩增榨菜中硫苷酶的cDNA片段,再通过1%琼脂糖凝胶电泳检测扩增结果。电泳结果表明,泳道1、2、4均扩增失败而没有目的条带,只有泳道3中的条带较清晰、明亮,无明显拖带现象,通过电泳图中DNA Marker 2 000可以看出,扩增产物的碱基数在200~500 bp,与预计的目的片段大小相似,可用作保守序列测定。但泳道1、2、4均不能作序列测定。经分析,泳道1可能是DNA模板的量偏多,泳道2和4可能是因为PCR反应体系中镁离子的量不够或者DNA模板量偏少所致。
2.3 硫苷酶基因保守序列的分析
硫苷酶基因序列测定由生工生物工程(上海)股份有限公司进行测定,测得的硫苷酶基因保守序列如下:320 bp(不含上、下游引物)。
①保守序列片段的比较分析由图3可知,将测得的榨菜硫苷酶基因保守序列与已有的硫苷酶基因保守序列(如甘蓝M YB.olerac ea-M登录号:AY957579以及菜心M Y 49B.parachinensis-M登录号:AY957578)[3]在DNAman7软件中进行序列比对。可看出榨菜硫苷酶基因保守序列碱基有缺失、多余和错误,如榨菜相对于菜心和甘蓝都缺失了“CCGCCA”、“CA”、“AAGCAC”、“T”,都多余了“T”、“GGG”。其中不同的碱基是第36 bp:菜心和榨菜都为“G”,甘蓝为“A”;第64 bp:甘蓝与菜心为“T”,榨菜为“A”;第143 bp:榨菜和甘蓝都为“G”,菜心为“A”;第146 bp:榨菜和菜心都为“G”,甘蓝为“A”;第317 bp、318 bp:甘蓝和菜心都为“AG”,榨菜为“GT”。三种植物硫苷酶基因序列比对中,碱基有所差异,但总体比对的Identity为97.12%。由结果得出同是芸薹属的榨菜与已有的菜心、甘蓝硫苷酶基因的一致性较高。与此同时,将测得的榨菜硫苷酶基因序列在NCBI中进行nucleotide blast。由图4可知,该基因与甘蓝(登录号:AY957579.1)、菜心(登录号:AY957578.1)、油菜(登录号:EF583560.1)的硫苷酶的核苷酸的Query cover均为97%和I-dentity分别为97%、96%、96%。

图3 榨菜硫苷酶基因保守序列与甘蓝、菜心硫苷酶基因保守序列的对比分析

注:下图为测得的硫苷酶基因保守序列(320 bp)
②保守序列的翻译核苷酸序列分析根据常用的生物信息检索分析网站http://www.ncbi.nlm.nih.gov/,将测得的榨菜硫苷酶基因保守序列与NCBI中已有的芸薹属的翻译核苷酸序列进行比对,结果表明与油菜硫苷酶基因mRNA,部分cd(登录号:EU 192929.1)、菜心硫苷酶基因mRNA(登录号:XM009124972.1)、甘蓝硫苷酶基因mRNA,完整的cd(登录号:EU 004075)以及油菜硫苷酶完整外显子(登录号:L11258.1)的覆盖度(Query cover)和E value分别为:97%、96%、96%、93%和2e-28、2e-27、2e-27、6e-24。由此可知,测得的硫苷酶基因保守序列可作为模板,得到相应的编码序列,编码相应的硫苷酶。总的来说,参与比对的榨菜硫苷酶基因序列大多数碱基参与了比对,但仍有少部分没能比对得出,有缺失、错误及插入。同时结合E value的值都小于10-5,可知比对序列之间的相似性较高。
③保守序列片段翻译成蛋白质序列分析根据常用的生物信息检索分析网站http://www.ncbi. nlm.nih.gov/,将测得的榨菜硫苷酶基因保守序列翻译成蛋白质与蛋白质数据库中的序列进行比对,因此将测得的序列在NCBI中的进行blastx,结果表明与菜心(登录号:AAX68548.1)、甘蓝(登录号:ABS30827.1)和欧洲油菜(登录号:ABW70826.1)的序列的覆盖度和同源性分别为:97%、98%、98%和98%、97%、94%,由此可得出,榨菜与同为芸薹属的菜心、甘蓝和油菜硫苷酶基因保守序列翻译成的蛋白质序列的相似性较高。
3 讨论与结论
硫苷酶基因作为编码硫苷酶的基因,包含完整的编码硫苷酶蛋白中氨基酸的编码序列,而硫苷酶在榨菜中含量特别少。本试验通过提取榨菜叶总RNA,进而运用RT-PCR技术扩增得到硫苷酶基因的保守序列,为进一步运用RACE技术扩增得到硫苷酶基因的全长序列以及如何提高榨菜中硫苷酶的生理作用及特性奠定基础。而且,在国内外有关硫苷酶基因的研究中,未曾有相关学者以榨菜为试验材料获得硫苷酶基因。
另外,本试验只选择了一种提取总RNA的方法即Trizol试剂一步分离总RNA法从榨菜叶中提取RNA。因此,难免总RNA质量和浓度有偏差。电泳检测得到的条带虽然是很清晰、明亮,但是在28S RNA和18S RNA的亮度比没有完全达到2∶1,而是稍微接近比值,但对于进一步合成第1链cDNA没有太大的影响。
对于通过RT-PCR扩增得到产物的电泳检测,从目的条带的大小可见,可以用于序列测定。因此,在将测得序列在NCBI及软件DNAman7中进行序列比对与分析中,得到的覆盖度、相似度等达到较高水平,因此也初步证明了测得的基因序列为硫苷酶基因[6]。总的来说,对榨菜硫苷酶基因的研究为榨菜叶中硫苷酶基因的原核表达及cDNA全长序列的获得奠定基础,同时对榨菜中硫苷酶得以充分利用,提高榨菜硫苷酶含量、活性,以及加大对榨菜叶的充分利用等有重要意义,为生产优质榨菜产品的创新提供一定依据。
[1]徐伟丽,赵国华,李洪军,等.茎用芥菜芥子苷酶的特性研究[J].中国食品学报,2006,6(2):41.
[2]肖海燕,王向阳,宋达峰,等.油菜黑芥子酶基因重组表达质粒的构建以及在大肠杆菌中的表达[J].农业生物技术学报,2008,16(4):642-646.
[3]董执权.菜心黑芥子酶基因的RNA干扰及其对小菜蛾的影响[D].福州:福建农业大学,2009.
[4]刘月萍,王向阳.黑芥子酶研究进展[J].生物技术通讯,2006,17(4):839.
[5]王忠英,王向阳.硫代葡萄糖苷及其降解产物异硫代氰酸盐[J].生命的化学,2005,25(4):342-344.
[6]Hartel F V,Brandt A.Characterization of aBrassica napus myrosinase expressed and secreted by Pichia pastoris[J]. Protein Expression and Purification,2002,24:221-226.
[7]梁锦峰.萝卜硫素抗肿瘤活性研究及其关键酶myrosinase基因的克隆表达[D].杭州:浙江工商大学,2009:24-26.
[8]谢丽雪.芥蓝黑芥子酶基因的克隆与原核表达[D].福州:福建农林大学,2007.
[9]肖海燕.油菜黑芥子酶基因的大肠杆菌工程菌构建和表达研究[D].杭州:浙江工商大学,2008.
[10]丁艳,李丽倩,曹蓉,等.油菜籽饼粕中硫苷的酶解条件优化及降解产物分析[J].中国农业科学,2014,47(2):383-393.
[11]李宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36-39.
[12]丁勇,刘英,杨鸯鸯,等.油菜种子高质量总RNA提取的一种有效方法[J].华中农业大学学报,2006,25(5):465-468.
[13]刘芬,于秀梅,刘大群.一种植物总RNA的快速提取方法[J].华北农学报,2010,25(2):140-144.
[14]侯双利,刘翠晶,杨利民,等.影响植物组织总RNA质量的因素[J].人参研究,2013(2):11-14.
[15]梁锦峰,沈莲清.西兰花(Brassica oleraceavar.italica)硫代葡萄糖苷酶基因cDNA分子克隆及其特征分析[J].中国食品学报,2009,9(1):9-12.
[16]谷守芹,解灵君,范永山.植物组织总RNA提取的常用方法及优化策略[J].保定师范专科学校学报,2005,18(2):40-43.
[17]王前梁.十字花科蔬菜防御基因-黑芥子酶基因的研究[D].福州:福建农林大学,2005.
Extracting RNA from Leaves of MustardBrassica Junceaand Measurement and Analysis of Myrosinase Gene
ZHANG Yan,HOU Kunlan
(Life Science and Technology College,Yangtze Normal University,Chongqing 408100)
This purposes of this research is to lay the foundation for prokaryotic expression and to improve the content and activity of myrosinase in mustardbrassica junceaat the same time.The research material was taken from myrosinase gene in mustardbrassica juncea.This topic get conserved sequence of myrosinase gene taken from leaves for the method used, for extraction of RNA from mustardbrassica juncealeavesthat Trizol reagent step separation method of total RNA, according to the conserved nucleotide sequences of different plants and conservative sequence obtained by RT-PCR, conserved sequence alignment between the obtained andBrassica rapeon the DNAman7 bioinformatics analysis software, myrosinase translated nucleotides sequence and protein sequence alignment analysis online combined the NCBI and main withBrassica napue,Brassica rape,Brassica oleracea,Brassica Juncea,etc.The results shows that under identical conditions:320bp gene conserved sequence was obtained by method of Trizol reagent step separation,bioinformatics analysis suggested that conserved sequence showed 97.12%identity to M YB.oleracea-M,M Y 49B.parachinensis-M, myrosinase translated nucleotides sequence and protein sequence of Mustardbrassica junceahas a higher query cover and identity withBrassica napue,Brassica rape,Brassica oleracea,etc.It found that the similarity of sequence coverage have reached a higher level.
Mustard brassica juncea;Myrosinase gene;Conserved sequence
S637.3
A
1001-3547(2015)20-0065-05
10.3865/j.issn.1001-3547.2015.20.026
重庆市应用开发计划项目B类(cstc2013yykfA10003):从榨菜叶中提取异硫代氰酸盐的技术研究与应用
张燕(1977-),女,讲师,硕士,主要从事细胞与分子生物学研究,E-mail:28789155@qq.com
2015-09-01

