春兰与大花蕙兰杂交种原球茎分化和生根研究
李玉萍+王燕青+武文婷+罗凤霞
摘 要:以春兰‘紫萼×大花蕙兰‘日本绿杂交种原球茎和无根幼苗为材料研究了NAA、6-BA和GA3对杂交种芽苗分化以及NAA、IBA、香蕉泥对壮苗生根的影响。结果表明:(1)在培养基中添加外源激素可促进原球茎分化,当6-BA和NAA浓度比为4~5∶1 时分化效果最好;当培养基含有较高或适宜浓度的生长素时,添加赤霉素会抑制原球茎的生长、分化;杂交种原球茎分化芽苗最适宜培养基为N6+NAA0.2 mg·L-1 +6-BA 1 mg·L-1。(2)NAA对生根率、生根数、根长影响均达极显著水平;IBA对生根率、根长影响不显著,仅对生根数有一定促进作用;香蕉泥对生根数影响不显著,但对生根率、根长影响都达极显著水平,壮苗生根最佳培养基为N6+NAA0.2 mg·L-1+ IBA0.5 mg·L-1+香蕉泥50 mg·L-1。
关键词:春兰;大花蕙兰;原球茎;分化;生根
中图分类号:S682.31 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2015.08.032
春兰(Cymbidium goeringii (Reichb. f.) Reichb. f.)是兰属中的小花型地生兰种类,其株型较小,叶长一般20~40 cm;花葶直立,高2~15 cm,花常单生,直径4~5 cm;花色以浅黄绿色为常见,常具宜人的清香。大花蕙兰(C. hybridum)通常是指兰属中原产于印度、缅甸、泰国、越南和我国西南部等地区的一部分附生性较强的大花种类及以这些原种为亲本获得的人工杂交种[1-2], 其株型、花型硕大,色泽艳丽丰富,花瓣圆阔丰满,开花数目多而花期长。杂交育种是兰花育种最重要的方法,利用该方法已培育出10万多个洋兰新品种。中国兰与大花蕙兰杂交培育而成的新品种既有大花蕙兰的花大色艳的优点,又弥补了大花蕙兰无香味、株型过大、抗性较差等缺点。但其种子十分细小,种子内的胚通常发育不完全,且几乎无胚乳,在自然条件下很难萌发,现代育种多采用离体胚培养[3-6]。本试验采用多因素正交试验,从基本培养基以及外源激素种类及其浓度等方面探讨了春兰与大花蕙兰杂种原球茎分化和生根的培养基,旨在为春兰与芳香型大花蕙兰杂交育种提供基础。
1 材料和方法
1.1 杂交种原球茎分化
以春兰‘紫萼×大花蕙兰‘日本绿杂交种增殖后所得的大小相同、长势一致的原球茎为外植体,以N6为基本培养基,对NAA、6-BA和GA3进行3因素3水平的L9(33)正交试验(表1)。每处理接种30个原球茎,重复3次,各因素水平见表1。接种60 d后统计芽苗分化情况。芽苗高度大于1 cm记录为分化苗,幼苗分化率=分化成苗数/接种原球茎数×l00%。
1.2 杂交种壮苗生根
以分化的株高约2~3 cm,有2~3枚幼叶,生长健壮、长势均匀的组培苗,进行壮苗生根培养。以N6为基本培养基,分别添加NAA、IBA、香蕉泥构成L9(33)正交试验。每处理接种30株,重复3次,各因素水平见表2。待幼苗生长60 d后对其统计生根情况:生根率、平均生根数和平均根长。生根率=(生根苗数/接种苗数) × l00%,平均生根数=总根数/生根苗数,平均根长=总根长/生根苗数。
以上各培养基每升加入蔗糖20 g,琼脂8 g,调节pH值到5.4,121 ℃高温灭菌25 min。培养环境为温度(25士2) ℃,光照12 h·d-1,光强2 000 Lx。
2 结果与分析
2.1 原球茎分化
原球茎接种30 d后,开始萌发出不定芽(图1),接种60 d后(图2)对芽苗分化情况的统计见表3。对表3的统计结果利用SPSS软件进行方差分析(表4),结果表明,GA3对原球茎分化芽苗的影响达到极显著水平(P<0.01),6-BA对原球茎分化影响显著(P<0.05),NAA对原球茎分化影响不显著。分别对3因素进行多重比较,结果见表5。
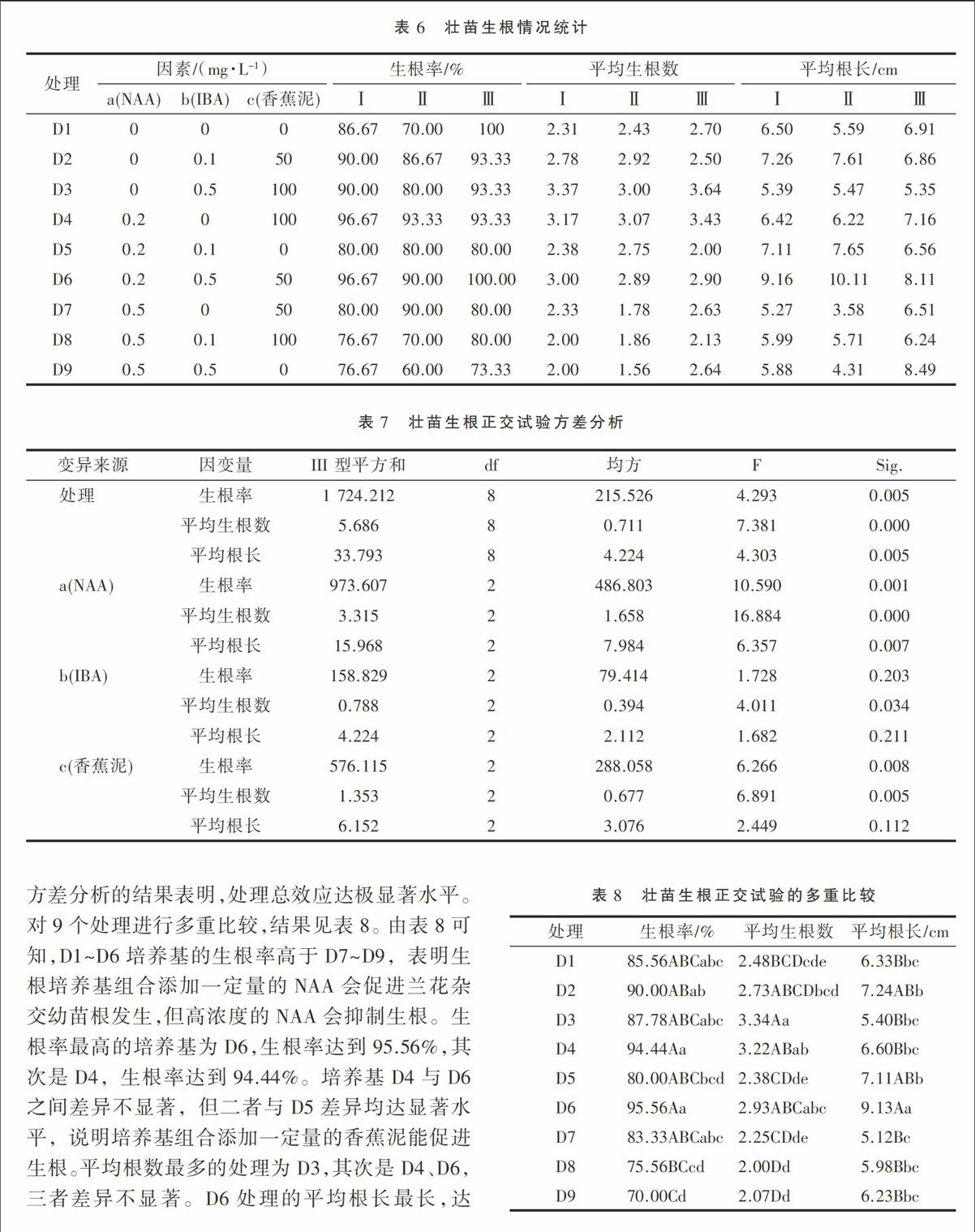
对正交试验9个处理进行多重比较,结果如图3。由图3可知,C4与C5之间差异极显著,C5幼苗分化率最高,达到38.17%,C4分化率最低,仅有14.6%,表明在培养基中添加的GA3和6-BA的比例不同,对原球茎分化将产生极大的影响。C1与C5差异不显著,且分化率相差较小,表明培养基中添加NAA对原球茎分化幼苗的影响较小。
方差分析结果表明,影响原球茎分化的主导因素为c因素,次要因素是b因素。由表5可知,b、c因素最佳组合为b2c1,即原球茎分化效果最佳的外源激素组合为6-BA mg/L +GA30 mg·L-1。a因素3水平之间差异不显著,试验过程中本着操作方便、节省开支等原则选取分化率最高的浓度,即第2水平。因此,3种外源激素的最佳组合为a2b2c1,此组合处理与C5相一致,即原球茎分化的最佳培养基为N6+NAA0.2 mg·L-1 +6-BA 1 mg·L-1。
2.2 壮苗生根
将分化的杂交小苗转接到各生根培养基25 d后,部分小苗基部开始长出1个或2个淡绿色小圆点,即开始根的分化,7 d后小圆点可伸长形成白色或淡绿色的根。培养60 d后,得到不同生根效果的植株(图2),对其生根率、平均生根数、平均根长等统计结果见表6。对幼苗生根各指标进行SPSS方差分析(表7),结果显示,NAA对生根率、平均生根数、平均根长影响极显著;IBA仅对平均生根数有显著影响,但对生根率、平均根长影响不显著;香蕉泥对生根率和平均生根数都有极显著影响,对平均根长影响不显著。
方差分析的结果表明,处理总效应达极显著水平。对9个处理进行多重比较,结果见表8。由表8可知,D1~D6培养基的生根率高于D7~D9,表明生根培养基组合添加一定量的NAA会促进兰花杂交幼苗根发生,但高浓度的NAA会抑制生根。生根率最高的培养基为D6,生根率达到95.56%,其次是D4,生根率达到94.44%。培养基D4与D6之间差异不显著,但二者与D5差异均达显著水平,说明培养基组合添加一定量的香蕉泥能促进生根。平均根数最多的处理为D3,其次是D4、D6,三者差异不显著。D6处理的平均根长最长,达9.13 cm,与其他处理之间差异极显著。综合壮苗生根的3个指标,生根效应最好的培养基为D6,即N6+NAA0.2 mg·L-1+IBA0.5 mg·L-1+香蕉泥50 mg·L-1。
分别对影响生根性状的3因素进行多重对比,结果见表9。由表9可知,a因素是影响生根各指标的主要因子,a1、a2与a3的生根效果差异极显著,a2与a1对平均根长的影响差异极显著,以均值分析,a因素生根最优水平为a2,即0.2 mg·L-1 的NAA。c因素是影响生根率和平均生根数的主导因子,c2与c3之间差异不显著,但与c1之间差异极显著,因此c因素的最优水平为c2或c3。b因素仅是影响平均生根数的次要因素,多重比较结果表明b3水平最优。因此,3因素的最佳组合为a2b3c2 或a2b3c3,前者与试验设计的D6培养基相符。由此可推断春兰‘紫萼×大花蕙兰‘日本绿杂交幼苗诱导生根的最佳培养基为N6+NAA0.2 mg·L-1+ IBA0.5 mg·L-1+香蕉泥50 mg·L-1。
3 结论与讨论
3.1 原球茎分化芽苗
组培研究中,植物器官的分化决定于其体内所含生长素和细胞分裂素的比例,6-BA、GA3等可有效诱导不定芽的发生和增殖,而低浓度的NAA与适宜浓度的细胞分裂素配合能促进茎的伸长。谷祝平等[7]报道较低浓度6-BA可促进大花蕙兰原球茎分化,鲁雪华等[8]报道附加0.5 mg·L-1 6-BA和0.1 mg·L-1 NAA的MS培养基对墨兰根状茎分化成苗的影响很大。本研究结果表明,6-BA对原球茎分化影响达显著水平,而NAA对原球茎分化的影响不显著。这与鲁迪[3]在研究春剑×大花蕙兰杂交种原球茎分化时的结果相一致。王丰妍等[9]在研究大花蕙兰与国兰杂种原球茎分化时发现6-BA 和 NAA 的浓度配比为 4~5∶1 时分化效果最好,本研究结果与其相近,研究中发现原球茎分化效果最佳的激素配比组合为1 mg·L-1 6-BA +0.2 mg·L-1 NAA,即5∶1的比例。
此外,王丰妍[10]研究认为GA3对诱导原球茎分化影响效果较好,当其浓度为 1.0 mg·L-1 时分化出的芽数最多,但分化出来的幼苗细,长势弱。本研究中亦证明了GA3对原球茎分化影响达极显著水平,但对分化率的影响是负效应,培养基中不加GA3时分化率最高,随GA3浓度升高,分化率反而降低。这可能是因为赤霉素(GA3)引起了植物内源激素的变化。赤霉素虽可以加速细胞伸长而促进不定芽的发生,但一定浓度的赤霉素也会使植物体内生长素的含量有较大提高,如果培养基中已含的生长素浓度适宜或相对较高,则添加赤霉素而引起的生长素的增加反而会抑制原球茎的生长、分化等。
3.2 壮苗生根
原球茎在分化芽苗阶段虽会萌发产生根而形成幼苗,但由于其所生根长度过短或生根数过少而容易导致炼苗移栽时难以成活,因此筛选适宜的生根培养基进行生根培养是非常必要的。陈著瑛等[11]认为生根壮苗时可适当提高NAA用量,降低或去除6-BA,效果更好。鲁迪[3]在研究中发现培养基中附加0.1 mg·L-1 NAA有利于根的萌发和生长,在此基础上添加0.5 g·L-1 AC可获得较多根数,但根长却最短,添加1 g·L-1 AC,获得的根长最长。王利民[12]在研究中发现MS培养基和较高的NAA浓度,对于苗高和根的粗度生长最为有利。本研究结果表明,NAA对生根率、生根数、根长等影响都达极显著水平,IBA对生根率、根长影响不显著,仅对生根数有一定促进作用,这与余道平[13]研究春兰的生根壮苗培养阶段NAA的生根效果好于IBA一致,与梁芳[14]研究杂交兰生根培养时发现IBA对生根影响显著的结论有所不同,这可能是由不同兰花材料或不同培养条件所引起的。也有报道称,生根壮苗时期因幼苗已可自身合成营养物质而对天然有机物依赖减少,生根培养基可不添加有机物。本研究结果表明,香蕉泥虽对生根数影响不显著,但对生根率、根长影响都达极显著水平,因此生根培养基中添加一定浓度的香蕉泥(50或100 mg·L-1)对生根壮苗有一定的促进作用。
参考文献:
[1] 朱根发.大花蕙兰[M].广州:广东科技出版社,2004:1-6.
[2] 陈璋.大花蕙兰[M].北京:中国林业出版社,2004.
[3] 鲁迪.春剑和大花蕙兰种间杂交种子无菌萌发及杂交后代的RAPD分析[D].雅安:四川农业大学,2010.
[4] 朱根发,陈明莉,罗智伟, 等.墨兰与大花惠兰种间杂种原球茎的诱导及增殖研究[J].园艺学报,2004,31(5):688-690.
[5] 陈瑶瑶,张燕,张探,等.广东.杂交兰`韩国桃花'×蕙兰种间杂交种子无菌萌发特征研究[J].园艺学报,2009,36(3):441-446.
[6] 段金玉,谢亚红.在无菌条件下激素和种子处理对兰属十种植物种子萌发的影响[J].云南植物研究,1982,4(2):197-201.
[7] 谷祝平,颜廷进.大花蕙兰茎尖组织培养及其形态建成的研究[J].实验生物学报,1989(2):149-151.
[8] 鲁雪华,郭文杰,林勇.墨兰的无菌播种和植株再生[J].亚热带植物通讯,1999,28(1)34-37.
[9] 王丰妍,李承秀,王长宪,等. 大花蕙兰与春剑杂交原球茎增殖及分化研究[J].中国农学通报,2009,25(23):327-330.
[10] 王丰妍.兰属中几种兰花杂交后代的组培与核型研究[D].泰安:山东农业大学,2010.
[11] 陈著瑛,蓝贺胜,陈雄鹰.兰花组织培养与快速繁殖技术[M].北京:中国农业出版社,2004.
[12] 王利民.大花蕙兰杂交育种[D]. 北京:北京林业大学,2007.
[13] 余道平.春兰组织培养技术体系研究[D].雅安:四川农业大学,2005.
[14] 梁芳.杂交兰组织培养技术体系的研究[D].郑州:河南农业大学,2008.

