低温下硅对春小麦幼苗生长及生理特性的影响
赵培培,于立河,赵长江
(黑龙江八一农垦大学农学院,大庆 163319)
小麦是世界上种植面积最大的粮食作物之一,它为世界上35%~40%的人提供食物。随着世界人口的增多,人们对小麦的需求量不断增加。因此,提高小麦产量和品质是至关重要的。
低温是限制植物生长发育的重要环境因素,它是农业生产中的主要自然灾害之一。有相关报道,作物受到低温冷害后,植物细胞膜质过氧化,水分代谢失调,破坏酶促反应的平衡,扰乱了植物正常的代谢,使植株受害,干物质积累量降低,产量和品质降低,严重时可使植株干枯死亡。因此,提高植株抗冷害能力至关重要[1]。
硅是地壳中含量仅次于氧,第二丰富的元素。有大量研究表明,硅对植物的生长发育是有益的,硅可以提高植物对生物和非生物胁迫的抗性,如抗旱性、抗病性、抗冷害等等[2-4]。因此,研究低温条件下硅对小麦幼苗生长和相关生理特性的影响机制对提高小麦产量具有重要的理论与实际意义。
1 材料与方法
1.1 材料与处理
试验以硅酸钠(Na2SiO3·9H2O)作为Si 处理试剂。选用两种春小麦品种,龙麦26 和克旱16。挑选籽粒大小均匀一致的种子,浸泡20 h 后,用1%的NaCl表面消毒20 min,冲洗干净。然后在培养箱中25 ℃催芽72 h。催芽后转移到塑料桶中,塑料桶装有1/2 的霍格兰营养液。营养液每4 d 更换一次,营养液pH 每次用10 mM NaOH 或H2SO4调至6.0 左右。将小麦放在可控气候条件的生长室内培养(光周期12 h/12 h黑暗,温度白天/黑夜21 ℃/17 ℃,相对温度50%)。
1.2 试验设计
将达到三叶一心期的麦苗分别放在硅(Si)浓度为0、0.5、1.0、2.5 mM 的1/2 强度的霍格兰营养液中,然后将塑料桶分别置于0 ℃和4 ℃的培养箱中,在光强400 umol·m-2·s-1,光照12 h·d-1条件下低温处理,培养箱内的CO2浓度与生长室内浓度一致。每个处理重复3 次。在低温处理的12、24、48、72 h 分别取样测定生理生化指标。同时在处理72 h 时取样测小麦株高,根长,地上部分鲜、干重和根鲜、干重。
1.3 测定方法
1.3.1 生物量的测定
从每个处理中随机取10 株幼苗,用蒸馏水冲洗干净,滤纸吸干表面水分,测定麦苗株高、根长、称取鲜重,然后将其放在105 ℃下杀青20 min,然后70 ℃下烘干至恒重,称取干重。
1.3.2 POD 和SOD 活性、MDA 和Pro 含量测定
采用氮蓝四唑(NBT)法测定SOD、愈创木酚法测定POD,同硫代巴比妥酸法测定MDA、酸性茚三酮法测定游离脯氨酸含量,以上指标均参照张志良《植物生理学实验指导》[5]测定。
1.4 数据分析
利用SPSS19.0 统计分析软件进行数据的分析和差异显著性检验。
2 结果与分析
2.1 硅对低温条件小麦幼苗生长的影响
试验结果表明,在0 ℃和4 ℃条件下加一定浓度硅(Si)后,两小麦品种的株高、根长和鲜、干重都有不同程度的升高(表1)。
龙麦26 品种,在0 ℃条件下加Si 处理后,除株高增加不显著外,其他指标随施硅水平不同均有不同程度的增加。其中,施0.5 mM Si 处理后,根长、根鲜、干重都显著升高,且分别显著高于0 mM Si 处理34.9%,87.7%和66.7%(P<0.05)。而地上部分鲜重和干重分别在加入1.0 mM Si 和2.5 mM Si 时显著高于0 mM Si 和0.5 mM Si 处理(P<0.05)。在4 ℃条件下,株高、地上部分鲜、干重随着施硅水平的增加而增加并在2.5 mM Si 处理时达到最高,显著高于其他硅浓度处理。在1.0 mM Si 处理下小麦根长和根鲜重显著高于其他硅浓度处理,达到显著水平(P<0.05)。

表1 硅对低温条件小麦幼苗株高、根长和鲜干重的影响Table 1 Effects of Si on plant height,root length,fresh and dry weight of wheat seeding under low temperature conditions
克旱16 品种,0 ℃条件下加Si 处理后,小麦幼苗各项值均高于未加硅处理。其中,株高和地上部分鲜重随着Si 浓度的增加而增加,且加Si 处理均显著高于未加硅(0 mM)处理(P<0.05),并在2.5 mM Si 处理时最高;而根长,地上部分干重,根鲜重和根干重均在施1.0 mM Si 处理时达到最高,且显著高于其他硅浓度25.8%~134.9%(P<0.05)。在4 ℃条件下,加0.5 mM Si 处理后,根长,地上部分干重和根鲜重显著高于其他硅浓度(P<0.05)。而株高,地上部分鲜重和根干重均在硅浓度为1.0 mM 时达到最大值,显著高于0 mM Si 处理。由此可知,不同硅浓度对0 ℃和4℃条件下小麦的生长有影响,其中,1.0 mM Si 处理能够显著促进小麦生长。
2.2 硅对低温条件小麦幼苗丙二醛含量的影响
由表2 可知,在0 ℃和4 ℃条件下,不同硅浓度下两品种小麦叶片MDA 含量均呈现先降低后增加趋势。龙麦26 品种在0 ℃条件下,在12~48 h 期间,小麦叶片MDA 含量在1.0 mM Si 处理较0 mM Si 处理显著降低了31.0%,62.3%和34.3%(P<0.05);而在72 h 时,小麦叶片MDA 含量在0.5 mM Si 处理下显著降低,低于0 mM Si 处理33.9%(P<0.05)。在4 ℃条件下,在12 h 和72 h,MDA 含量在硅浓度为0.5 mM 时达到最低,显著低于其他硅浓度处理(P<0.05)。24~48 h 期间,施硅处理后,不同硅浓度下,MDA 含量均降低,1.0 mM Si 处理下降幅度最大,分别低于0 mM Si 处理52.8%和37.5%。克旱16 品种,无论是0 ℃还是4 ℃条件下,在12~72 h 期间,小麦叶片MDA 含量均在1.0 mM Si 处理时最低,明显低于2.5 mM Si 处理,显著低于0 mM Si 和1.0 mM Si 处理(P<0.05)。可见,不同硅浓度下小麦叶片MDA积累量有明显差异,1.0 mM Si 处理的MDA 含量最低。
2.3 硅对低温条件小麦叶片过氧化物酶(POD)活性的影响
过氧化物酶(POD)是构成植物抗氧化防御系统的主要酶之一,其活性的提高有助于植物抗性的增强。由图1 可知,12~48 h 期间,加硅处理的POD 活性均显著高于未加硅(0 mM)处理(P<0.05),且在24 h时,0.5 mM Si 处理中POD 活性达到最大值,显著高于0 mM Si 处理47.8%(P<0.05)。在72 h,1.0 mM Si处理POD 活性显著高于其他硅处理的POD 活性,达到显著水平(P<0.05)。图3 中,在24 h 时,与12 h 相比,各处理中POD 活性均降低,但在48~72 h 时,POD 活性开始上升并在72 h 达到最大值,显著高于0 mM Si 处理45.6%(P<0.05)。

表2 硅对低温条件小麦叶片MDA 含量的影响Table 2 Effects of Si on MDA content of wheat leaf under low temperature conditions

图1 0 ℃条件下硅对龙麦26 小麦叶片POD 活性影响Fig.1 Effects of silicon on POD activity of Longmai26 under 0 ℃
如图2 所示,12 h 时,Si 浓度为1.0 mM 时对POD 活性的提高最显著。24 h 时,0.5 mM Si 处理显著高于其他Si 浓度处理。48~72 h 期间,POD 活性的变化非常显著,在0~1.0 mM 浓度期间,随Si 浓度的升高,POD 活性不断升高,并在72 h 达到最大值。超过1.0 mM 至2.5 mM 浓度时,POD 活性呈下降趋势,但仍然显著高于0 mM Si 处理(P<0.05)。
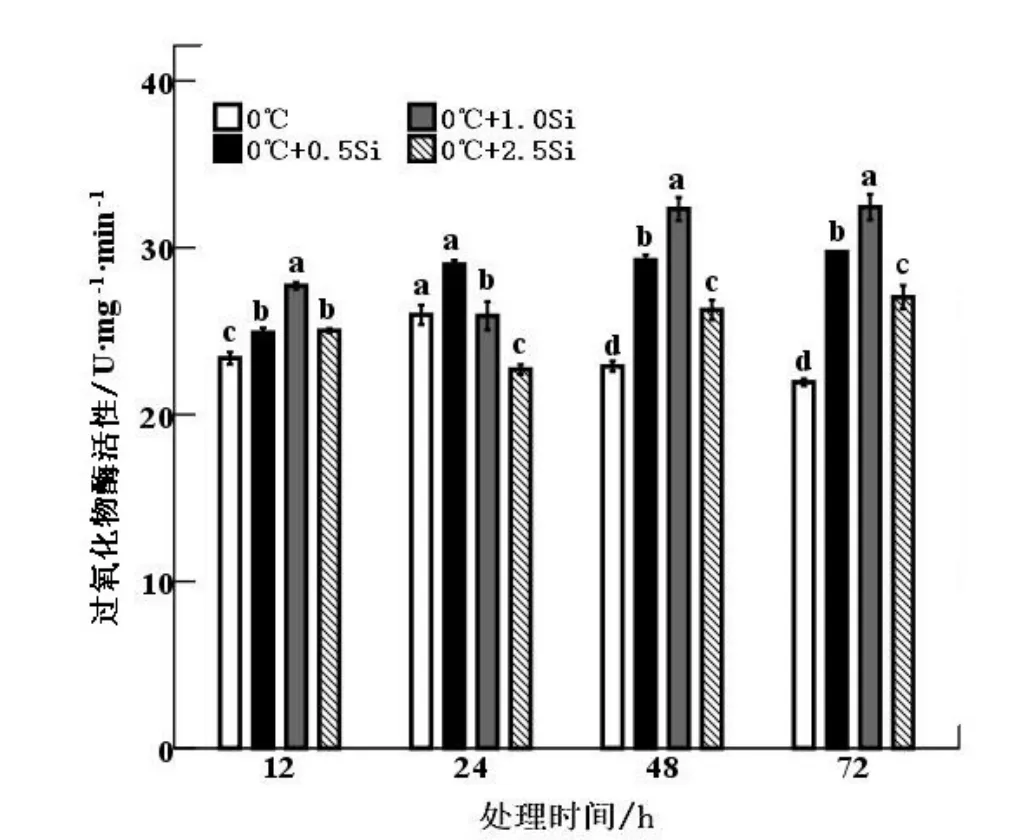
图2 0 ℃条件下硅对克旱16 小麦叶片POD 活性影响Fig.2 Effects of silicon on POD activity of Kehan16 under 0 ℃
由图4 可知,12~24 h 期间,加Si 处理POD 活性均显著高于未加Si 处理(P<0.05)。48 h 时,0.5 mM Si处理中POD 活性达到最大值,显著高于其他硅处理(P<0.05)。在72 h,随着Si 浓度的升高,POD 活性呈先上升后下降趋势,但加硅处理的POD 活性仍高于未加硅(0 mM)处理,且达到显著水平(P<0.05)。
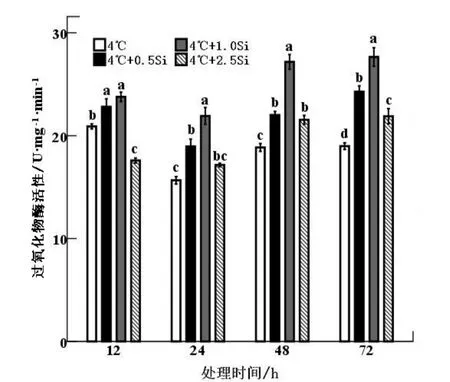
图3 4 ℃条件下硅对龙麦26 小麦叶片POD 活性影响Fig.3 Effects of silicon on POD activity of Longmai26 under 4 ℃
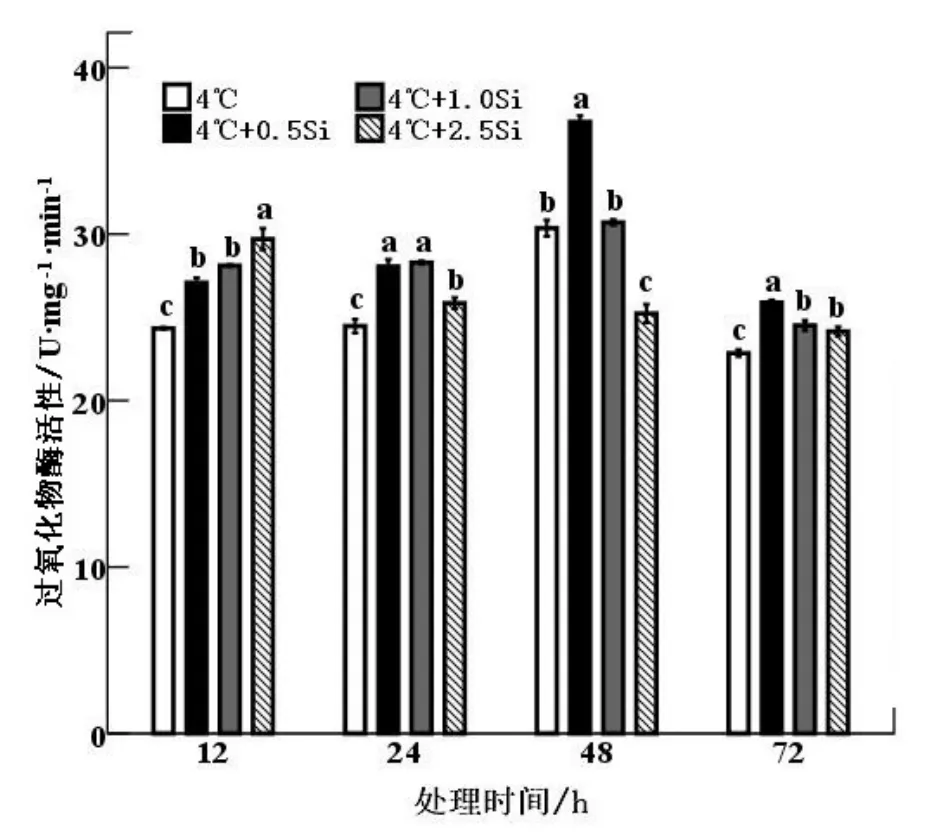
图4 4 ℃条件下硅对克旱16 小麦叶片POD 活性影响Fig.4 Effects of silicon on POD activity of Kehan16 under 4 ℃
2.4 硅对低温条件小麦叶片超氧化物歧化酶(SOD)活性的影响
超氧化物歧化酶(SOD)是活性氧清除系统中最重要的抗氧化酶,在保护细胞免受氧化损伤过程中具有十分重要的作用。由图5 可知,在12 h,加Si 处理的SOD 活性均显著高于未加Si 处理(0 mM)(P<0.05),其中1.0 mM Si 处理显著高于0 mM Si 处理56.8%。24~48 h,随着Si 浓度的升高,SOD 活性逐渐升高,并在Si 浓度为2.5 mM 时达到最大值。图7中,SOD 活性仅在2.5 mM Si 处理下随时间推移呈下降趋势,其他硅浓度呈先升高后降低趋势,且在24 h时,其SOD 活性在0.5 mM Si 处理下达到最大值,显著高于其他硅处理(P<0.05)。
图6 中,在12~72 h 期间,0 mM 和0.5 mM Si 处理下,SOD 活性呈现先上升后下降趋势,而1.0 mM和2.5 mM Si 处理中,SOD 活性先降低后升高。在72 h,1.0 mM Si 处理的SOD 活性迅速升高,达到最大值,显著高于0 mM Si 处理39.2%(P<0.05),而0.5 mM Si 处理的SOD 活性最高峰出现在24 h,显著高于0 mM Si 处理29.6%(P<0.05)。在图8 中,总体上,12~48 h,SOD 活性的逐渐升高并在48 h 达到最大值,显著高于0 mM Si 处理25.9%(P<0.05)。在72 h时,SOD 活性开始降低。从图中可看出,1.0 mM Si 处理的SOD 活性明显高于其他硅浓度,1.0 mM Si 处理能够显著提高小麦叶片SOD 活性(P<0.05)。

图5 0 ℃条件下硅对龙麦26 小麦叶片SOD 活性影响Fig 5 Effects of silicon on SOD activity of Longmai26 under 0 ℃
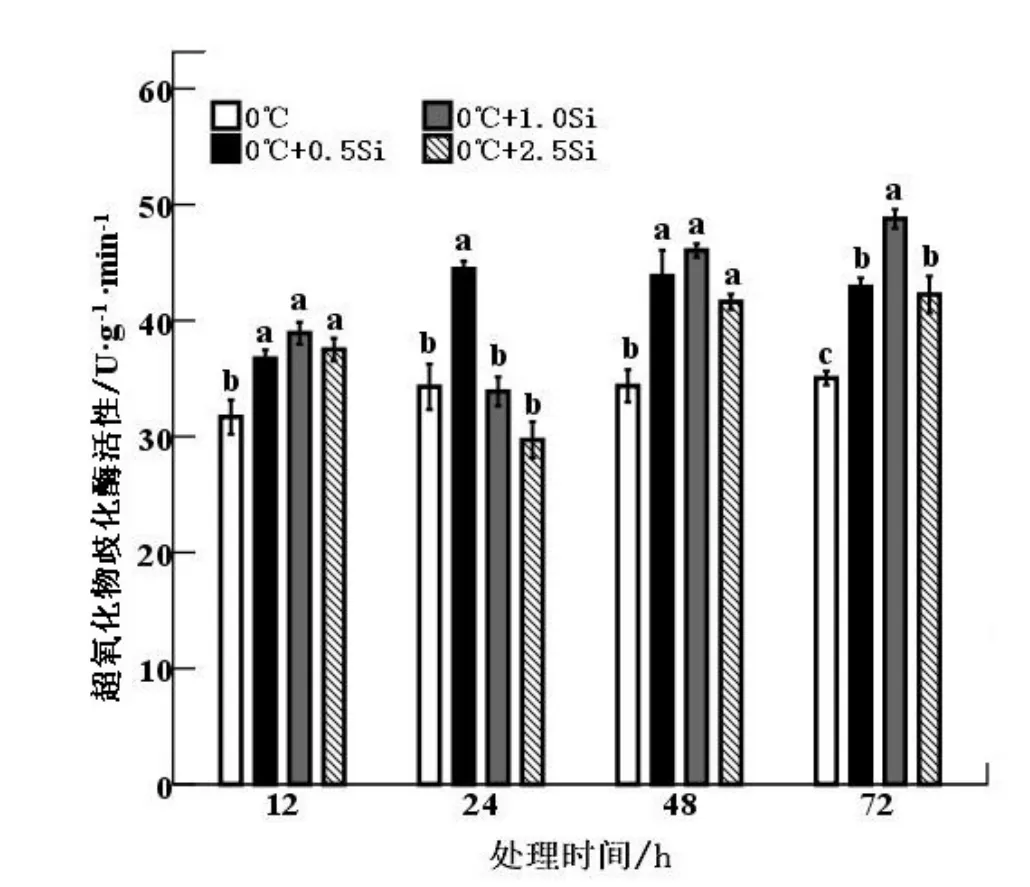
图6 0 ℃条件下硅对克旱16 小麦叶片SOD 活性影响Fig 6 Effects of silicon on SOD activity of Kehan16 under 0 ℃

图7 4 ℃条件下硅对龙麦26 小麦叶片SOD 活性影响Fig.7 Effects of silicon on SOD activity of Longmai26 under 4 ℃

图8 4 ℃条件下硅对克旱16 小麦叶片SOD 活性影响Fig.8 Effects of silicon on SOD activity of Kehan16 under 4 ℃
2.5 硅对低温条件小麦叶片脯氨酸(Pro)含量的影响
图9 和图11 分别为在0 ℃和4 ℃条件下,龙麦26 品种小麦叶片脯氨酸含量变化图。从两图中可看出,总体而言,随着时间的增加,脯氨酸含量在逐渐降低,且均在1.0 mM Si 处理时达到最小值。图9 中。12~24 h,1.0 mM Si 处理脯氨酸含量显著低于其他硅处理(P<0.05),同时脯氨酸含量最小值出现在24 h,低于0 mM Si 处理47.4%;图11 中,12~24 h,1.0 mM Si处理和2.5 mM Si 处理脯氨酸含量均显著低于其他硅处理(P<0.05),且脯氨酸含量最小值出现在12 h,低于0 mM Si 处理69.6%,均达到显著水平(P<0.05)。在48~72 h,仅1.0 mM Si 处理脯氨酸含量低于其他硅处理,且存在显著性差异(P<0.05)。

图9 0 ℃条件下硅对龙麦26 小麦叶片Pro 含量影响Fig.9 Effects of silicon on Pro content of Longmai26 under 0 ℃

图10 0 ℃条件下硅对克旱16 小麦叶片Pro 含量影响Fig.10 Effects of silicon on Pro content of Kehan16 under 0 ℃
图10 和图12 分别为在0 ℃和4 ℃条件下,克旱16 品种小麦叶片脯氨酸含量变化图。图10 中,在12 h,1.0 mM Si 处理脯氨酸含量显著低于其他硅浓度,相比于0 mM Si 处理降低了49.3%,达到显著水平(P<0.05)。24~72 h 期间,0.5 mM 和1.0 mM Si 处理下脯氨酸积累量均不断降低,且在72 h,0.5 mM Si处理中脯氨酸含量达到最小值,显著低于0 mM Si处理51.4%(P<0.05)。图12 中,在12 h,在0.5 mM Si处理中,脯氨酸含量最低,显著低于0 mM Si 处理49.1%(P<0.05)。在24 h,脯氨酸含量随硅浓度增加而降低,并在2.5 mM Si 处理时达到最低值,显著低于0 mM Si 处理68.8%。48~72 h 期间,1.0 mM Si 处理脯氨酸的积累量显著低于0 mM Si 处理,分别降低了52.5%和42.6%(P<0.05)。
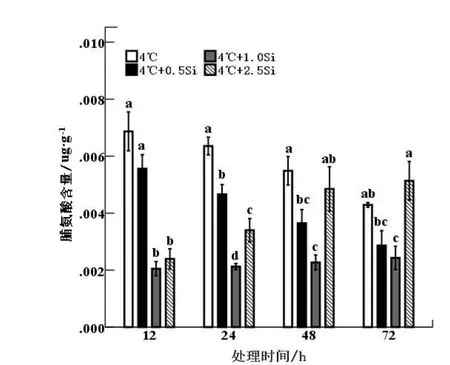
图11 4 ℃条件下硅对龙麦26 小麦叶片Pro 含量影响Fig.11 Effects of silicon on Pro content of Longmai26 under 4 ℃

图12 4 ℃条件下硅对克旱16 小麦叶片Pro 含量影响Fig.12 Effects of silicon on Pro content of Kehan16 under 4 ℃
3 结论与讨论
有研究发现,硅能够显著促进植物生长发育。硅可以促进水稻根系生长,提高根系对水分和养分的吸收和利用率,增加根系干物质积累[6]。马成仓等[7]研究结果表明,硅可以促进玉米种子呼吸代谢,提高发芽率和单株鲜重。试验结果显示,两品种小麦在低温条件下加不同浓度硅处理,株高、根长以及鲜干重都显著增加,说明,硅在一定浓度范围内能够缓解小麦低温伤害,促进小麦幼苗生长。
MDA 是膜质过氧化作用的主要产物之一,其含量的高低可以反映质膜破坏的程度[8]。有研究表明,随低温危害程度的增大,膜质过氧化产物MDA 含量增多[9]。试验中,植物在低温条件下加硅处理可使小麦叶片MDA 含量降低,减轻膜质过氧化,显著降低产生速率和质膜渗透率,从而保护细胞膜,缓解植物低温危害。此结论在低温胁迫下黄瓜幼苗中得到证实[10]。
大量研究结果显示:低温条件下,植物体内积累大量的活性氧自由基。这些活性氧自由基会破坏植物体内的一些生物功能分子,导致膜质过氧化,造成细胞膜的氧化损伤。而植物体内存在一个抗氧化防御系统,包括一些酶类和非酶物质,它们可以清除多余的活性氧自由基,维持细胞膜结构完整和膜系统的稳定,保护细胞免受伤害,进而增强植株对低温的抗性[11-12]。试验中,由图1 和2 可看出,低温条件下加硅处理可显著提高两品种小麦叶片POD 和SOD 活性。说明,外源硅可以显著提高低温条件下小麦抗氧化酶活性,缓解小麦低温危害。
植物受到低温危害时,通常通过提高细胞渗透调节能力来缓解或消除低温危害。脯氨酸是细胞渗透调节系统中主要物质之一。试验结果表明,在低温条件下加不同浓度的硅处理,脯氨酸含量相比于未加硅处理显著降低,其中以1.0mM Si 浓度处理降低效果最佳。脯氨酸含量与植物低温危害程度密切相关,但关于脯氨酸和低温危害之间的关系,迄今为止仍有争议[13]。有大量研究表明[14-15],游离脯氨酸的积累与植物耐低温能力呈负相关,由此可得出脯氨酸积累可能是植物受到低温危害的结果。也有研究报道,脯氨酸的积累可以增加细胞的渗透调节能力,有助于提高植物的抗逆性,耐逆植物中脯氨酸含量一般情况下高于敏感型植物[13,16]。试验研究结果表明脯氨酸积累是植物受低温危害的结果。
综上所述,外源硅通过促进根系生长,提高小麦生物量,提高SOD、POD 抗氧化酶活性,减少活性氧的产生,降低MDA 含量,保持细胞膜结构完整,调节渗透平衡来缓解低温对小麦幼苗的伤害。但是,硅对低温条件下小麦抗寒性的影响程度因品种而有所不同,具体的作用机制还需进一步研究。
[1]姜丽娜,张黛静,林琳,等.低温对小麦幼苗干物质积累及根系分泌物的影响[J].麦类作物学报,2012,32(6):1171-1176.
[2]宫海军,陈坤明,王锁民,等.植物硅营养的研究进展[J].西北植物学报,2004,24(12):2385-2392.
[3]李文彬,王贺,张福锁.高温胁迫条件下硅对水稻花药开裂及授粉量的影响[J].作物学报,2005,31(1):134-136.
[4]孙万春,梁永超,杨艳芳,等.硅和接种黄瓜炭疽菌对黄瓜过氧化物酶活性的影响及其与抗病性的关系[J].中国农业科学,2002,35(12):1560-1564.
[5]张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.
[6]饶立华,覃莲祥,朱玉贤.硅对杂交水稻形态结构和生理的效应[J].植物生理学通讯,1986(3):20-24.
[7]马成仓,李清芳,束良佐,等.硅对玉米种子萌发和幼苗生长作用机制初探[J].作物学报,2002,28(5):665-669.
[8]李明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[9]李建设,耿广东,程智慧.低温胁迫对茄子幼苗抗寒性生理生化指标的影响[J].西北农林科技大学学报,2003,31(1):90-92.
[10]王海红,祝鹏飞,束良佐,等.硅对低温胁迫下黄瓜幼苗生长的影响[J].生态科学,2011,30(1):38-42.
[11]叶亚新,金进,秦粉菊,等.低温胁迫对小麦、玉米、萝卜幼苗超氧化物歧化酶活性的影响[J].中国农学通报,2009,25(23):244-248.
[12]王树刚,王振林,王平,等.不同小麦品种对低温胁迫的反应及抗冻性评价[J].生态学报,2011,31(4):1064-1072.
[13]Madan S,Nainawatee H S,Jain R K,et al.Praline and praline metabolizing enzymes in in-vitro selected NaCltolerant (Brassica juncea L.)under salt stress[J].Ann Bot,1995,76:51-57.
[14]Lacerda C F,Cambraia J,Oliva M A,et al.Solute accumulation and distribution during shoot and leaf development in two sorghum genotypes under salt stress[J].Environ Exp Bot,2003,49(2):107-120.
[15]Lutts S,Majerus V,Kinet J M.NaCl effects on proline metabolism in rice(Oryza sativa)seedlings[J].Physiol Plant,1999,105(3):450-458.
[16]Nayyar H,Walia D P.Water stress induced praline accumulation in contrasting wheat genotypes as affected by calcium and abscisic acid[J].Biol Plant,2003,46(2):275-279.
[17]宫占元,焦峰.不同氮水平对马铃薯干物质积累和产量的影响[J].黑龙江八一农垦大学学报,2012,24(4):1-3.

