身痛逐瘀汤通过调控P38 MAPK信号通路抑制LPS诱导的RAW264.7巨噬细胞一氧化氮的分泌
王健楠,阮洪生,崔玉东,孙虎男
(黑龙江八一农垦大学生命科技学院,大庆 163319)
巨噬细胞活化过程中会产生一氧化氮(NO)和超氧阴离子等激进分子,这些分子产生与释放不仅对细胞有着一定毒性作用,同时还参与了许多细胞的氧化还原过程[1]。巨噬细胞存在于几乎所有的组织当中,是重要的免疫效应细胞。巨噬细胞可以在机体损伤和感染时迅速作出反应,同时一些其他类型的有害条件,如缺氧和代谢压力也可以促进巨噬细胞活化。NO 是由精氨酸在一氧化氮合成酶 [nitric oxide synthase(NO S)]的作用下合成的一种重要的生物信使分子[2-3],参与血流调节、信号传导、免疫防御等多种生理及病理过程[3-5]。近年来,在活化巨噬细胞中发现NO 是一个主要的细胞毒分子,进而引起了关于NO 在炎症中及免疫疾病中作用的广泛研究,体内多种组织和细胞均能合成内源性NO(如巨噬细胞)。巨噬细胞等在未受到致炎因子刺激时不表达iNOS,也无诱生型NO 的合成,但是在许多致炎因子,如TNFα,IL-1,INF-γ,LPS 等的作用下会使iNOS 过量表达,引起炎症反应的发生[6-7]。LPS 主要被巨噬细胞表面LPS 结合蛋白(LBP)/CD14/ toll-like receptor-4(TLR-4)结合[8]从而诱导巨噬细胞的活化,诱导NO的过度释放、iNOS 的过表达及细胞内活性氧(ROS)的水平升高[9-10],最终引起机体的败血症休克。
通过对广泛文献的学习和整理,在之前的报道中已经阐述了身痛逐瘀汤具有活血化淤,通痹止痛的功效[12]。在临床上以此方为基本的复方中药常用于治疗瘀血痹阻等疾病之外,还可用于治疗类风湿关节炎,腰间盘突出症以及心血管疾病等[11-13],这些研究结果充分地展示出身痛逐瘀汤在各种炎症治疗过程中的重要作用。但是,目前为止身痛逐瘀汤在由LPS 诱导的巨噬细胞NO 分泌过程中的效果及其调控机理尚不清楚。研究结果显示,身痛逐瘀汤通过选择性地抑制P38 信号通路,进而有效地抑制了由LPS 诱导的RAW264.7 巨噬细胞NO 的产生以及iNOS 的表达,同时也降低了LPS 诱导的巨噬细胞内ROS 水平。研究结果为进一步了解和认识身痛逐瘀汤对巨噬细胞诱导的炎症反应提供新的理论依据。
1 材料与方法
1.1 材料
脂多糖(LPS,from Escherichia coli serotype 0111:B4)购自Sigma Aldrich 公司,身痛逐瘀汤由(按此药味组成和剂量,共计75 g,加入10 倍药物质量的水煎煮0.5 h,煎煮液过滤。滤渣再加入10 倍药物质量的水煎煮0.5 h,煎煮液过滤。合并2 次滤液,浓缩至干膏状。精密称取干膏粉1 g,加入10 倍质量的水,超声提取30 min,用0.45 μm 滤膜过滤,滤液为供试液),RAW264.7 小鼠巨噬细胞来自实验室细胞库。
1.2 试剂及仪器
DMEM/高糖培养基购自美国Hyclone 公司,胎牛血清购自美国Gibco 公司,抗mouse anti-JNk、p-JNK、ERK、p-ERK、P38、p-P38 和α-tubulin 单克隆抗体购自美国Santa Cruz 公司。多功能酶标仪(TECAN);流式细胞仪(BD,FACS Calibur);蛋白免疫印迹系统(Amersham Bioscience,美国)。
1.3 细胞的培养
RAW264.7 培养在完全培养基(DMEM;Invitrogen),含有10%的胎牛血清(FBS;HyClone,Logan,UT,USA),和1%的抗生素(青霉素和链霉素)并置于37 ℃,5%CO2恒温培养箱中传代培养。
1.4 ROS 水平及NO 含量检测
ROS 的分析,用ROS 的指示剂(1 mM,CM2-DCFDA)与处理过的RAW264.7 细胞在37 ℃孵育15 min 后,用PBS 洗3 次,利用500 uL 的PBS 重悬,利用流式细胞仪分析10 000 个细胞内所带的ROS指示剂的荧光强度。NO 含量检测是通过RAW264.7细胞培养上清液与10%格里斯试剂室温下进行反应10 min 利用多功能酶标仪在波长为540 nm 通过测定亚硝酸盐的含量来检测的。**P≤0.01 ,***P≤0.001,每组实验均重复3 次。
1.5 蛋白质免疫印迹分析
回收细胞,加入蛋白质裂解液4 ℃裂解细胞20 min。4 ℃,12 000 rpm 离心20 min,提取细胞总蛋白并定量,再用12%十二烷基硫酸钠-聚丙烯酰胺分离20 μg 的细胞总蛋白,电印迹转移法将蛋白质转移到NC 膜(nitrocellulose membranes Millipore,USA)上。将膜用5% Skim milk 封闭1 h,TBST(含有15 mmol·L-1的NaCl 和0.2%Tween-20,10 mmol·L-1的Tris-HCl)洗涤5 次,5 min·次-1,随后用一抗封闭,4 ℃孵育过夜。再用TBST 洗涤5 次,5 min·次-1,用与HRP 标记的鼠或兔二抗,室温孵育2 h。弃去二抗,TBST 洗涤5 次,5 min·次-1,即可进行ECL 化学反应发光显影及结果分析。每组实验均重复3 次。
1.6 统计学分析
采用SPSS 13.0 软件进行统计分析。 多组均数比较采用t 检验对数据进行分析,P<0.01 为差异显著,具有统计学意义。
2 实验结果
2.1 身痛逐瘀汤及其单方药对LPS 诱导RAW264.7巨噬细胞NO 分泌的影响比较
为了比较身痛逐瘀汤(F)与其12 种单方药(秦艽、川芎、桃仁、红花、甘草、羌活、没药、当归、香附、牛膝、地龙、灵脂,#1~#12)对LPS 诱导RAW264.7巨噬细胞NO 产生的影响,同样浓度的12 种单方药与F 预处理RAW264.7 细胞30 min,再用1 μg·mL-1LPS 刺激处理24 h 结果显示,只有F 组的处理明显地抑制了LPS 诱导的巨噬细胞NO 的分泌(图1)。

图1 F 与十二种单方药对LPS 诱导RAW264.7巨噬细胞NO 分泌的影响Fig.1 Effects of F and 12 monotherapy on LPS induced NO production in RAW264.7 macrophages
2.2 身痛逐瘀汤对LPS 诱导的RAW264.7 巨噬细胞的iNOS 的表达和NO 的产生的抑制
为了进一步研究F 对LPS 诱导RAW264.7 巨噬细胞NO 分泌的抑制效果,RAW264.7 细胞在不同浓度(1、5、10、15 mg·mL-1)和不同时间段(0、6、12、24 h)用F 预处理30 min 后,再用1 μg·mL-1LPS 刺激细胞24 h,检测细胞培养上清液中的NO 含量和细胞内iNOS 蛋白质表达量。实验结果显示,F 具有浓度和时间依赖性地抑制巨噬细胞NO 的分泌和iNOS 蛋白质的表达(图2 A、B、C、D)。另外,通过比较F 与已知的NO 抑制剂(SMT,硫酸甲基异硫脲)对NO 的抑制效果显示,SMT(1 μg·mL-1)对NO 分泌和iNOS 蛋白的抑制效果要优于F(图2 E、F)。

图2 F 对LPS 诱导RAW264.7 巨噬细胞NO 产生的抑制和对iNOS 表达的影响Fig.2 Effects of F on NO production and iNOS expression in LPS-stimulated RAW264.7 macrophages
2.3 身痛逐瘀汤对LPS 诱导的巨噬细胞活性氧(ROS)产生及对MAPKs 信号通路的影响
为了研究F 对LPS 诱导巨噬细胞产生ROS 的影响,F(10 mg·mL-1)预处理RAW264.7 细胞30 min,LPS(1 μg·mL-1)分别处理细胞(0、6、12、24 h)。结果显示,F 能够有效地抑制LPS 诱导的RAW264.7 细胞活性氧水平(图3A、B)。为了进一步检测F 对MAPK信号通路的影响,RAW264.7 细胞用F 预处理30 min,之后用LPS 处理不同时间段(0、15、30、45 min)。结果显示,F 选择性的抑制了P38 的磷酸化,而对ERK,JNK MAPKs 信号通路并没有影响(图3C、D、E)。
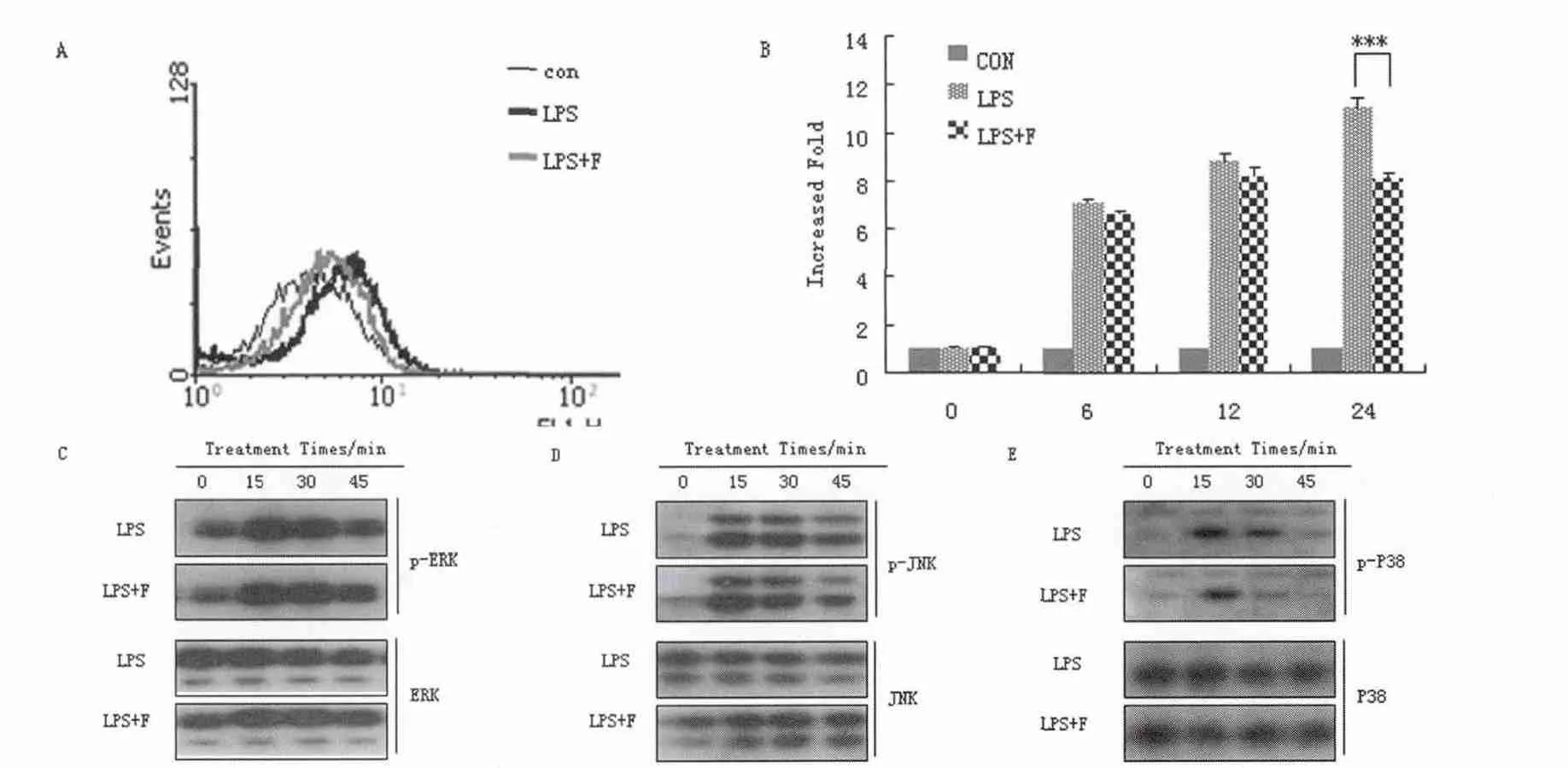
图3 F 对LPS 诱导的RAW264.7 巨噬细胞ROS 水平和P38 信号通路的影响Fig.3 Effects of F on LPS induced RAW264.7 cell ROS levels and P38 signaling pathway
3 讨论
在炎性反应过程中巨噬细胞通过分泌不同的细胞炎症介质间接或直接参与各种炎症性疾病的反应过程。脂多糖(LPS)诱导巨噬细胞NO 分泌以及ROS产生,进一步导致炎症的扩大[14-15]。实验结果表明,单味药物对LPS 诱导的RAW264.7 细胞NO 分泌的抑制作用不明显,与对照组比较无统计学意义。单味中药作用效果不明显的原因可能与药物的提取、精制方法有关。提取时采用水煎煮的方法脂溶性成分没有溶出,溶出的大多是糖、蛋白质、苷类等水溶性成分,由于没有采用进一步的精制工艺,杂质多,影响了药效成分的作用效果。传统水煎获得的提取物在抗炎方面的活性不及乙醇提取物,可能中药抗炎类活性成分以脂溶性小分子居多,水煎制剂可能通过体内代谢才能发挥较强功效[16],此种阐述与实验中单味药物对LPS 诱导RAW264.7 细胞释放NO 的量抑制作用不明显的原因分析一致。
活性氧可以激活多种下游的信号分子,如蛋白激酶C,细胞分裂素活化蛋白激酶(MAPK)以及核转录因子(NF-κB),从而调节各种各样的促炎症因子的表达。MAPKs 广泛存在于真核细胞内,是一组保守的丝苏氨酸蛋白激酶。目前已知的MAPKs 家族的主要成员中ERK1/2、JNK1/2、P38 均可参与对炎症的调控。当巨噬细胞受到LPS 刺激时,细胞内ROS 水平明显就会上升,引起ROS 依赖性MAPKs 信号通路的活化,诱导炎性介质的过度表达进而引起自身免疫疾病以及炎症性疾病。研究中利用LPS 刺激RAW264.7 巨噬细胞后,可以活化MAPKs 信号通路,这与前人的实验研究相吻合[17-18]。F 可以有效地抑制LPS 诱导的RAW264.7 细胞内ROS 水平(图2A、B),因此,认为F 必然对ROS 依赖性的MAPKs 信号通路具有调控作用。实验结果显示,F 选择性地抑制了P38 MAPK 信号通路,说明F 是通过抑制P38 信号通路起到抑制NO 分泌地效果。
综上所述,身痛逐瘀汤可以有效地抑制LPS 诱导的巨噬细胞NO 分泌和细胞内ROS 水平,同时还可以说明这种抑制效果是通过选择性地抑制P38 MAPK 信号通路来完成的。研究结果为身痛逐瘀汤在临床上进一步的应用与开发提供有价值的实验数据与理论依据。
[1]Bernhard B,Nathalie D,Nina G,et al.Redox Control of Inflammation in Macrophages[J].Antioxid Redox Signal,2013,19(6):595-637.
[2]Nathan C.Nitric oxide as a secretory product of mammalian cells[J].FASEB J.,1992,6(12):3051-3064.
[3]Hierholzer C,Harbrecht B,Menezes J M,et al.Essential role of induced nitric oxide in the initiation of the inflammatory response after hemorrhagic shock[J].J Exp Med,1998,187:917-928.
[4]Hibbs J B,Taintor R R,Vavrin Z.Macrophage cytotoxicity:role for L-arginine deiminase and imino nitrogen oxidation to Nitrite[J].Science,1987,235:473-476.
[5]Griffith O W,Stuehr D J.Nitric oxide synthases:properties and catalytic mechanism[J].Annu Rev Physiol,1995,57:707-734.
[6]卢秀红,邓祝新,黄维义,等.一氧化氮在免疫效应机制中的作用及其细胞因子的调控[J].河南畜牧兽医,2009,12(3):10-12.
[7]刘建国,王宪,陈明哲.一氧化氮与细胞因子之间的相互调节作用[J].生理科学进展,2000,31(1):61-64.
[8]Pålsson-McDermott E M,O’Neill L A.Signal transduction by the lipopolysaccharide receptor,Toll- like receptor-4[J].Immunology ,2004,113,153-162.
[9]周忠江,叶海燕,吴赛珠.NO 前体-左旋精氨酸相关肽对大鼠血小板聚集、血栓形成及血浆NO、cGMP、PGI-2 的影响[J].第一军医大学学报,1999,19(6):540-542.
[10]Wang J,Mazza G.Inhibitory effects of anthocyanins and other phenolic compounds on nitric oxideproduction in LPS/IFN-γ-Activated RAW 264.7 Macrophages [J].J Agric Food Chem,2002,50(4):850-857.
[11]阮洪生,刘树民.身痛逐瘀汤治疗骨伤科疾病临床研究进展[J].中国实验方剂学杂志,2011,17(9):275-277.
[12]Zhang Y,Tang Y,Guo J,et al.Dose-effect relationship of traditional Chinese medicine formula for promoting blood circulation to remove stasis on ADP-induced platelet aggregation and rabbit plasma thrombin time[J].China Journal of Chinese Materia Medica ,2009,34 (21):2821-2826.
[13]朱辉军,黄胜光,谭宁,等.身痛逐瘀汤合黛力新治疗风湿性多肌痛临床观察[J].天津中医药,2010,27(3):197-198.
[14]董婷,嵇源源,王剑文.活性氧参与多壁碳纳米管诱导的RAW264.7 细胞毒性[J].生态毒理学报,2013,8(1):55-60.
[15]Guachalla LM,Rudolph K L.ROS induced DNA damage and checkpoint responses[J].Cell Cycle,2010,20(9):4058-4060.
[16]何维.医学免疫学[M].北京:人民卫生出版社,2010.
[17]Karahashi H,Nagata K,Ishii K,et al.A selectiveinhibitor of p38 MAP kinase,SB202190,induced apoptotic cell death of a lipopolysaccharide (LPS)-treated macrophage-like cell line,J774.1 [J].Biochim Biophys Acta,2000,1502(2):207.
[18]徐晓露,张乃博,陈志宝,等.虫草素对OVA 免疫小鼠的体内免疫抑制活性研究[J].黑龙江八一农垦大学学报,2014,26(4):33-35.

