精子纤维鞘发育不良的形态学和遗传学初步研究(附3例报道)*
王家雄杨慎敏**马林伟程洪波李海波. 南京医科大学附属苏州医院生殖与遗传中心 (苏州 25002)2. 盐城卫生职业技术学院
精子纤维鞘发育不良的形态学和遗传学初步研究(附3例报道)*
王家雄1杨慎敏1**马林伟2**程洪波1李海波1
1. 南京医科大学附属苏州医院生殖与遗传中心 (苏州 215002)2. 盐城卫生职业技术学院
摘要目的 分析纤维鞘发育不良患者精子形态学特点,探寻其致病基因。方法 对3例表现为严重弱精子症的患者进行光镜下精液分析,通过扫描电镜和透射电镜进一步明确其超微结构特点。候选基因精子鞭毛蛋白2 (SPEF2)和减数分裂特异性蛋白1(MNS1)全外显子测序,分析可能的致病突变位点。结果 3例患者均表现为100%(或接近)不活动精子,精子存活率26.0%~80.0%。光镜和扫描电镜下可见无尾、粗短尾、卷尾和不规则尾等严重畸形,DFS缺陷精子分别占99.5%,97.5%和79.5%。透射电镜表现为精子鞭毛纤维鞘等多种结构组装异常,伴有中心微管缺失(59%~78%)和动力蛋白臂缺失。MNS1和SPEF1基因外显子未见病理性突变。结论 DFS是严重弱精子症原因之一,根据形态学特点可以诊断;遗传学病因有待研究。
关键词精子/超微结构; 弱精子症; 鞭毛
按照精液特征不育男性可以诊断为少精子症、弱精子症和无精子症等,隐藏在精液表现下的原发病因复杂多样。通过标准的评估仍有44%的精液异常原因不明[1]。射出精液中精子均不活动,可能由于获得性和或天性缺陷精子鞭毛缺陷造成[2]。大多数精子表现为活的但不活动提示精子鞭毛超微结构缺陷[3]。原发性纤毛运动障碍(primary ciliary diskinesia,PCD)是纤毛动力蛋白臂缺失为主的超微结构异常,表现为无活动精子或严重弱精子症,以及反复的呼吸道感染症状[4]。
Chemes[5]发现了5名纤维鞘发育不良(dysplasia f the fibrous sheath, DFS)患者,精子95%~100%不活动,光镜下形态呈短、粗和不规则尾。电镜下纤维鞘及线粒体等整个鞭毛组装异常,伴不同程度中心微管及动力蛋白臂缺失[3, 5]。DFS可能为常染色体隐性遗传,一般发病率低于PCD[3]。DFS在中国人群中仅见个别确诊或可疑病例报道,发病率不详[6-9]。我们最近报道了中国DFS患者,但初步的遗传学分析未发现致病基因[10]。
目前已经有多种动物基因敲除模型用来研究人类精子鞭毛异常,也为DFS研究提供工具[11]。精子鞭毛蛋白2(sperm flagella protein 2,SPEF2)和减数分裂特异性蛋白1(meiosis-specific nuclear structural rotein 1,MNS1)基因突变小鼠精子表型与人类
FS相似[12,13],故作为候选基因对3例患者进行测序分析。
资料与方法
一、临床资料
2012年12月至2014年6月来我院就诊的不育男性例,原发不育2~7年。均为汉族,现居苏州,病例1 和2籍贯苏州,病例3籍贯山西。精液检查提示为严重弱精子症及严重精子鞭毛畸形。病例1在1岁时有急性肺炎病史以及慢性咳嗽。其余2例否认反复呼吸道感染、鼻窦炎病史,未发现内脏反位情况。生殖系统体格检查未见异常,染色体核型分析均为正常核型。性激素和精浆抗精子抗体检测未见异常。生殖系统超声检查,睾丸、附睾、精索静脉、前列腺及精囊均未见特殊病变。病例1的父母为姨表亲。患者均签署知情同意书参与本项研究,并获得我院伦理委员会通过。
二、精子形态学分析
(一)光镜下观察
患者禁欲2~7d手淫取精,在37℃温箱30min精液液化后,按照世界卫生组织《人类精液检查与处理实验室手册》第5 版标准进行精液常规分析。存活率试验采用伊红-苯胺黑染色,着色精子为死精子。精子形态分析采用改良巴氏染色,计数200个精子尾部,将无尾、粗短尾、卷尾和不规则形记为DFS精子。不规则尾指精子尾部正常结构难以辨认,全部或部分被杂乱结构占据。精液常规和精子形态学分析至少重复两次。
(二)电镜观察
精液液化后,380×g 离心15min,0.1mol/L PBS洗涤2次,离心设定同前。使精子沉淀松散后缓慢加入2.5%戊二醛固定液固定12 h,PBS缓冲液冲洗2次,每次15min,之后经过1%锇酸后固定1 h,再经过 PBS缓冲液冲洗2次,每次15min,需要观察表面结构的样本经过乙醇逐级脱水,100%丙酮和乙酸异戊酯置换后,进行临界点干燥和离子溅射喷金,最后在扫描电镜(Stereoscan260, Cambridge, UK)下观察。而需要观察内部超微结构的标本在锇酸后固定和PBS冲洗后,经2%醋酸铀染色,乙醇逐级脱水,100%丙酮置换,用环氧树脂Epon 812包埋,切片机超薄切片,醋酸铀与柠檬酸铅双重染色,最后在透射电镜(TECNAI-10; Philips, Amsterdam, Netherlands)下观察精子尾部超微结构。
三、遗传学分析
抽血患者外周血2 m l(E D TA抗凝),应用 QIAamp mini blood kit外周血DNA提取试剂盒(Qiagen,德国)提取基因组DNA。根据SPEF2 基因(Genbank ID:NC_000005)和MNS1(Genbank ID:NC_000015)外显子及其侧翼区碱基序列,采用Premer Premier 6.0 软件设计相应引物,引物交由上海捷瑞公司合成。PCR扩增产物经1.5%琼脂糖凝胶电泳30min,溴化乙锭染色,于凝胶成像系统中观察PCR产物特异性。PCR产物纯化后再行双向测序PCR反应,并将产物再次纯化后于ABI 3130遗传分析仪毛细管电泳。应用DNAstar软件将测序结果与Genebank的参考序列进行对比,确定突变位点。
结 果
一、精液基本参数
经过多次精液检测3例患者均表现为无活动精子,病例2 在1份精液标本中偶见微动精子。3个病例的精液量和pH值基本正常,精子浓度正常或偏低,精子存活率分别为26%、30%~80%和35.6%。光镜下形态分析,精子头部形态无特殊异常,尾部出现严重的畸形,突出表现为精子主段增粗、无尾、短尾和卷尾,符合DFS的诊断标准(图1)。根据DFS缺陷精子的比例,病例1(94.5%)和病例2(99.5%)诊断为完全型DFS,病例3(79.5%)诊断为不完全型DFS。见表1。
二、精子超微结构特点
与光镜观察相比,扫描电镜更加清晰地观察到精子尾部畸形,部分精子尾部仅存末段样的结构(图2A2A)。在透射电镜下,纵切面可见精子纤维鞘以及线粒体等细胞器未能在正常的位置完成组装,而是紊乱的堆积在精子尾部(图2B2B)。横断面可见精子纤维鞘明显增厚,病例1~3精子中心微管缺失率分别为59%, 78%和 62%。内、外侧动力蛋白臂不同程度缺失(图2C2C)。
三、测序结果
3例患者的MNS1和SPEF2基因所有外显子区均无致病意义突变产生。
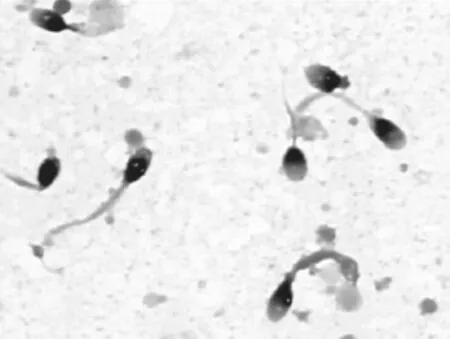
图1 光镜下DFSDFS精子形态

表1 DFS病例的精液特点
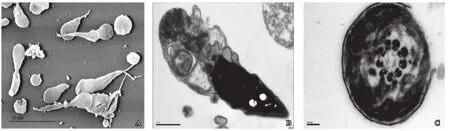
图2 DFS精子超微结构变化
讨 论
鞭毛是精子的运动装置,严重弱精子症可源于精子鞭毛结构异常[3]。本组病例均表现为100%不动精子,病例2在其中一次检测中偶见微动精子。光镜下形态分析,79.5%~99.5%的精子出现粗、短和不规则尾,符合DFS精液特点[5]。根据DFS缺陷精子所占比例,病例1和2为完全型DFS,病例3为不完全型DFS[14]。通过超微结构分析,精子活力的完全丧失更可能与精子动力蛋白臂缺失相关,与受累精子比例无明确关系。本研究中精子存活率为26%~80%不等,即使精子存活率为0%,DFS也并非继发于死精子症[14, 15]。
透射电镜可以对精子尾部超微结构进行观察,并指导治疗方式和病因学研究。当前向运动精子率≤7%且存活率>50%时,可能存在源于遗传学因素的精子鞭毛超微结构异常[16]。虽然3个病例在光镜下表现相近,但超微结构存在差别。中心微管和动力蛋白臂缺失率不同,这提示不同的分子基础。DFS是精子纤维鞘组装异常为共同表现的综合征,是整个精子鞭毛的组装异常。DFS精子免疫荧光显示纤维鞘成分散,纤维鞘结紊乱和不完全组装;多数精子线粒体鞘减少、组装异常或缺失[17]。
卵胞浆内单精子注射(intra-cytoplasmic sperm injection,ICSI)使包括DFS在内的多种精子鞭毛异常男性有机会生育后代[18]。但随之带来遗传风险,有必要探寻DFS的分子病因以进行遗传咨询。A激酶锚定蛋白3(A-kinase anchoring proteins 3,AKAP3)和AKAP4是精子纤维鞘的主要成分并参与调节精子运动[19]。研究发现5例DFS患者中1例AKAP3、AKAP4基因缺失突变[20]。但是并未发现其余的DFS患者存在AKAP3和AKAP4基因突变[17, 21, 22]。最近,动力蛋白重链基因1(dynein heavy chain 1,DNAH1)被确认为部分北非DFS男性的遗传基础[23]。我们对6例中国DFS患者的AKAP3和AKAP4全外显子,以及包含上已报道突变位点的DNAH1基因4个外显子进行测序,未发现病理性突变[10]。
猪罹患的一种常染色体隐性遗传病,不活动短尾精子(immotile short tail sperm,ISTS)精子表型类似DFS[24]。这种疾病是由于SPEF2基因插入突变导致[25]。SPEF2基因突变小鼠伴有精子纤维鞘发育异常和严重精子尾部畸形[12]。但是本组3例患者SPEF2基因的全外显子测序,并没有发现病理性突变。小鼠MNS1对精子鞭毛组装十分重要,特异性表达于睾丸,肺和卵巢少量表达,编码轴丝蛋白,蛋白表达于晚期粗线期精子细胞、双线期生精细胞和精子细胞;突变小鼠表现为不活动短尾精子,轴丝微管和动力臂异常,精子主段缺失[13]。MNS1蛋白存在于人类精子鞭毛[26],突变小鼠精子表型类似人类DFS,但3例患者MNS1基因测序未能发现阳性结果。从动物模型推测DFS遗传学病因在本研究中并未奏效,新一代测序技术可能为DFS研究带来突破。
DFS在中国人群中鲜有报道,作为不动精子症或严重弱精子症的一种病因,值得临床关注。对可疑病例通过光镜下精子形态观察做出初步诊断,并建议根据超微结构分型。DFS患者的遗传学病因研究,可能对人类精子形成机制和弱精子症的病因带来新的认识。
参 考 文 献
1 Pierik FH, Van Ginneken AM, Dohle GR, et al. The advantages of standardized evaluation of male infertility. Int J Androl 2000; 23(6): 340-346
2 Ortega C, Verheyen G, Raick D, et al. Absolute asthenozoospermia and ICSI: what are the options. Hum Reprod Update 2011; 17(5): 684-692
3 Chemes EH, Rawe YV. Sperm pathology: a step beyond descriptive morphology. Origin, characterization and fertility potential of abnormal sperm phenotypes in infertile men. Hum Reprod Update 2003, 9(5): 405-428
4 Leigh MW, Pittman JE, Carson JL, et al. Clinical and genetic aspects of primary ciliary dyskinesia/ Kartagener syndrome. Genet Med 2009; 11(7): 473-487
5 Chemes HE, Brugo S, Zanchetti F, et al. Dysplasia of the fi brous sheath: an ultrastructural defect of human spermatozoa associated with sperm immotility and primary sterility. Fertil Steril 1987; 48(4): 664-669
6 杨慎敏, 李铮, 李红. 精子纤维鞘发育不良的研究进展.中华男科学杂志 2014; 20(11): 1035-1038
7 李满, 庄广伦, 周灿权, 等. 卵浆内单精子注射治疗精子尾部发育不良不育1例. 生殖医学杂志 2000; 9(3): 178-179
8 林谦, 白文俊, 郑姝颖, 等. 重度特发性弱精子症患者精子鞭毛超微结构的研究: 附22例报告. 中华男科学杂志2014; 20(2): 156-159
9 刘锋, 丘映, 王东玮, 等. 用ICSI治疗纤毛运动障碍不育患者1例报告. 第三军医大学学报 2001; 23(7): S131-S134
10 Yang SM, Li HB, Wang JX, et al. Morphological characteristics and initial genetic study of multiple morphological anomalies of the fl gella in China. Asian J Androl 2015; 17(3): 513-515
11 Escalier D. Knockout mouse models of sperm fl agellum anomalies. Hum Reprod Update 2006; 12(4): 449-461
12 Sironen A, Kotaja N, Mulhern H, et al. Loss of SPEF2 function in mice results in spermatogenesis defects and primary ciliary dyskinesia. Biol Reprod 2011; 85(4): 690-701
13 Zhou J, Yang F, Leu NA, et al. MNS1 is essential for spermiogenesis and motile ciliary functions in mice. PLoS Genet 2012; 8(3): e1002516
14 Chemes HE, Olmedo SB, Carrere C, et al. Ultrastructural pathology of the sperm fl agellum: association between fl agellum pathology and fertility prognosis in severely asthenozoospermic men. Hum Reprod 1998; 13(9): 2521-2526
15 Toyama Y, Sumiya H, Fuse H, et al. A case of an infertile man with short-tailed spermatozoa. Andrologia 1996; 28(2): 81-87
16 Francavilla S, Pelliccione F, Cordeschi G, et al. Utrastructural analysis of asthenozoospermic ejaculates in the era of assisted procreation. Fertil Steril 2006; 85(4): 940-946
17 Baccetti B, Collodel G, Gambera L, et al. Fluorescence in situ hybridization and molecular studies in infertile men with dysplasia of the fibrous sheath. Fertil Steril 2005; 84(1):123-129
18 Mitchell V, Rives N, Albert M, et al. Outcome of ICSI with ejaculated spermatozoa in a series of men with distinct ultrastructural flagellar abnormalities. Hum Reprod 2006; 21(8): 2065-2074
19 Eddy EM, Toshimori K, O'Brien DA. Fibrous sheath of mammalian spermatozoa. Microsc Res Tech 2003; 61(1): 103-115
20 Baccetti B, Collodel G, Estenoz M, et al. Gene deletions in an infertile man with sperm fi brous sheath dysplasia. Hum Reprod 2005; 20(10): 2790-2794
21 Turner RM, Musse MP, Mandal A, et al. Molecular genetic analysis of two human sperm fibrous sheath proteins, AKAP4 and AKAP3, in men with dysplasia of the fi brous sheath. J Androl 2001; 22(2): 302-315
22 Turner RM, Foster JA, Gerton GL, et al. Molecular evaluation of two major human sperm fibrous sheath proteins, pro-hAKAP82 and hAKAP82, in stump tail sperm. Fertil Steril 2001; 76(2): 267-274
23 Ben KM, Coutton C, Zouari R, et al. Mutations in DNAH1, which encodes an inner arm heavy chain dynein, lead to male infertility from multiple morphological abnormalities of the sperm fl agella. Am J Hum Genet 2014; 94(1): 95-104
24 Sironen AI, Andersson M, Uimari P, et al. Mapping of an immotile short tail sperm defect in the Finnish Yorkshire on porcine Chromosome 16. Mamm Genome 2002; 13(1): 45-49
25 Sironen A, Thomsen B, Andersson M, et al. An intronic insertion in KPL2 results in aberrant splicing and causes the immotile short-tail sperm defect in the pig. Proc Natl Acad Sci U S A 2006; 103(13): 5006-5011
26 Amaral A, Castillo J, Estanyol JM, et al. Human sperm tail proteome suggests new endogenous metabolic pathways. Mol Cell Proteomics 2013; 12(2): 330-342
(2015-01-08收稿)
**共同通讯作者: 杨慎敏, E-mail: drim2004@126.com, Tel: 13584891093; 马林伟, E-mail: xht800703@163.com
doi:10.3969/j.issn.1008-0848.2015.03.004
中图分类号R 698.2
*基金项目资助: 苏州市科教兴卫青年项目(KJXW2013025); 盐城市医学科技发展计划项目(YK2014058)
A preliminary study on morphology and genetics of dysplasia of the fi brous sheath (3 cases report)*
Wang Jiaxiong1, Yang Shenmin1**, Ma Linwei2**, Cheng Hongbo1, Li Haibo1
1. Center for Reproduction and Genetics, Suzhou Hospital Affiliated to Nanjing Medical University, Suzhou 215002,
Jiangsu, China; 2. Yancheng Institute of Health Sciences
Corresponding author: Yang Shenmin, E-mail: drim2004@126.com, Tel: 13584891093; Ma Linwei, E-mail: xht800703@163.com
AbstractObjective To analyze the sperm morphological characteristics of dysplasia of the fi brous sheath (DFS), and explore the possible genetic origin. Methodsthods Three patients with DFS were identifi ed among severe asthenospermia cases, and their semen samples were collected. Ultra-structural features of semen were studied by scanning and transmission electron microscopy (SEM and TEM). Exons of candidate genes MNS1 and SPEF2 were sequenced to search the mutations. Resultssults Analysis of semen samples from all the three patients showed 100% (or nearly) immotility in sperms, and 26%~80% viability in sperms. The morphological assessment under light and SEM presented severe distorted sperm tails, such as absence, short and thick, coiled, and irregular. The affected spermatozoa were 99.5%, 97.5% and 79.5% respectively. In TEM assays, most spermatozoa showed disorganized fi brous sheath, accompanied by distortion of various cytoskeletal components. The absence of central microtubules (59% to 78%) and dynein arms were observed. No likely pathogenic variants in MNS1 and SPEF2 were identifi ed. Conclusionusion DFS is one cause of severe asthenospermia, and the genetic origin deserves further study.
Key wordsords spermatozoa/ ultrastructure; asthenozoospermia; fl agella

