毛细管区带电泳-间接紫外检测法快速测定食品中乳糖、蔗糖、葡萄糖和果糖
张欢欢, 李 疆, 赵 珊, 丁晓静*, 王 志
(1.河北农业大学理学院,河北保定071001;2.北京市疾病预防控制中心,食物中毒诊断溯源技术北京市重点实验室,北京100013)
乳糖、蔗糖、葡萄糖和果糖是食品中常见糖,也是人体主要能量来源,然而过量摄取糖易导致龋齿和肥胖,严重者可引起代谢紊乱而引发糖尿病和冠心病等症[1]。故各类食品中糖的检测方法研究一直是人们关注的热点。
糖的分析方法主要有化学法及仪器分析法。化学法测得的是总糖或还原糖,因使用换算公式[2]而导致测定结果偏高[3,4],操作步骤繁琐[5]。仪器法中气相色谱应用相对较少[6],能够实现多种糖同时分离与测定的高效液相色谱(HPLC)[5,7-13]和离子色谱(IC)[14-20]逐渐成为食品中糖的主要分析方法。因糖类化合物无特征紫外吸收而给直接紫外检测造成困难[11],故文献报道的色谱法大多采用示差折光(RI)[8-10]、蒸发光散射(ELS)[5,7,11]或电化学(EC)[18]检测。RI对温度及压力变化敏感,预平衡时间较长,检出限通常在g/L量级。尽管ELS的灵敏度比RI高1~2个数量级,但易受温度和氮气流速的影响,对实际样品的分析结果并不十分理想。EC的检测灵敏度比RI和ELS均高,但与其联用的IC需使用较昂贵的色谱柱,且大部分色谱柱易受复杂食品样品基体的污染,造成较高的分析成本[21]。
糖的强亲水性给色谱分离造成了困难[22],故文献报道的HPLC或IC法大多采用梯度洗脱进行分离,而分离时间一般为 30 ~ 50 min[11],甚至更长[13,18,19],不利于大量样品分析。高效毛细管电泳(HPCE)以其较HPLC高2~3个数量级的分离效率而非常适合糖的分析。目前用CE进行糖类化合物的检测有直接检测、间接检测和衍生后检测3种方法,每种检测方法各有其优缺点。本文在文献工作[23]的基础上,采用新的分离缓冲体系,建立了毛细管区带电泳(CZE)-间接紫外检测食品中乳糖、蔗糖、葡萄糖和果糖的方法。方法分离效率高、耐用。用该法测定了巧克力蛋糕质控样品和9种食品样品中的4种糖,均获得了满意结果。
1 实验部分
1.1 仪器、材料与试剂
P/ACE MDQ毛细管电泳仪(美国Beckman公司);Millipore Milli-Elix/RiOs型超纯水器(美国Millipore公司);山梨酸钾(纯度>99%,梯希爱(上海)化成工业发展有限公司);磷酸钠(Na3PO4·12H2O,分析纯)、氢氧化钠(NaOH,优级纯)(北京化学试剂公司);十六烷基三甲基溴化铵(CTAB,纯度≥99%)(美国Sigma-Aldrich公司);葡萄糖(纯度98%)、果糖(纯度99%)、蔗糖(纯度99%)和乳糖(纯度98%)均购自美国Chemservice公司;内径50 μm未涂层熔融石英毛细管(河北永年锐沣色谱配件有限公司);英国弗帕斯食品分析水平评估计划(FAPAS)巧克力蛋糕质控样品(20110)购自北京中检维康技术有限公司;苹果醋、干红葡萄酒、雪碧、果珍冲剂、雪梨汁、奶酪、花青素饮料、人参蜂王浆和花粉伴侣等样品购自超市。
1.2 实验方法
1.2.1 标准储备液的配制
准确称取0.010 0 g葡萄糖、果糖、乳糖及蔗糖,分别置于1.5 mL塑料离心管中,加入1 mL超纯水,涡旋溶解,得到质量浓度均为10 g/L的标准储备液,4℃冰箱中保存。
1.2.2 标准工作液的配制
将4种糖的储备液分别用超纯水稀释成一系列浓度的混合工作液。其中葡萄糖和果糖工作液的质量浓度依次为75、150、300、600 及 1 200 mg/L,乳糖工作液的质量浓度依次为 150、300、600、1 200及2 400 mg/L,蔗糖工作液的质量浓度依次为300、600、1 200、2 400 及 4 800 mg/L。
1.2.3 样品前处理
巧克力蛋糕和奶酪:称取0.10 g样品,置于15 mL塑料离心管中,加入10 mL 5 mmol/L醋酸,涡旋、超声 20 min,于 9 000 r/min 下离心 5 min,经0.45 μm滤膜过滤,滤液供分析。
花粉伴侣、固体颗粒冲剂:称取0.10 g样品,用5 mL超纯水溶解,涡旋混溶,稀释适当倍数后进样。
其余样品直接进样或用超纯水稀释后进样。
1.2.4 电泳条件
毛细管:30.2 cm(有效长度 20 cm)×50 μm;分离缓冲溶液:4 mmol/L 山梨酸钾 +10 mmol/L Na3PO4+30 mmol/L NaOH (pH 12.56)+0.5 mmol/L CTAB;分离电压:-8 kV;检测波长:254 nm;进样压力:3.448 kPa;进样时间:3 s。新的毛细管依次用1 mol/L NaOH溶液冲洗20 min、超纯水冲洗5 min、分离缓冲液冲洗5 min。每次进样前依次用1 mol/L NaOH溶液、超纯水及分离缓冲液各冲洗2 min,以保证方法的重现性。
2 结果与讨论
2.1 探针和检测波长的选择
间接紫外法是测定没有特征紫外吸收物质如糖的较为简单和易行的方法。其中探针及检测波长的选择是关键。探针的淌度和浓度是关系到分离效能的参数,因为它们会影响峰形及分离效率。探针与分析物的淌度越接近,则峰形越好、灵敏度越高[24,25]。山梨酸盐、乳糖、葡萄糖、果糖及蔗糖的淌度分别为 3.16 × 10-4cm2/(V ·s)[24],2.85 ×10-4、3.20 × 10-4、3.22 × 10-4cm2/(V·s)[26]及4.20 ×10-4cm2/(V·s)[25]。4 种糖与山梨酸盐的淌度相似。故山梨酸是糖分析中比较好的探针,其在256 nm处的摩尔吸光系数为27 800 L/(mol·cm)[22]。文献[23]将山梨酸作为紫外探针实现了蜂蜜中3种糖(葡萄糖、蔗糖及果糖)的同时分离与测定。但考虑到20℃时山梨酸在水中的溶解度为0.16%,而山梨酸钾的溶解度为67.6%[27],本研究选用了易溶于水的山梨酸钾作为探针。由于钾离子(抗衡离子)的存在,山梨酸钾会降低检测灵敏度,但能够满足食品样品中糖的分析需求,因为所测食品中4种糖的质量分数均大于1%。
为获得大多数物质的高灵敏度检出,一般在200 nm 或者 205 nm 波长附近检测[12],亦有文献[23]选用254 nm作为检测波长,故本实验比较了检测波长分别为200、214和254 nm时4种糖的检测灵敏度。图1表明,214 nm检测时4种糖的灵敏度低于其他两个波长的检测灵敏度,而200 nm和254 nm的检测灵敏度差别不大,本实验选择254 nm作为检测波长。
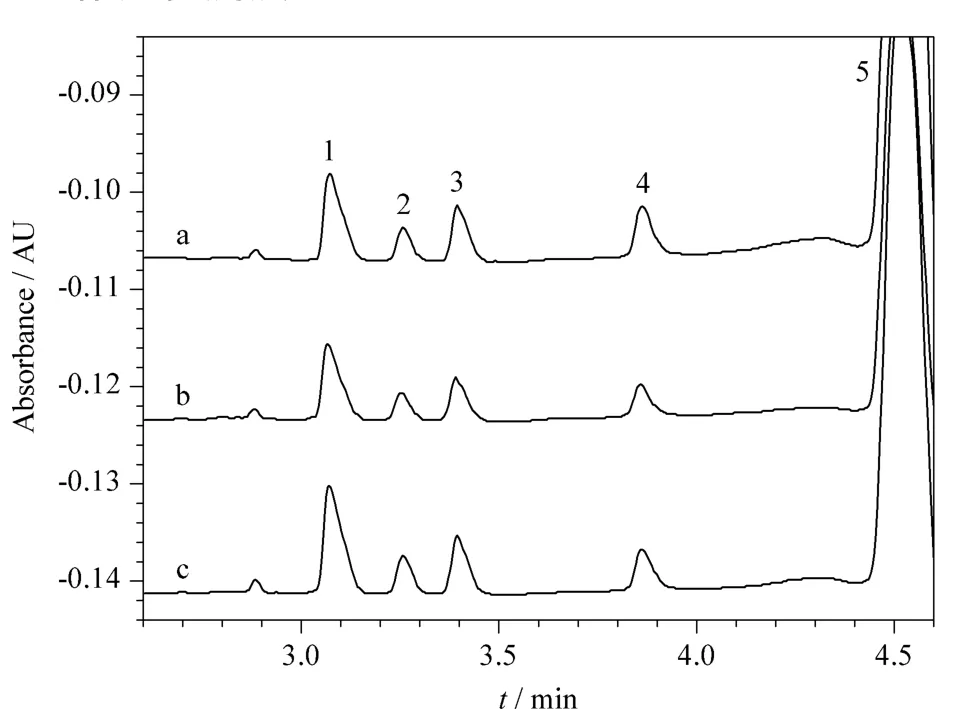
图1 山梨酸钾为探针时4种糖混合标准溶液在不同检测波长的电泳图Fig.1 Electrophoregrams of the mixed four carbohydrate standard solution at different detection wavelengths using potassium sorbate as a probe
2.2 探针浓度的选择
探针浓度一般选择在2~20 mmol/L,以避免探针浓度过低而引起的电迁移扩散导致的峰展宽,以及过高而导致的基线噪声增加[21,28]。在其他实验条件不变的条件下,考察了 2、4、6和8 mmol/L山梨酸钾对4种糖检测灵敏度的影响。图2显示随着山梨酸钾浓度的增加,4种糖的迁移时间均逐渐增加并伴随电泳峰展宽。综合考虑分离度及分析时间,最终选择山梨酸钾的浓度为4 mmol/L。
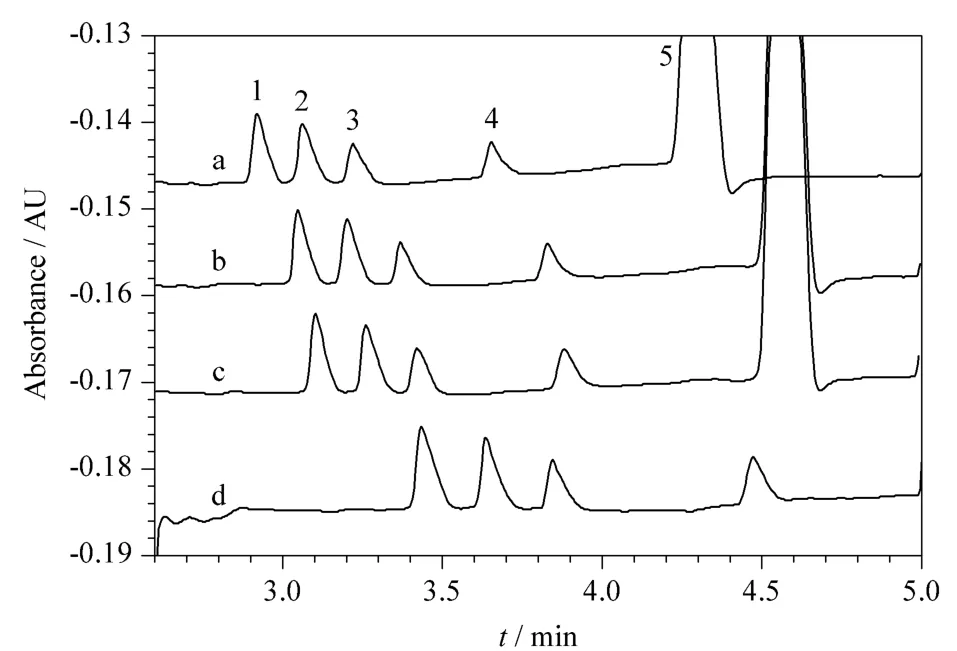
图2 山梨酸钾浓度对4种糖分离的影响Fig.2 Effect of the concentration of potassium sorbate on the separation of the four carbohydrates
2.3 分离缓冲溶液体系及其浓度的选择
糖分子上的羟基具有一定的酸性,能在强碱下解离,解离常数 pKa在 12 ~14 之间[22]。Colón等[29]和 Rizelio 等[23]分别 用 100 mmol/L 和 40 mmol/L NaOH溶液作为分离缓冲溶液,分别实现了15种糖和3种糖的同时分离与测定。如此高浓度的强碱溶液一方面不易准确配制,另一方面pH易受空气中CO2的影响,生成的碳酸盐导致分离缓冲溶液的pH发生改变,故迁移时间的重现性不好。为保证迁移时间及定量结果的重现性,需经常更换溶液。
磷酸盐因本底紫外吸收低、其pKa3=12.36,缓冲范围在pH 11.36~13.36之间,因而常成为分离常见糖的缓冲体系。间接紫外法需选用低浓度盐作为缓冲溶液,通常控制浓度在5~10 mmol/L之间[30];此外,分离缓冲溶液具有缓冲能力的最低浓度一般为10 mmol/L[30]。本研究分别考察了10、15及20 mmol/L磷酸钠对4种糖分离的影响。如图3所示,随着磷酸钠浓度的增加电渗流降低,4种糖的迁移时间增加;另外,焦耳热的增加导致4种糖的灵敏度下降,故磷酸钠的最佳浓度选为10 mmol/L。
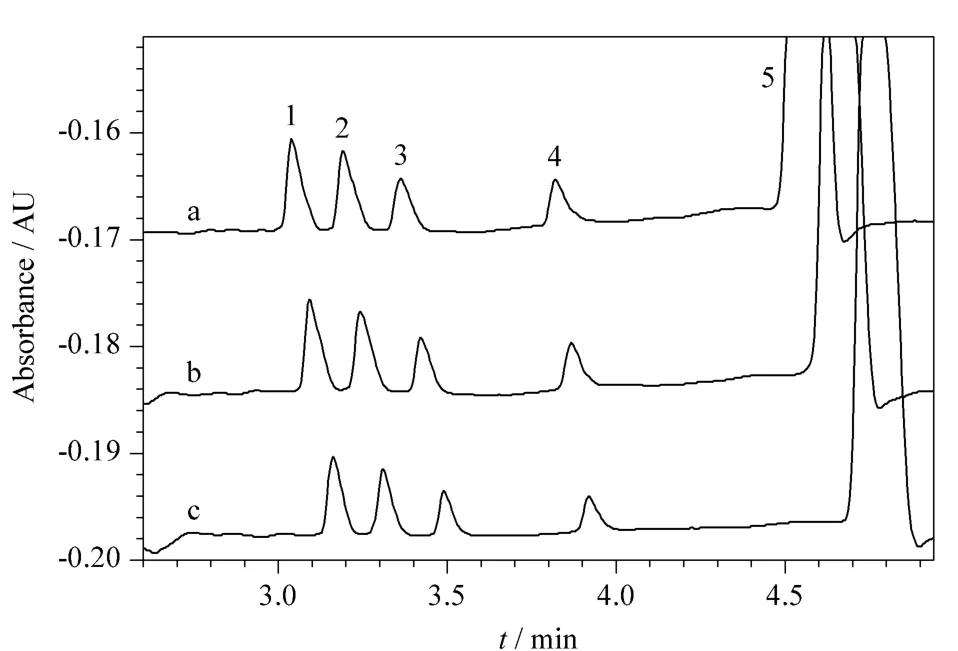
图3 Na3PO4溶液浓度对4种糖分离的影响Fig.3 Effect of the concentration of Na3PO4solution on the separation of the four carbohydrates
2.4 分离缓冲溶液pH的优化
分离缓冲溶液的pH影响电渗流及待分析物所带电荷,从而影响分析物的迁移时间和分离效率。在其他实验条件不变的情况下,考察了磷酸盐缓冲溶液pH分别为12.30、12.40、12.56及12.60(相应NaOH 溶液的浓度分别为20、25、30 及35 mmol/L)时对4种糖分离的影响。如图4所示,随着pH增加,4种糖的迁移时间减少,乳糖与果糖间的分离度相应增加。在保证分离度的情况下,NaOH溶液的浓度越低越好,以避免CO2的干扰。最终确定最佳pH为 12.56,相应的 NaOH溶液的浓度为 30 mmol/L。
2.5 毛细管内径、长度及进样时间的选择
兼顾检测灵敏度和分离度,内径50 μm的石英毛细管最为常用。由于所测食品中常见糖的质量分数大于1%,故选用50 μm内径毛细管足以满足检测灵敏度的需求。选择比文献[23]所用毛细管(8.5 cm)要长的毛细管,即采用30.2 cm(有效长度20
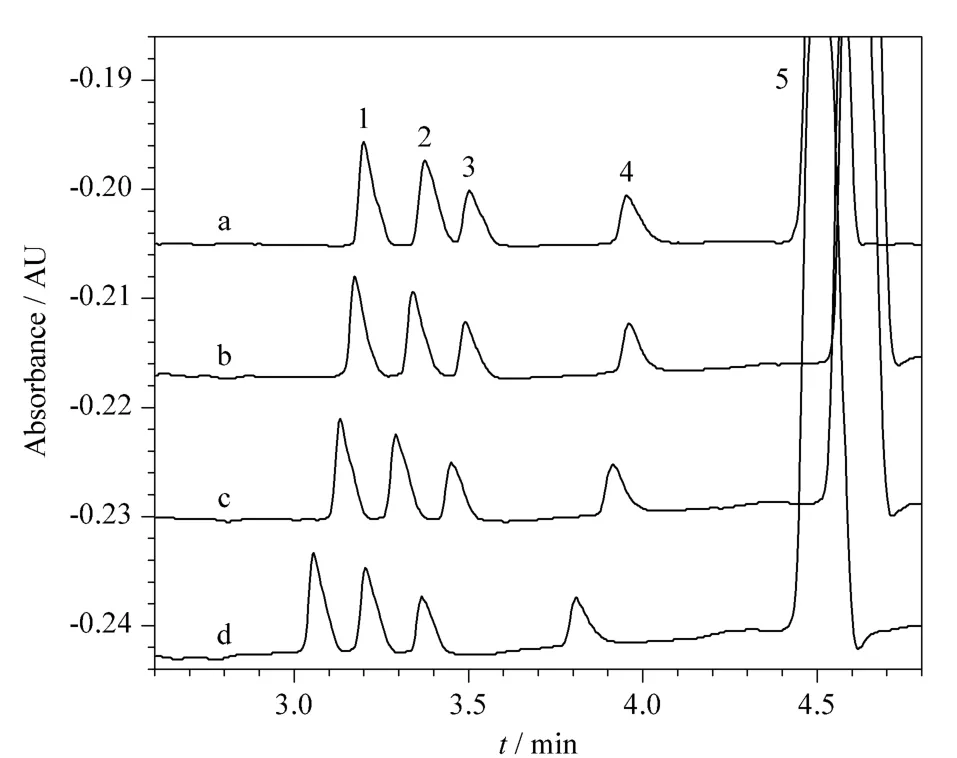
图4 分离缓冲液的pH对4种糖分离的影响Fig.4 Effect of the pH of separation buffer on the separation of the four carbohydrates
cm)毛细管,获得了优于文献[23]的分离能力,葡萄糖和果糖可达基线分离。为避免因进样引起的区带展宽,进样区带长度应不超过毛细管总长度的2%[31]。利用CE Expert软件计算,最佳进样时间选择为3 s。
2.6 工作曲线和方法精密度
在上述优化的实验条件下,将上述一系列混合标准工作液依次进样,校正峰面积外标法定量。由表1可见,校正峰面积(y)与质量浓度(x,mg/L)间呈良好线性关系;葡萄糖和果糖的LOD低于文献[23]的26 mg/L 及 29 mg/L;蔗糖的 LOD 则高于文献[23](22 mg/L),但仍能满足实际样品分析的检测需求。
以FAPAS巧克力蛋糕质控样品(20110)进行方法精密度试验,按1.2.3节样品前处理方法平行处理7份样品后进样测定,蔗糖的测定结果为38.29%,相对标准偏差为1.5%。
2.7 回收率
以仅含乳糖的植物黄油样品为本底进行4种糖的加标回收率试验,结果见表2。
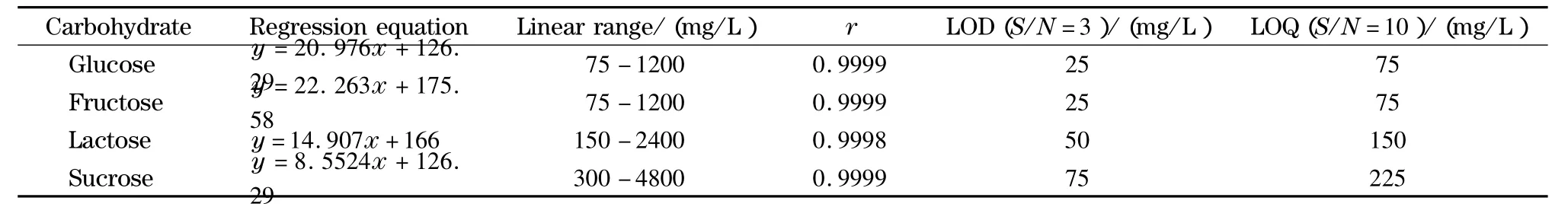
表1 4种糖的线性关系、检出限和定量限Table 1 Linear relationships,LODs and LOQs of the four carbohydrates
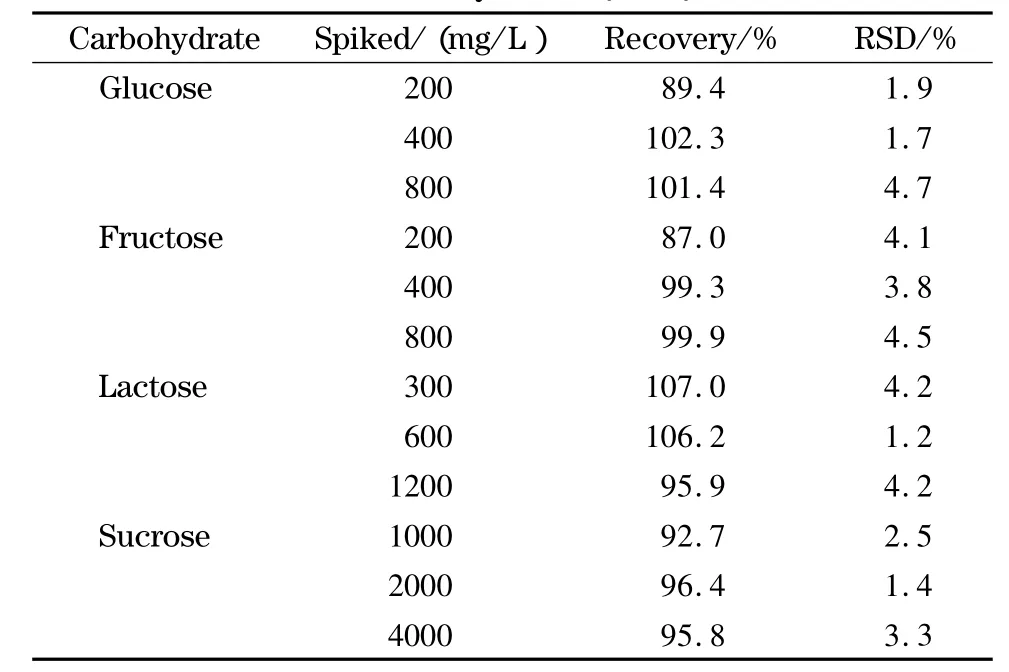
表2 4种糖的加标回收率(n=5)Table 2 Spiked recoveries of the four carbohydrates(n=5)
2.8 实际样品测定
在对FAPAS质控样品分析并获满意结果的基础上,用本法对苹果醋、奶酪等多种样品进行测定,结果见表3和表4,其中雪梨汁和奶酪的电泳图见图5。测定奶制品时半乳糖干扰乳糖测定,但其他类样品不受干扰。
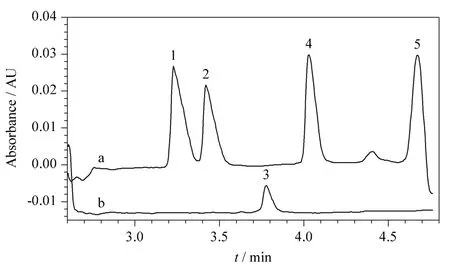
图5 (a)雪梨汁和(b)奶酪样品的电泳图Fig.5 Electropherograms of(a)pear juice and(b)cheese samples
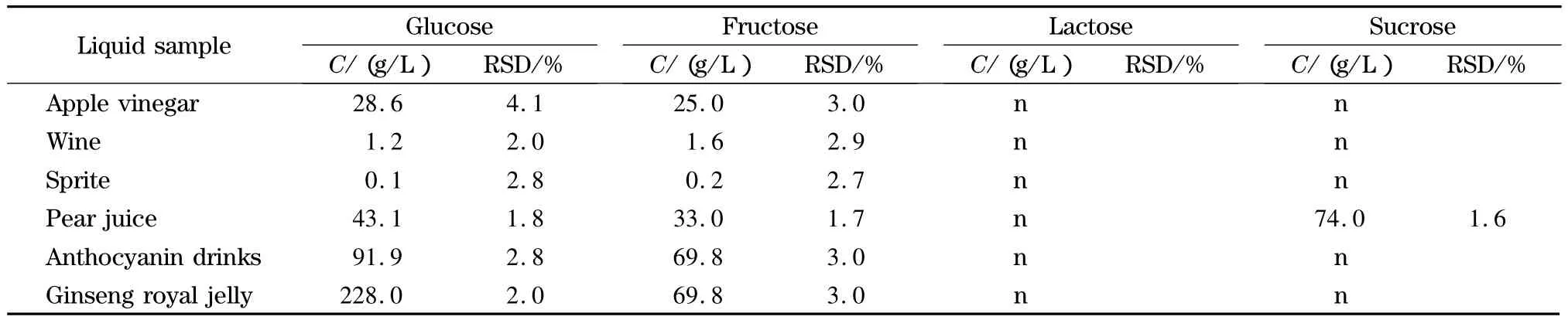
表3 液体食品中4种糖的测定结果(n=5)Table 3 Mass concentrations of the four carbohydrates in liquid food samples(n=5)
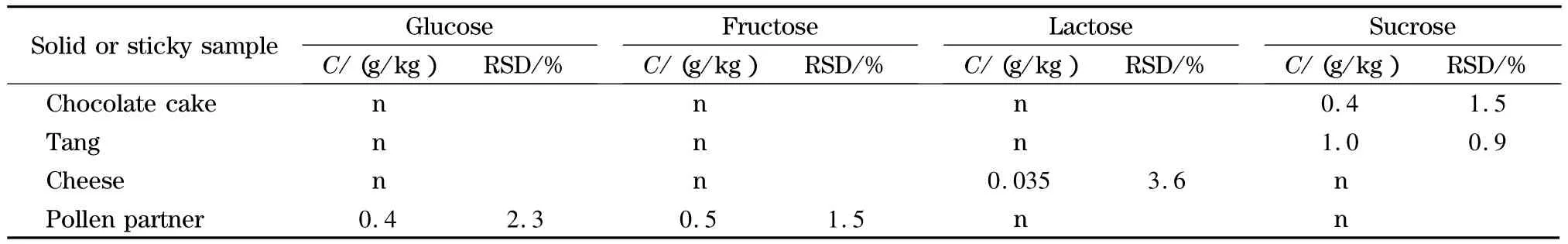
表4 固态食品中4种糖的测定结果(n=5)Table 4 Contents of the four carbohydrates in solid or sticky food samples(n=5)
3 结论
采用毛细管区带电泳-间接紫外法,以简单的磷酸盐分离缓冲体系,在10 min(预清洗6 min;分离4 min)内即可完成4种糖的同时分离与测定。样品前处理简单(仅需用水或醋酸提取),降低了检测成本,提高了实际样品的分析速度,可获得精密而准确的分析结果。本方法适用于食品中乳糖、蔗糖、葡萄糖和果糖的同时测定。但该方法测定奶制品中乳糖时,半乳糖干扰其测定。
[1] Ren L P,Song G Y.Chinese General Practice(任路平,宋光耀.中国全科医学),2011,14(4B):1278
[2] Zuo T M.China Inspection and Quarantine(左天明.中国检验检疫),2012(9):19
[3] GB /T 5009.7-2008
[4] GB /T 5009.8-2008
[5] Lin H,Yan C R,Xu C X,et al.Food Science(林慧,颜春荣,徐春祥,等.食品科学),2013,34(12):286
[6] Wang F Q,Yang H X,Wang Y Z.Chinese Journal of Chromatography(王凤芹,杨航仙,汪以真.色谱),2013,31(1):53
[7] Shanmugavelan P,Kim S Y,Kim J B,et al.Carbohyd Res,2013,380:112
[8] Zakharova A M,Grinshtein I L,Kartsova L A.J Anal Chem,2013,68(12):1081
[9] Oliver J D,Gaborieau M,Hilder E F,et al.J Chromatogr A,2013,1291:179
[10] Yilmaz M T,Tatlisu N B,Toker O S,et al.Food Res Int,2014,64:634
[11] Ma C M,Sun Z,Chen C B,et al.Food Chem,2014,145:784
[12] Ghfar A A,Wabaidur S M,Ahmed A Y B H,et al.Food Chem,2015,176:487
[13] Ding H L,Li C,Jin P,et al.Chinese Journal of Chromatography(丁洪流,李灿,金萍,等.色谱),2013,31(8):804
[14] Eggleston G.Food Chem,1999,65:483
[15] Zheng H L,Deng B H,Xiao G Q,et al.Food Science (郑惠玲,邓宝浣,肖桂秋,等.食品科学),2014,35(6):180
[16] Xi L L,Wang F L,Zhu Z Y,et al.Talanta,2014,119:440
[17] Guignard C,Jouve L,Bogéat-Triboulot M B,et al.J Chromatogr A,2005,1085:137
[18] Fa Y,Yang H Y,Ji C S,et al.Anal Chim Acta,2013,798:97
[19] Li J,Chen M L,Zhu Y.J Chromatogr A,2007,1155:50
[20] Xu Y,Zang Y,Jiang T,et al.Chinese Journal of Chromatography(徐颖,臧颖,姜婷,等.色谱),2014,32(12):1400
[21] Chen T,Ding X J,Li Y Z,et al.Chinese Journal of Chromatography(陈桐,丁晓静,李一正,等.色谱),2014,32(6):666
[22] Chen Y.Capillary Electrophoresis Technology and Application.2nd ed:Beijing:Chemical Industry Press(陈义.毛细管电泳技术及应用.2版.北京:化学工业出版社),2006
[23] Rizelio V M,Tenfen L,Silveira R D,et al.Talanta,2012,93:62
[24] Boyce M C,Breadmore M,Macka M,et al.Electrophoresis,2000,21:3073
[25] Macka M,Johns C,Doble P,et al.LC GC CE Currents,2001,19(1):38
[26] Grill E,Huber C,Oefner P,et al.Electrophoresis,1994,14:1004
[27] Sheng L,Su B Q.Chinese Journal of Chemical Education(盛丽,苏碧泉.化学教育),2004,25(7):8
[28] Xu X,Kok W T,Poppe H.J Chromatogr A,1997,786:333
[29] Colón L A,Dadoo R,Zare R N.Anal Chem,1993,65:478
[30] Schellinger A P,Carr P W.LC GC North America,2004,22(6):544
[31] Weston A,Brown P R.HPLC and CE Principles and Practice.San Diego:Academic Press,1997:145

