光照对苦荞芽多酚类物质及抗氧化活性的影响
殷培蕾,李 静,邓园园,闫 娟,彭镰心,赵 钢
(1.西华大学 生物工程学院,四川 成都 610039;2.成都大学 生物工程学院,四川 成都 610106)
0 引 言
荞麦属蓼科荞麦属双子叶作物[1-2],苦荞与甜荞是两种主要的栽培种,其中,苦荞不仅含有黄酮、D-手性肌醇(DCI)、γ-氨基丁酸(GABA),大黄素[3-5]等有效成分,还含有丰富且更为平衡的氨基酸、维生素、矿物质等[6-9].萌发以后的苦荞,其脂肪酸和氨基酸的营养价值更高,更能满足人体的需要.另外,萌发一段时间的苦荞芽,其黄酮和酚酸类物质的含量会大幅增加[10-11].所以,生产苦荞芽可增加其附加值,改变苦荞以苦荞茶产品为主的现状,为苦荞的深加工奠定一定的基础[12].相关研究发现,苦荞中黄酮等多酚类成分与苯丙氨酸解氨酶(phenylalanineammonia-1yase,PAL)活力的高低有非常密切的关系,而PAL 活性受光照、温度、诱导剂等因素影响[13-17].在此基础上,为更全面地评价光照对苦荞芽品质的影响,本研究对光照与黑暗条件下苦荞芽中绿原酸、咖啡酸、对香豆酸、荭草素、异荭草素、阿魏酸、牡荆素、芦丁、槲皮素、山奈酚10 种酚类物质进行测定,并采用主成分分析和聚类分析研究光照对苦荞芽中多酚类物质的影响规律,同时分析光照对苦荞芽抗氧化活性的影响情况.
1 材料与方法
1.1 实验材料
1.1.1 种 子.
实验所用荞麦品种为西荞一号,其种子于2012年11月采收于成都大学荞麦试验田.
1.1.2 仪器与试剂.
实验所用仪器包括:高效液相色谱仪(日本岛津仪器公司),LGJ-10C 型四环冻干机,PQX-300B 型多段可编程人工气候箱,DHP-9160B 型智能电热恒温培养箱,TDL-4A 型离心机,DFT-100 型手提式高速粉碎机,Spectrum 量子光亮计,ESJ210-4B 型电子天平,KH5200DE 型数控超声波清洗器,SHZ-95B 型循环水式多用真空泵.
实验所用试剂包括:绿原酸、咖啡酸、对香豆酸、荭草素、异荭草素、阿魏酸、牡荆素、芦丁、槲皮素、山奈酚标准品(中国药品生物制品检定所),甲醇(HPLC级,Sigma-Aldrich 公 司),冰 乙 酸(AR 级)、磷 酸(HPLC 级,科密欧公司),实验用水为乐百氏纯净水.
1.2 实验方法
1.2.1 苦荞的发芽条件.
分别称取20 g 西荞一号种子12 份,于1%的盐水中浸泡15 min,之后用蒸馏水洗净,转移至垫有滤纸的发芽盘中,随机分配光照组和黑暗组各6 盘,放入恒温培养箱先黑暗培养3 天,再分别进行光照处理(光照条件:16 h 光照,8 h 黑暗进行循环;光密度,74.65 μmol/m2/s;温度,25 ℃;湿度,75%)和黑暗处理(黑暗条件:始终处于黑暗状态;温度,25 ℃;湿度,75%).发芽9 d 后取样,冷冻干燥后用于多酚物质及抗氧化活性测定.
1.2.2 苦荞芽长及鲜重的测定.
从光照组与黑暗组中各取样品3 组,每组10 株,去除根和外壳,用直尺测量芽长,并用滤纸将苦荞芽表面的水吸干再称量鲜重.
1.2.3 多酚类物质的提取.
本研究在文献[17]的方法上进行调整:先将苦荞芽进行冷冻干燥,研磨成细粉,取10 mg 的样品,精密称定,精密加入15 mL 含10%磷酸(0.1%)的甲醇,在室温下旋涡振荡5 min,并在37 ℃培养箱中存储3 h,且每隔1 h 旋涡振荡5 min;之后在1 000 g离心5 min 后,用于抗氧化活性与多酚类物质的高效液相色谱测定.
1.2.4 多酚类物质的检测.
多酚类物质检测的色谱条件为:Kromasil 100-5 C18 色谱柱(250 mm ×4.6 mm,5 μM);柱温,40℃;进样量,20 μL;检测波长,350 nm;流动相A,甲醇∶ 水∶ 乙酸(5∶ 92.5∶ 2.5,V/V/V);流动相B,甲醇∶ 水∶ 乙酸(95∶ 2.5∶ 2.5,V/V/V);流速为1 mL/min;洗脱程序为:0.01 ~55 min,0% ~80%;55.01 min,0%;65 min,stop.采用外标一点法计算多酚类物质的含量.
1.2.5 DPPH 清除率的测定.
准确称取12.4 mg DPPH 于100 mL 容量瓶内,用无水甲醇定容,配成0.124 mg/mL 的DPPH 贮备液,避光保存(0 ~4 ℃).取“1.2.3”项中上清液稀释成系列浓度梯度的样液,再进行下列操作:
1)吸取4.0 mL DPPH 溶液于10 mL 试管中,加入1.0 mL 无水甲醇,摇匀,反应30 min 后,以无水甲醇为参比,并于波长517 nm 处测吸光值,记为Ao.
2)吸取4.0 mL 无水甲醇于10 mL 试管中,加入1.0 mL 样液,摇匀,反应30 min 后,以无水甲醇为参比,并于波长517 nm 处测吸光值,记为Ac.
3)吸取4.0 mL DPPH 溶液于10 mL 试管中,加入1.0 mL 样液,摇匀,反应30 min 后,以无水甲醇为参比,并于波长517 nm 处测吸光值,记为As.
计算自由基清除率,
X=[1-(As-Ac)/Ao]%
同时,以样液浓度为横坐标,清除率为纵坐标,绘制标准曲线,再由标准曲线方程求得IC50值(清除率为50%时,抗氧化剂的浓度值).
1.2.6 数据分析.
芽长和鲜重重复实验3 组,采用DPS 7.05 软件进行显著性分析.以多酚类物质含量为自变量,运用在线分析软件MetaboAnalyst 2.0(www.metaboanalyst.ca)进行数据处理,先将数据autoscaling,再进行主成分分析和聚类分析(ward,Euclidean).
2 结果与分析
2.1 荞麦芽的生长
光照/黑暗条件下荞麦芽的生长情况如表1 所示.表1 中,黑暗组的芽长和鲜重均大于光照组,且差异显著.说明光照不利于芽长和鲜重的增加,此与Li 等[17-18]的研究结果一致.

表1 光照/黑暗条件下的芽长和鲜重
2.2 多酚类物质的含量
10 种混合标准品的色谱图如图1 所示,在本实验条件下检测出10 个主要峰,依次为:绿原酸、咖啡酸、对香豆酸、荭草素、异荭草素、阿魏酸、牡荆素、芦丁、槲皮素、山奈酚,保留时间分别为:16.865、19.915、26.332、27.148、27.598、28.198、29.498、32.315、41.215、45.602 min.10 种标准品的混合物能完全分离,峰形较好,没有拖尾现象.样品的光照组色谱图和黑暗组色谱图如图2、3 所示,由图可见,10 种多酚类物质均能被检测,且分离效果较好.

图1 10 种混合标准品色谱图
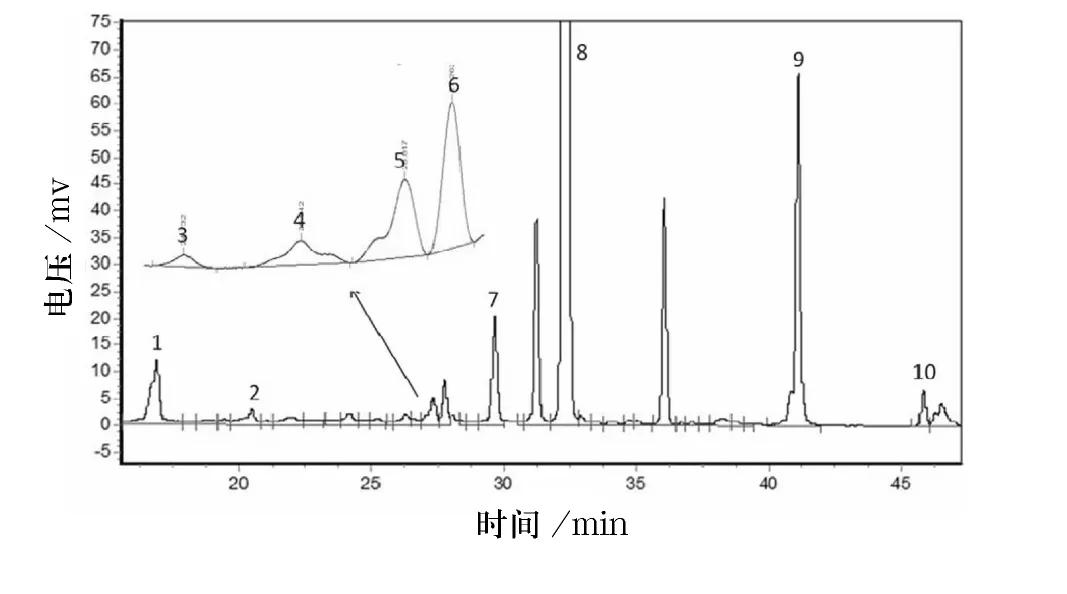
图2 光照组样品色谱图
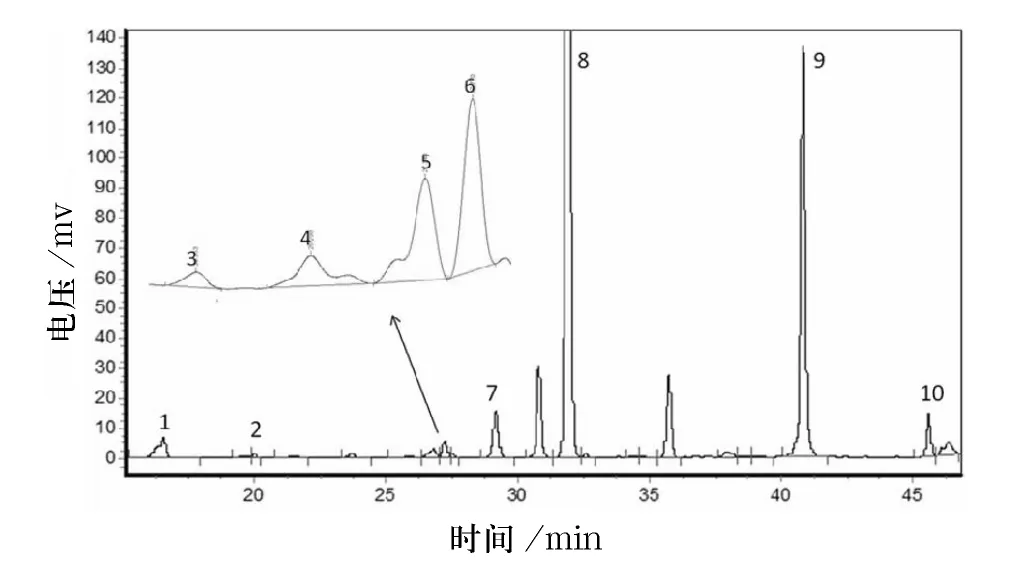
图3 黑暗组样品色谱图
苦荞芽样品中的黄酮和酚酸类物质含量测定结果如表2 所示.由表2 知,黑暗组样品的槲皮素和山奈酚的含量高于光照组,且差异极显著.绿原酸、对香豆酸、荭草素、异荭草素、阿魏酸、牡荆素和芦丁在光照组样品中的含量大于黑暗组,存在极显著差异.而光照组样品中的咖啡酸含量与黑暗组差异不显著.说明苦荞芽在光照条件下,发芽9 d 后槲皮素和山奈酚的含量降低,而对咖啡酸影响不大,其余7 种物质的含量增加.

表2 苦荞芽中黄酮类和酚类物质的含量
2.3 主成分分析
主成分分析是一种降维分析方法,其原理是:设法将原来变量重新组合成一组新的互相无关的几个综合变量,同时根据实际需要从中取出几个较少的综合变量尽可能多地反映原来变量的信息的统计方法.
由图4A 可知,前2 个主成分能解释原变量91.2%的信息,其中,主成分一能解释原变量的82.5%;主成分二能解释8.7%.在PC1 上光照组(L)和黑暗组(D)能完全分离,说明光照对苦荞多酚类成分有显著影响.结合图4B 可知,槲皮素和山奈酚在PC1 上有较大的负贡献,咖啡酸呈较小的正贡献,其余7 种物质呈较大正贡献,此表明光照组样品的槲皮素和山奈酚含量低于黑暗组,其余物质含量高于黑暗组.
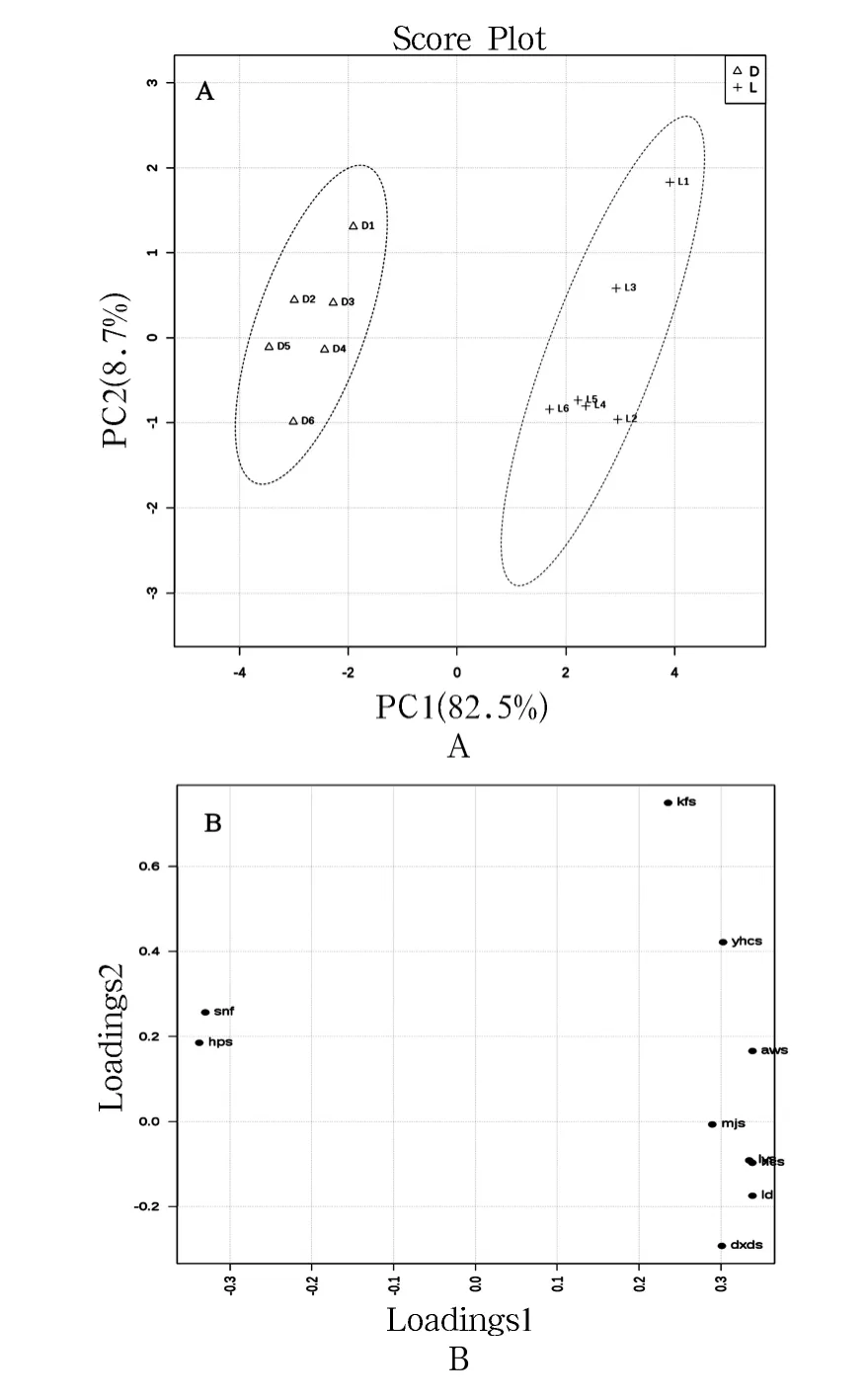
图4 主成分得分图(A)及主成分载荷图(B)
2.4 聚类分析
聚类分析是指把相似的对象通过静态分类的方法分成不同的组别或者更多的子集,这样让在同一个子集中的成员对象都有相似的一些属性.
本实验采用ward 法和欧氏距离进行聚类分析,结果如图5 所示.

图5 聚类分析图
由图5 可知,苦荞芽样品在黑暗和光照条件下的多酚类物质含量差异性显著,此结论与主成分分析结果一致.
2.5 抗氧化性
经测定得光照组/黑暗组自由基清除率(y)与其系列浓度(x)的标准曲线方程分别为:
光照组,
y=25178x+7.9802,R2=0.9987;
黑暗组,
y=20925x+5.9353,R2=0.9965.
由此得,光照组IC50=1.6689 mg/mL,黑暗组IC50=2.1058 mg/mL.说明在第9 d 时,光照组样品的抗氧化活性比黑暗组大.
3 讨 论
3.1 光照对苦荞芽形态指标的影响
相关研究发现,随着发芽时间的增加,芽长和鲜重都将逐渐增加,且黑暗组的芽长和鲜重均显著大于光照组[17-18].本实验结果表明,黑暗组的芽长和鲜重均大于光照组,且差异显著,与前人研究结果一致.宁婵娟[19]等人认为,判断植物性状最直接的一类指标是其形态指标,而其中最主要的就是芽长和根长.所以从黑暗组的芽长和鲜重都大于光照组可以看出,光照不利于苦荞芽的生长和鲜重的增加,而黑暗条件有利于苦荞芽的生长和物质积累.
3.2 光照对苦荞芽抗氧化活性的影响
Tsurunaga 等[16]比较了不同光质条件下苦荞芽抗氧化活性的差异,结果表明适当的光照条件可提高苦荞芽的抗氧化活性,并认为是与花青素含量的增加有关.本试验发现,发芽9 d 光照组样品的抗氧化活性比黑暗组强.苦荞抗氧化活性主要与其中的酚类、花青素、维生素C 等含量密切相关,本实验光照组样品中绿原酸、对香豆酸、荭草素、异荭草素、阿魏酸、牡荆素和芦丁的含量显著大于黑暗组,此可能是苦荞芽抗氧化活性增强的原因之一.保留时间为31.265 min 和35.765 min 并有含量较高的未知成分,且光照条件下其峰面积均显著提高,这可能也是苦荞芽抗氧化活性增加的原因之一,此有待进一步采用液质联用技术及对照品确定其分子结构.
3.3 光照对苦荞芽多酚类物质含量的影响
荞麦发芽后,其多酚类成分含量发生复杂的变化.Li 等[17]研究发现,随着发芽时间的增加,其绿原酸、荭草素、异荭草素、牡荆素、异牡荆素和芦丁的含量逐渐增加.光是影响生物量和次级代谢产物合成的重要因素[20-25],本实验比较了光照条件下与黑暗条件下苦荞芽多酚类物质的含量差异,结果表明光照对苦荞芽多酚类成分的积累有显著的影响.
4 结 论
光照对苦荞芽中多酚类物质及抗氧化活性有重要的影响.相较于黑暗条件,光照条件不利于苦荞芽长和鲜重的增加,但有利于苦荞芽中绿原酸、对香豆酸、荭草素、异荭草素、阿魏酸、牡荆素和芦丁含量的提高,且其抗氧化活性也比黑暗条件下显著增高.
[1]赵钢,唐宇,王安虎.苦荞的成分功能研究与开发应用[J].四川农业大学学报,2001,19(4):297-300.
[2]赵钢,陕方.中国苦荞[M].北京:科学出版社,2009.
[3]Ikeda K.Buckwhe:composition,chemistry,and processing[J].Adv Food Nutr Res,2002,44(2):395-434.
[4]Yang N,Ren G X.Determination of D-chiro-Inositol in tartary buckwheat using high-performance liquid chromatography with an evaporative light-scattering detector[J].J Agric Food Chem,2008,56(3):757-860.
[5]Peng L X,Wang J B,Hu L X,et al.Rapid and simple method for the determination of emodin in tartary buckwheat(Fagopyrum tataricum)by high-performance liquid chromatography coupled to a diode array detector[J].J Agric Food Chem,2013,61(4):854-857.
[6]Pomeranz Y,Robbinas G S.Amino acid composition of buckwheat[J].J Agric Food Chem,1972,20(2):270-274.
[7]Bonafaccia G,Gambelli L,Fabjan N,et al.Trace elements in flour and bran from common and tartary buckwheat[J].Food Chem,2003,83(1):1-5.
[8]Huang Y F,Peng L X,Liu Y,et al.Evaluation of essential and toxic element concentrations in different parts of buckwheat[J].Czech J Food Sci,2013,31(3):249-255.
[9]Jin H M,Wei P.Anti-fatigue properties of tartary buckwheat extracts in mice[J].Int Mol Sci,2011,12(8):4770-4780.
[10]陈鹏,李玉红,刘春梅,等.荞麦芽菜营养成分分析评价[J].园艺学报,2003,30(6):739-741.
[11]孙军涛,任顺,查磊.萌发对荞麦籽粒营养成分的影响研究进展[J].河南农业科学,2008,37(3):17-19.
[12]蒋亚莉,李小平,李晓丹,等.荞麦芽的功能成分及产品开发研究进展[J].农产品加工(学刊),2013,9(10):46-49.
[13]刘金福,李晓雁,孟蕊.苦荞发芽过程中促进黄酮合成的因素初探[J].食品工业科技,2006,28(10):106-108.
[14]Kim H J,Park K J,Lim J H.Metabolomic analysis of phenolic compounds in buckwheat (Fagopyrum esculentum M.)sprouts treated with methyl jasmonate[J].J AgricFood Chem,2011,59(10),5707-5713.
[15]Kim S J,Kawaharada C,Suzuki T,et al.Effect of natural light periods on rutin,free amino acid and vitamin C contents in the sprouts of common (Fagopyrum esculentum Moench)and tartary(F.tataricum Gaertn.)buckwheats[J].Food Sci Technol Res,2006,12,199-205.
[16]Tsurunaga Y,TakahashiT,Katsube T,et al.Effects of UV-B irradiation on the levels of anthocyanin,rutin and radical scavenging activity of buckwheat sprouts[J].Food Chem,2013,141(1):552-556.
[17]Li X H,Thwe A A,Park N I,et al.Accumulation of phenylpropanoids and correlated gene expression during the development of tartary buckwheat sprouts[J].J Agric Food Chem,2012,60:5629-5630.
[18]Li X H,Kim Y B,Uddin M R.Influence of light on the free amino acid content and γ-aminobutyric acid synthesis in brassica juncea Seedlings[J].J Agric Food Chem,2013,61(26):8624-8631.
[19]宁婵娟,吴因良.梨树体内矿质元素分布变化规律[J].山西农业科学,2009,37(7):37-39.
[20]Kawoosa T,Singh H,Kumar A,et al.Light and temperature regulated terpene biosynthesis:hepatoprotective monoterpene picroside accumulation in picrorhiza kurroa[J].Funct Int Gen,2010,10(3):393-404.
[21]Gerhardt K E,Lampi M A,Greenberg B M.The effects of far-red light on plant growth and flavonoid accumulation in Brassica napus in the presence of ultraviolet B radiation[J].Photochem,Photobio,2008,84(6):1445-1454.
[22]Koyama K,Ikeda H,Poudel P R,et al.Light quality affects flavonoid biosynthesis in young berries of cabernet sauvignon grape[J].Phytochemistry,2012,78(1):54-64.
[23]Han L,Dong B C,Yang X J,et al.Effect of light on flavonoids biosynthesis in red rice Rdh[J].Agr Sci China,2009,8(6):746-752.
[24]Wang Y,Gao L P,Shan Y,et al.Influence of shade on flavonoid biosynthesisin tea(Camellia sinensis(L.)O.Kuntze)[J].Sci Hort,2012,141(1):7-16
[25]Vogt T,Ibdah M,Schmidt J,et al.Light-induced betacyanin and flavonol accumulation in bladder cells of Mesembryanthemum crystallinum[J].Phytochemistry,1999,52(4):583-592.

