IKKε影响代谢性疾病的相关机制研究进展
贺 茜,邹秀兰
(三峡大学人民医院 宜昌市第一人民医院 综合内科, 湖北 宜昌 443000)
短篇综述
IKKε影响代谢性疾病的相关机制研究进展
贺 茜,邹秀兰*
(三峡大学人民医院 宜昌市第一人民医院 综合内科, 湖北 宜昌 443000)
IKKε作为新发现的IKK相关激酶,通过介导非经典的NF-κB和IRF信号通路,在调控炎性反应、天然免疫、癌症形成等方面都具有重要的作用。同时,IKKε在代谢性疾病中的作用也逐渐被认识。IKKε与肥胖、2型糖尿病、非酒精性脂肪性肝病等密切相关,其作用机制主要包括促进组织炎性反应、加重胰岛素抵抗、影响能量代谢及脂肪因子分泌等方面。
IKKε;2型糖尿病;非酒精性脂肪肝
IKKε是IKK(inhibitor of nuclear factor kappa-B kinase,IκB激酶)家族中的新成员,虽然其在结构上与传统的IKKα、IKKβ有高度相似性(33%与31%的氨基酸序列同源性),但IKKε主要介导了非经典的核因子-κB (nuclear factor-kappa B, NF-κB)途径。近年来的研究表明,低度的、慢性的炎性反应贯穿于肥胖、2型糖尿病、非酒精性脂肪肝等代谢性疾病的发生发展过程中[1]。包括 JNK (c-Jun N-terminal kinase, 氨基末端激酶)[2]、IKK(inhibitor of NF-κB kinase,IκB激酶)[3]、PKR (double-stranded RNA-dependent protein kinase, 双链RNA依赖的蛋白质激酶)[4]在内的促炎性激酶的活化是炎性反应的重要特征,而IKK介导的NF-κB通路在代谢性疾病中的重要作用逐步被发现。本文就IKKε影响代谢性疾病相关机制的研究进展作一综述,从而为代谢综合征的治疗提供可能靶点。
1 促进组织炎性反应
肥胖、非酒精性脂肪性肝病作为低度的慢性炎性反应,与NF-κB的活化有关。用脂多糖(lipopolysaccharides,LPS)注射高脂饮食喂养的肥胖小鼠发现NF-κB的量显著增加,提示肥胖时NF-κB的活化是呈慢性的非最大量的状态[5]。同时,活化的NF-κB导致脂肪细胞、脂肪组织中巨噬细胞IKKε的高表达[5- 6]。因此,NF-κB是IKKε发挥促炎性作用的关键点。
但是,IKKε与NF-κB的关系较为复杂(图1)。一方面,促炎因子LPS可以通过诱导IKKε的产生,显著刺激NF-κB的激活。然而,过表达的IKKε在直接激活NF-κB的同时,还磷酸化经典的IκB激酶,抑制NF-κB的活化[7]。有些学者认为,这种反馈抑制的现象也可以看作是IKKε的“抗炎作用”[8]。用LPS、白细胞介素 (interleukin,IL)- 1、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等细胞因子刺激IKKε缺乏的小鼠胚胎成纤维细胞,发现NF-κB量没有改变[9],说明抑制后的IKKε对NF-κB的反馈抑制作用也减弱了。另一方面,IKKε在大部分细胞中的表达又受NF-κB调控:IKKε基因的启动子区含有κB结合位点,活化后的NF-κB,进入细胞核中激活IKKε的转录和表达。因此,NF-κB与IKKε间的相互作用放大炎性信号,促使重要糖脂代谢组织如肝脏、肌肉及脂肪等产生大量的炎性细胞因子。
肥胖小鼠脂肪组织中巨噬细胞浸润增加,伴随TNF-α、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP- 1)、整合素-αX (integrin alpha-X,ITGAX)、表皮生长因子样激素受体- 1(EMR1)等炎性基因表达增加[6],同时脂肪细胞、MGL1-F4/80+巨噬细胞的IKKε表达增高[5]。当用氨来呫诺特异性抑制IKKε活性后,上述炎性指标明显减低,伴随血清中抗炎性的IL- 10的表达增加[6]。此外,IKKε可通过增加JNK的磷酸化促进组织炎性反应发生,但是JNK信号通路并不是IKKε的直接作用靶点。在体外实验中,高表达IKKε并不能增加TNF-α诱导下的3T3- L1脂肪细胞JNK的磷酸化[5]。
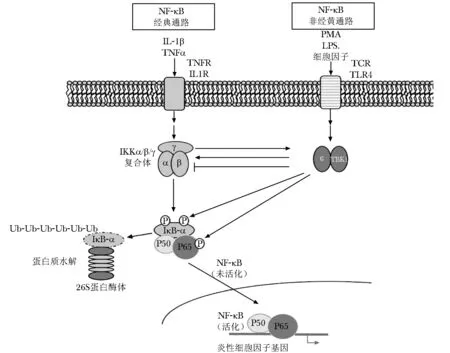
图1 IKKε介导的NF-κB信号通路[7]
在NAFLD的发病机制中,肝脏中的FFA通过激活IKKβ活化了NF-κB的表达[10]。一方面,NF-κB可以激活IKKε的表达。高脂饮食能促进炎性反应的发生,同时增加肝脏中IKKε的表达[6],而当在高脂饮食中加用可减少炎性反应的n- 3多不饱和脂肪酸(EPA、DHA)后,肝脏中IKKε的表达减少了,提示肝脏中IKKε的高表达是由于炎性反应的激活。同时,当在培养的脂肪细胞中加入IKKβ的抑制剂后,在TNF-α的刺激下,IKKε的表达减少,说明IKKε是通过经典NF-κB通路激活的。另一方面,IKKε又促进了肝脏的炎性反应。并且,IKKε对肝脏炎性反应的影响可能是通过直接的、细胞自主性的方式进行调控的。当高表达H2- 35肝癌细胞的IKKε基因时,细胞中CCL5、TNF-α、IP- 10和iNOS的表达增加;但将失活的IKKε转染细胞后上述指标呈反向变化[5]。
2 加重胰岛素抵抗
肥胖是引起胰岛素抵抗的最重要原因。肥胖时脂肪细胞分泌趋化因子使得脂肪组织中的M1巨噬细胞增多[11],活化的巨噬细胞释放细胞因子(如TNF-α、IL- 1β等)通过旁分泌减弱邻近细胞对胰岛素的敏感性,导致脂解作用增强,释放出游离脂肪酸[12]。肥胖时血中游离脂肪酸浓度增加,伴随有脂肪因子的改变(脂联素减少、抵抗素增加),同样增加了胰岛素抵抗的程度[13]。当用氨来呫诺抑制IKKε活性后,可减少脂肪组织的含量[6],脂肪组织中巨噬细胞数量、TNF-α的表达也减少[5],空腹胰岛素水平、糖耐量试验结果都得到了改善。因此,IKKε可通过促进脂肪组织蓄积间接导致胰岛素抵抗的发生。
另一方面,IKKε直接作用于胰岛素信号通路影响肝脏、脂肪组织的胰岛素敏感性。肥胖小鼠脂肪细胞表面与胰岛素作用相关的葡萄糖转运蛋白- 4(glucose transporter type 4,GLUT4)和过氧化物酶增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)-γ的表达减少,而抑制IKKε活性后上述两种蛋白表达增加[6]。当在3T3-L1脂肪细胞中高表达IKKε后,胰岛素刺激后脂肪细胞对糖的摄取减少了50%[5],提示IKKε对于胰岛素敏感性的负调节是一种直接的细胞自主性的调节。胰岛素通过胰岛素受体(insulin receptor,IR)作用于胰岛素受体底物(insulin receptor substrate,IRS),使Akt磷酸化,激活胰岛素信号通路[14]。肥胖时肝脏及脂肪组织表现为对胰岛素刺激后磷酸化Akt减少,而IKKε敲除的小鼠在注射胰岛素后,肝脏及脂肪组织中磷酸化Akt增加,伴随IRS- 1的水平上升。
再者,IKKε可通过“脂肪组织-肝脏轴”增加肝脏糖异生。当低表达IKKε后,高浓度的cAMP促进了脂肪细胞中IL- 6的表达,而脂肪组织中大量的IL- 6进一步刺激肝脏Stat3的磷酸化,最终抑制了参与肝脏糖异生基因的表达[15]。同时,IKKε敲除的肥胖小鼠肝脏中参与糖代谢的丙酮酸脱氢酶激酶4的表达减少,葡萄糖激酶表达增多[5],这两种酶的共同作用使得肝脏糖酵解增加,更好地平衡与丙酮酸作用下糖异生的刺激,维持血糖稳态。
3 影响能量代谢
脂质是机体3大营养物质之一,它通过氧化合成与分解作用参与了机体能量代谢的过程。脂肪、肝脏是脂质代谢的重要场所,而脂质代谢异常可导致肥胖、非酒精性脂肪肝等代谢性疾病的发生。最近的研究表明,IKKε可通过影响肝脏、脂肪组织中的脂质代谢参与能量调控。
肥胖小鼠肝脏三酰甘油含量、肝脏脂肪变性程度比正常小鼠要严重[5],同时,肝脏中参与脂质合成的脂肪酸合成酶(fatty acid synthase,FASN)、苹果酸酶- 1(malic enzyme 1,ME 1)、乙酰辅酶A羧化酶α(acetyl-CoA carboxylase alpha,ACACA)、硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)的基因表达增多[6]。但将IKKε低表达后,上述参与脂质合成的基因表达减少[6],同时小鼠体质量、肝重、肝脏三酰甘油含量及脂肪变性程度均减轻,伴随有空腹血游离脂肪酸、胆固醇浓度降低[5]。
其次,IKKε可调控棕色脂肪组织与白色脂肪组织间的转化。高脂饮食增加了脂肪组织三酰甘油的蓄积和Cidea(cell death-inducing DNA fragmentation factor alpha like effector A,诱导细胞死亡DNA片段化因子α样效应因子A)、Prdm16(PR domain containing 16,PR域包含蛋白16)、PPARγc1a的表达减少,同时诱导了棕色脂肪组织向白色脂肪组织转化,而特异性抑制IKKε可以逆转脂肪组织间的转化,并使得参与脂质代谢的基因长链脂肪酸延长酶3(elongation of very long chain fatty acids protein 3,Elovl3)表达增加[6]。
再者,解偶联蛋白1(uncoupling protein 1,Ucp1)是IKKε调控能量代谢的关键点。用氨来呫诺特异性的抑制小鼠IKKε后发现其体质量明显减轻,但是饮食摄入量却并不改变[6],甚至对IKKε敲除后具有更高的日摄入量[5]。在进一步的研究中发现,高脂喂养的IKKε敲除鼠白色脂肪组织解偶联蛋白1表达明显增加,伴随耗氧量和体温增加[5]。而Ucp1具有使线粒体氧化磷酸化解偶联的作用,减少了ATP生成,增加了能量消耗和热能的产生[16]。同时,体外实验中用氨来呫诺处理高脂饮食诱导的小鼠棕色脂肪组织可以发现,脂质氧化率及耗氧量均显著增加,说明IKKε对于机体的能量代谢也可以是一种直接效应[6]。
4 造成脂肪因子分泌紊乱
脂肪组织是分泌脂肪因子的重要场所,包括脂联素、瘦素和抵抗素等在内的脂肪因子在肥胖、NAFLD和T2DM的病理生理过程中都扮演了重要角色。在最近的研究中发现IKKε可影响脂肪因子的分泌,这可能是IKKε影响肥胖、NAFLD和T2DM发生发展的又一原因。
低表达IKKε使血清及脂肪组织中脂联素浓度升高,伴随有调控脂联素的PPARγ和PPARγ下游的CAP (c2cb1 associated protein, c2cb1相关蛋白)、CD36、GLUT4的表达增加,同时旨在增加PPARγ转录活性的LPIN 1的表达也增加[5]。脂联素作为唯一由脂肪细胞分泌的蛋白,可通过减少肝脏糖异生,增加肌肉中脂肪酸氧化从而增加机体胰岛素敏感性,达到减重效果[17]。用氨来呫诺喂养小鼠后瘦素水平降低了80%[6],而瘦素在降低机体饮食摄入量,增加机体能量消耗的同时,也可通过下调前胰岛素基因的转录、抑制胰岛素分泌导致胰岛素抵抗的发生[18]。
脂肪因子在NAFLD的发病中也起到了作用。FFA作为肝脏中三酰甘油的合成原料,在NAFLD中约有60%的FFA来源于脂肪组织。而高表达IKKε可增加血中游离脂肪酸的含量[5]。同时,高表达的IKKε可降低血清中脂联素水平[5]。脂联素具有抗纤维化的作用,在非酒精性脂肪肝的发生发展过程中起重要作用[19]。
5 问题与展望
IKKε能够促进代谢性疾病的发生发展,特异性的靶向基因敲除IKKε在动物实验中证实了其保护性的作用[5]。另一方面,IKKε通过激活IRF(interferon regulatory factor)- 3、IRF- 7介导的固有免疫产生的1型干扰素α、β,在抗病毒的信号通路中具有重要作用。如何平衡这两方面的作用一直是IKKε开展于临床研究的难点。氨来呫诺(Amlexanox)是一种在国外被用于治疗哮喘[20]和口腔溃疡[21]的临床药物,将可能成为人类关于IKKε开展临床研究的突破点。氨来呫诺在动物实验中已证实了对于肥胖、非酒精性脂肪肝、胰岛素抵抗的保护性作用[6, 15],同时,其临床药用的安全性将可能成为基于IKKε靶向治疗代谢性疾病的首选药物。
[1] Chen L, Chen R. Mechanisms linking inflammation to insulin resistance[J]. Int J Endocrinol, 2015, 2015:508409. doi: 10.1155/2015/508409.
[2] Han MS, Jung DY, Morel C,etal. JNK expression by macrophages promotes obesity-induced insulin resistance and inflammation[J]. Science, 2013, 339: 218- 222.
[3] Verhelst K, Verstrepen L, Carpentier I,etal. IkappaB kinase epsilon (IKKepsilon): a therapeutic target in inflammation and cancer[J]. Biochem Pharmacol, 2013, 85: 873- 880.
[4] Nakamura T, Kunz RC, Zhang C,etal. A critical role for PKR complexes with TRBP in Immunometabolic regulation and eIF2alpha phosphorylation in obesity[J]. Cell Rep, 2015, 11: 295- 307.
[5] Chiang SH, Bazuine M, Lumeng CN,etal. The protein kinase IKKepsilon regulates energy balance in obese mice[J]. Cell, 2009, 138: 961- 975.
[6] Reilly SM, Chiang SH, Decker SJ,etal. An inhibitor of the protein kinases TBK1 and IKK-varepsilon improves obesity-related metabolic dysfunctions in mice[J]. Nat Med, 2013, 19: 313- 321.
[7] Niederberger E, Moser CV, Kynast KL,etal. The non-canonical IkappaB kinases IKKepsilon and TBK1 as potential targets for the development of novel therapeutic drugs[J]. Curr Mol Med, 2013, 13: 1089- 1097.
[8] Hinz M, Scheidereit C. The IkappaB kinase complex in NF-kappaB regulation and beyond[J]. EMBO Rep, 2014, 15: 46- 61.
[9] Kravchenko VV, Mathison JC, Schwamborn K,etal. IKKi/IKKepsilon plays a key role in integrating signals induced by pro-inflammatory stimuli[J]. J Biol Chem, 2003, 278: 26612- 26619.
[10] Fabbrini E, Magkos F. Hepatic Steatosis as a Marker of Metabolic Dysfunction[J]. Nutrients, 2015, 7: 4995- 5019.
[11] Oliveira AG, Araujo TG, Carvalho BM,etal. Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in diet-induced obese rats[J]. Obesity (Silver Spring), 2013, 21: 2545- 2556.
[12] Ye J. Mechanisms of insulin resistance in obesity[J]. Front Med, 2013, 7: 14- 24.
[13] Lee BC, Lee J. Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance[J]. Biochim Biophys Acta, 2014, 1842: 446- 462.
[14] Saltiel AR. Insulin resistance in the defense against obesity[J]. Cell Metab, 2012, 15: 798- 804.
[15] Reilly SM, Ahmadian M, Zamarron BF,etal. A subcutaneous adipose tissue-liver signalling axis controls hepatic gluconeogenesis[J]. Nat Commun, 2015, 6: 6047. doi: 10.1038/ncomms7047.
[16] Poher AL, Altirriba J, Veyrat-Durebex C,etal. Brown adipose tissue activity as a target for the treatment of obesity/insulin resistance[J]. Front Physiol, 2015, 6: 4. doi: 10.3389/fphys.2015.00004.
[17] Stojsavljevic S, Gomercic Palcic M, Virovic Jukic L,etal. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2014, 20: 18070- 18091.
[18] Zuo H, Shi Z, Yuan B,etal. Association between serum leptin concentrations and insulin resistance: a population-based study from China[J]. PLoS One, 2013, 8: e54615.
[19] Handy JA, Saxena NK, Fu P,etal. Adiponectin activation of AMPK disrupts leptin-mediated hepatic fibrosis via suppressors of cytokine signaling (SOCS- 3)[J]. J Cell Biochem, 2010, 110: 1195- 1207.
[20] Makino H, Saijo T, Ashida Y,etal. Mechanism of action of an antiallergic agent, amlexanox (AA- 673), in inhibiting histamine release from mast cells. Acceleration of cAMP generation and inhibition of phosphodiesterase[J]. Int Arch Allergy Appl Immunol, 1987, 82: 66- 71.
[21] Bhat S, Sujatha D. A clinical evaluation of 5% amlexanox oral paste in the treatment of minor recurrent aphthous ulcers and comparison with the placebo paste: a randomized, vehicle controlled, parallel, single center clinical trial[J]. Indian J Dent Res, 2013, 24: 593- 598.
Research progress in mechanism of IKKε promoting the development of metabolic diseases
HE Qian, ZOU Xiu-lan*
(Dept. of General Medicine,the First People’s Hospital, People’s Hospital of China Three Gorges University, Yichang 443000, China)
IKKε is a new IκB kinase(IKK)-related kinases with plays a vital role in regulating inflammation, innate immune response and oncogenesis through the activation of non-canonical NF-κB and IRF signaling cascades. Meanwhile, the role involved in the pathophysiology of metabolic diseases have been found. IKKε have been closely linked to obesity, type 2 diabetes(T2DM)and non-alcoholic fatty liver disease(NAFLD)through the mechanisms including producing inflammation, aggravating insulin resistance and effecting energy expenditure as well as andipokines secretion.
IKKε; type 2 diabetes mellitus; non-alcoholic fatty liver disease
2015- 07- 13
2015- 10- 23
三峡大学培优基金(2015PY057)
1001-6325(2015)12-1686-05
R589
A
*通信作者(corresponding author):zouxl61@126.com

