树突状细胞在无精子症睾丸组织中的免疫表型分析*
郑文忠 陈剑波 张恩溥 刘 冲 李明华 段永刚 桂耀庭 李贤新** . 北京大学深圳医院泌尿外科, 广东省男性生殖与遗传实验室(深圳 5806). 北京大学深圳医院妇产科; . 深圳市第二人民医院(深圳大学第一附属医院)生殖医学中心
·论 著·
树突状细胞在无精子症睾丸组织中的免疫表型分析*
郑文忠1陈剑波1张恩溥1刘 冲2李明华1段永刚3桂耀庭1李贤新1**1. 北京大学深圳医院泌尿外科, 广东省男性生殖与遗传实验室(深圳 518036)
2. 北京大学深圳医院妇产科; 3. 深圳市第二人民医院(深圳大学第一附属医院)生殖医学中心
目的 探讨树突状细胞(Dendritic cell, DC)在非梗阻性无精子症患者睾丸中的免疫表型及其分子机制。方法 采用免疫组织化学染色法检测10例正常人及25例无精子症患者睾丸中CD3,CD1a,CD11c,CD123,DC-SIGN (DC-speci c ICAM-grabbing non-integrin),CD83,HLA-DR表达水平,并进行体视学分析。结果 正常组及无精子症组均有CD1a、CD11c、DC-SIGN、HLA-DR表达,并主要分布于睾丸间质。无精子症组CD1a、CD11c、DCSIGN、HLA-DR表达水平较正常组显著增高,差异有显著性(P<0.05)。正常组无CD123及CD83表达,无精子症组CD123、CD83高表达。结论 非梗阻性无精子症患者睾丸中CD1a+朗格汉斯细胞(Langerhans cell,LC)、DCSIGN+间质型DC(Stromal DC)、CD123+浆细胞样DC(Plasmacytoid DC,pDC)及CD11c+髓样DC(Myeloid DC,mDC)表达水平显著增高并趋向分化成熟,提示DC在无精子症发生发展过程中可能起重要作用。
无精子症; 树突细胞; 免疫表型分型
无精子症是男性不育常见原因中最为严重的一种类型,男性不育中约占10%[1]。近期研究表明,睾丸炎症性疾病是引起精子发生异常的主要因素之一[2-4]。其致病机制可能为炎性细胞浸润及诸多细胞因子超高水平释放,导致血-睾屏障受损,损害生精上皮导致精子发生异常[5]。前期研究发现,树突状细胞(Dendritic cell, DC)可通过诱导Th17细胞(T helper17 cell)极化,产生白细胞介素17 (interleukin-17, IL-17)等细胞因子损伤生精上皮,进而引起无精子症[5]。本实验通过免疫组织化学技术检测不同DC亚群[朗格汉斯细胞(Langerhans cell,LC),间质型DC(Stromal DC, sDC),浆细胞样DC (Plasmacytoid DC, pDC)及髓样DC(Myeloid DC,mDC)]在正常及无精子症患者睾丸组织中的分布及表达,并探讨DC在非梗阻性无精子症中的作用。
材料与方法
一、标本收集制备
筛选符合研究标准无精子症患者睾丸病理标本共25例,正常睾丸标本共10例,年龄30~55岁,登记病例资料(感染史、用药史、其他治疗史、配偶情况和生育史等)、筛选标准和诊断标准,填写知情同意书。正常睾丸标本选自2009年至2012年我院泌尿外科因前列腺癌而接受睾丸去势手术治疗的患者,并经2名病理科医师同时诊断为正常睾丸组织。无精子症睾丸病理标本选自2011年至2014年我院泌尿外科因3次精液检查中未见精子而诊断为无精子症而接受睾丸活检者,经CD3免疫组织化学染色、精浆中性α葡萄糖苷酶测定及2名病理科医师同时确定其为炎性非梗阻性无精子症。标本均经4%多聚甲醛固定处理并由常规石蜡包埋备用。
二、主要试剂及仪器
CD3鼠抗人单抗(福州迈新公司);CD1a 鼠抗人多抗(Abcam,UK);CD11c鼠抗人多抗(武汉三鹰公司);CD123鼠抗人单抗(福州迈新公司);DC-SIGN兔抗人多抗(Abcam,UK);CD83鼠抗人多抗(Abcam,UK);HLA-DR鼠抗人单抗(Abcam,UK),UltraSensitiveTM SP(鼠/兔)试剂盒(福州迈新公司),DAB(福州迈新公司),莱卡显微镜DM 4000 b。
三、免疫组织化学染色(二步法)
经石蜡包埋标本连续切片,片厚为5μm,烘干处理后备用。经二甲苯脱蜡,梯度酒精水化处理。0.3%过氧化氢孵育20min,pH 10.0 Tris-EDTA微波修复20min,自然冷却至室温。山羊血清室温孵育60min,一抗4℃过夜,二抗37℃温箱孵育45min,DAB(棕黄)显示,经苏木紫复染细胞核,水化,透明,中性树胶封片。显微镜下观察染色结果。阴性对照用相应IgG替代一抗。
四、统计学方法
对免疫组化图像采集者实施盲法,每个标本病变典型处采集10个高倍视野(HPF×200)。安排2名未参与实验设计人员计数每相同高倍视野中阳性细胞数,并相互确认结果间差异无显著性(P>0.05)。另安排1名未参与实验设计人员统计分析实验结果,方法为以10个高倍视野下阳性细胞均数代表该样本中DC特异性标志物表达水平。正常组与无精子症组采用样本均数间 t 检验进行分析,每组实验数据以±s表示,统计软件为R 3.0.1,P<0.05为差异有显著性。
结 果
一、CD1a在正常及无精子症患者睾丸中的分布及表达
正常及无精子症患者CD1a+ LC主要分布于睾丸间质,且无精子症患者CD1a+ LC显著增加(图 1)。正常组及无精子症组中CD1a表达水平分别为(11.18±4.73)个/HPF、(103.56±26.12)个/HPF。组间差异有显著性(P<0.01)。
二、CD11c在正常及无精子症患者睾丸中的分布及表达
正常及无精子症患者CD11c+ mDC主要分布于睾丸间质,且无精子症患者CD11c+ mDC显著增加并向生精小管腔内浸润(图1)。正常组、无精子症组中CD11c表达水平分别为(15.22±9.71)、(202.6±28)个/HPF。组间差异有显著性(P<0.01)。
三、DC-SIGN在正常及无精子症患者睾丸中的分布及表达
正常及无精子症患者DC-SIGN+ DC主要分布于睾丸间质,且无精子症患者DC-SIGN+ DC显著增加并向生精小管腔内浸润(图1)。正常组、无精子症组中DCSIGN表达水平分别为(16.79±3.79)、(86.67±17.57)个/HPF。组间差异有显著性(P<0.01)。
四、CD123在正常及无精子症患者睾丸中的分布及表达
正常睾丸无CD123表达,无精子症睾丸间质可见大量CD123+ pDC浸润,其表达水平为(87.64±21.89)个/HPF(图2)。
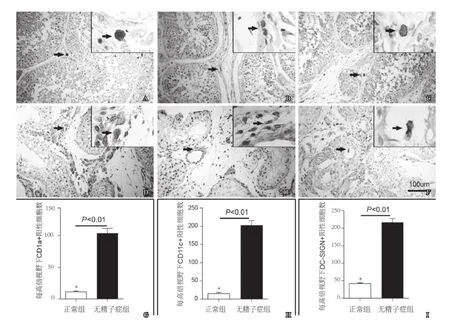
图1 免疫组化分析CD1a、CD11c及DC-SIGN在睾丸组织中的表达(×200, ×400)A: 正常睾丸中CD1a的表达; B: 无精子症患者睾丸中CD1a的表达; C: 两者间CD1a阳性细胞数的比较; D: 正常睾丸中CD11c的表达; E: 无精子症患者睾丸中CD11c的表达; F: 两者间CD11c阳性细胞数的比较; G: 正常睾丸中DC-SIGN的表达; H: 无精子症患者睾丸中DC-SIGN的表达; I:两者间DC-SIGN阳性细胞数的比较; 箭头指向为阳性细胞

图2 免疫组化分析CD123及CD83在睾丸组织中的表达(×200, ×400)A: 正常睾丸中无CD123的表达; B: 无精子症患者睾丸中CD123的表达; C: 正常睾丸中无CD83表达; D: 无精子症患者睾丸中CD83的表达;箭头指向为阳性细胞
五、 CD83及HLA-DR在正常及无精子症患者睾丸中的分布及表达
CD83常为DC分化成熟的标志,正常睾丸组织未见CD83表达,无精子症睾丸间质中可见大量CD83+ DC浸润,其表达水平为(82.09±23.78)个/HPF(图2)。HLA-DR为主要组织相容性复合物(MHC)Ⅱ类分子,在DC及巨噬细胞中均有表达,并在炎症DC中高表达。正常人及无精子症患者睾丸均可见HLA-DR表达, 正常睾丸可见HLA-DR+细胞分布于间质及围绕生精小管基底部呈环形分布。无精子症患者睾丸间质中可见大量HLA-DR+细胞浸润,围绕生精小管基底部呈环形分布的HLA-DR+细胞显著增加(图3)。在正常组、无精子症组中HLA-DR表达水平分别为(42.18±4.35)、(103.24±24.30)个/HPF。组间差异有显著性(P<0.01)。
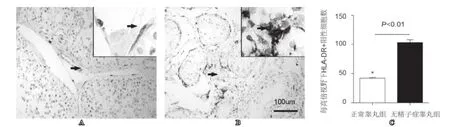
图3 免疫组化分析HLA-DR在睾丸中的表达(×200,×400)A: 正常睾丸中HLA-DR的表达情况; B: 无精子症患者睾丸中HLA-DR的表达; C: 两者间HLA-DR阳性细胞数的比较; 箭头指向为阳性细胞
讨 论
无精子症病因复杂,可将其分为梗阻性无精子症及非梗阻性无精子症。梗阻性无精子症系指精子排出受阻,患者睾丸生精功能正常,而远侧精子排出管道受阻。非梗阻性无精子症系指睾丸生精功能异常,无法产生精子。近期研究表明免疫因素在非梗阻性无精子症致病过程中起重要作用[4,5]。本实验采用免疫组织化学方法分析正常及无精子症患者睾丸组织中的DC分布,发现DC在无精子症患者睾丸中显著增加,提示DC在无精子症患者睾丸免疫损伤发生发展过程中可能起关键作用。
DC是抗原提呈功能最强的一种抗原提呈细胞,为连接固有免疫及适应性免疫的“桥梁”,是机体产生适应性T淋巴细胞免疫应答的始动者[6-8]。根据其来源、分布、分化状态及功能可分为:mDC、pDC、LC、间质性DC、成熟性DC、未成熟性DC、耐受性DC及炎症性DC[9]。
CD1a是一类呈递脂类抗原的分子,是LC特征性标记物。LC主要分布于表皮组织中,在对抗病原微生物侵入皮肤及免疫监视肿瘤细胞中起重要作用[10]。本研究发现正常及无精子症患者睾丸中均有CD1a+ LC表达,且无精子症患者睾丸组织中CD1a+ LC显著增加。推测其作用机制可能为睾丸炎引起细胞坏死凋亡,募集大量LC浸润病灶组织,并通过向T淋巴细胞提呈抗原表位,进而对睾丸产生免疫损伤。本项目组前期研究发现,无精子症患者睾丸中mDC较正常人显著增高,并可通过释放白细胞介素23(interleukin-23, IL-23)诱导幼稚型T淋巴细胞向Th17细胞分化,进而打破Th17细胞与调节性T细胞(Regulatory cell,Treg )间的免疫平衡,Th17细胞通过产生IL-17等细胞因子进而对生精子细胞产生免疫损伤[5]。与前期研究一致,本研究发现无精子症患者睾丸中CD11c+ mDC数量显著增加并向生精小管腔内浸润,表明CD11c+ mDC在启动Th17细胞产生免疫杀伤中可能发挥关键作用。
DC-SIGN(DC-specific ICAM-grabbing nonintegrin)是Ⅱ型跨膜受体,为DC表面C型凝集素受体(CLRs)的主要成员,通过识别HIV包膜蛋白(gp120)捕获HIV病毒,并将病毒传递给T淋巴细胞[11]。近期研究发现睾丸间质少量分布DC-SIGN+ DC,并在HIV持续感染中发挥重要作用[12]。DCSIGN+ DC在慢性睾丸炎及无精子症中的作用至今仍无相关报道,本实验发现无精子症患者睾丸组织大量浸润DC-SIGN+ DC,部分DC-SIGN+ DC可穿透血-睾丸屏障,并向生精小管及其腔内扩散。DC-SIGN为间质型DC的特征性标记,常在成熟型DC中表达[13,14]。实验结果提示炎症后期DC-SIGN+ DC可能在睾丸免疫损伤中发挥重要作用。
正常条件下,pDC主要分布于外周血及次级淋巴器官。pDC对外源性抗原摄取能力较弱,主要通过其细胞表面的TLR7(Toll-like receptors 7)及TLR9提呈内源性抗原,并通过分泌I型干扰素活化自然杀伤细胞(Nature killer cell,NK)、CD8+T及CD4+T细胞,进而发挥免疫防御作用。睾丸作为机体免疫豁免区,其间有多种免疫细胞,而至今仍无pDC在睾丸中的相关报道。本实验未见正常睾丸表达CD123+ pDC,而无精子症患者睾丸组织可见大量CD123+ pDC炎性浸润,说明pDC在无精子症发生发展过程中可能发挥重要的作用。
CD83常视为DC分化成熟的标志[15]。本研究未见其在正常睾丸组织中表达,而无精子症睾丸间质中可见大量CD83+ DC浸润。HLA-DR常在炎性DC中高表达,我们研究发现正常睾丸大部分HLA-DR+细胞围绕生精小管基底部呈环形分布,无精子症患者睾丸间质中可见大量HLA-DR+细胞浸润。CD83+ DC及HLA-DR+ DC在无精子症患者睾丸中的高表达,说明炎症状态下,睾丸DC逐渐分化成熟,并打破耐受性DC与炎症性DC之间的免疫平衡,炎症性DC可进一步激活T淋巴产生免疫损伤作用[5,16]。
综上所述,通过分析正常睾丸及无精子症睾丸组织中各DC亚群的改变,本实验发现正常睾丸组织中DC主要表现为未成熟型,说明其可能在维系睾丸免疫微环境及免疫调节中发挥重要作用。在无精子症患者睾丸组织中,LC、sDC、mDC及pDC表达水平显著增高,且主要表现为成熟型的炎性DC,提示在非梗阻性无精子症发生发展过程中DC通过大量吞噬坏死及凋亡细胞并逐渐分化成熟,成熟DC可募集大量DC浸润并促进炎症的发展,进而对精子产生免疫损伤。本研究仅通过免疫组织化学染色检测DC在非梗阻性无精子症中的免疫表型特征,进一步需通过Western blot及PCR验证其在非梗阻性无精子症中的表达差异,并将深入探讨DC在非梗阻性无精子症中的分子机制。
1 Zopfgen A, Priem F, Sudhoff F, et al. Relationship between semen quality and the seminal plasma components carnitine, alpha-glucosidase, fructose, citrate and granulocyte elastase in infertile men compared with a normal population. Hum Reprod 2000; 15(4): 840-845
2 Weidner W, Krause W, Ludwig M. Relevance of male accessory gland infection for subsequent fertility with special focus on prostatitis. Hum Reprod Update 1999;5(5): 421-432
3 Haidl G, Allam JP, Schuppe HC. Chronic epididymitis: impact on semen parameters and therapeutic options. Andrologia 2008; 40(2): 92-96
4 Schuppe HC, Meinhardt A, Allam JP, et al. Chronic orchitis: a neglected cause of male infertility? Andrologia 2008; 40(2): 84-91
5 Duan YG, Yu CF, Novak N, et al. Immunodeviation towards a Th17 immune response associated with testicular damage in azoospermic men. Int J Androl 2011;34(6 Pt 2): e536-545
6 Steinman RM, Cohn ZA. Identi cation of a novel cell type in peripheral lymphoid organs of mice. I. Morphology,quantitation, tissue distribution. J Exp Med 1973; 137(5): 1142-1162
7 Steinman RM. Decisions about dendritic cells: past,present, and future. Ann Rev Immunol 2012; 30: 1-22
8 Novak N, Koch S, Allam JP, et al. Dendritic cells: bridging innate and adaptive immunity in atopic dermatitis. J Allergy Clin Immunol 2010; 125(1): 50-59
9 段永刚, 秦晓峰, 蔡志明, 等. 树突状细胞在男性生殖系统中的作用. 医学分子生物学杂志 2013; 10(4): 238-243
10 Yu SH, Bordeaux JS, Baron ED. The immune system and skin cancer. Adv Exp Med Biol 2014; 810: 182-191
11 de Witte L, Nabatov A, Geijtenbeek TB. Distinct roles for DC-SIGN+-dendritic cells and Langerhans cells in HIV-1 transmission. Trends Mol Med 2008; 14(1): 12-19
12 Shehu-Xhilaga M, Kent S, Batten J, et al. The testis and epididymis are productively infected by SIV and SHIV in juvenile macaques during the post-acute stage of infection. Retrovirology 2007;4:7.
13 Geijtenbeek TB, Torensma R, van Vliet SJ, et al. Identi cation of DC-SIGN, a novel dendritic cell-speci c ICAM-3 receptor that supports primary immune responses. Cell 2000; 100(5): 575-585
14 Steinman RM. DC-SIGN: a guide to some mysteries of dendritic cells. Cell 2000; 100(5): 491-49415 Zhou LJ, Tedder TF. Human blood dendritic cells selectively express CD83, a member of the immunoglobulin superfamily. J Immunol 1995; 154(8): 3821-3835
16 Ohman J, Magnusson B, Telemo E, et al. Langerhans cells and T cells sense cell dysplasia in oral leukoplakias and oral squamous cell carcinomas--evidence for immunosurveillance. Scand J Immunol 2012; 76(1): 39-48
(2015-07-01收稿)
Immunophenotype analysis of dendritic cells in testicular tissues of azoospermia patients*
Zheng Wenzhong1, Chen Jianbo1, Zhang Enpu1, Liu Chong2,Li Minghua1, Duan Yonggang3, Gui Yaoting1, Li Xianxin1**1. Department of Urology, Peking University Shenzhen Hospital; Guangdong Key Labrotory of Male Reproductive and
Genetic, Shenzhen Guangdong 518036, China;
2. Department of Gynaecology and Obstetrics, Peking University Shenzhen Hospital; 3. Reproductive Medicine Center,Shenzhen Second People's Hospital (The First Af liated Hospital of Shenzhen University)
Objective To investigate the immunophenotype of dendritic cells (DC) in testicular tissues of azoospermia patients and explore its roles in development of azoospermia. Methods The expressions of DC specific marker CD1a,CD11c, CD123, DC-SIGN(DC-speci c ICAM-grabbing non-integrin), CD83, HLA-DR were comparatively analyzed in 25 testicular tissues of azoospermia patients and 10 normal testicular tissues. Results The expressions of CD1a+, CD11c+, DCSIGN+ and HLA-DR+ DC were found in all normal and azoospermia testicular tissues, and most of them were located in interstitial tissue of testis. The number of DC with CD1a+, CD11c+, DC-SIGN+ and HLA-DR+ were signi cantly increased in testicular tissues of azoospermia patients as compared with that of normal testicular tissues. No expression of CD123+ and CD83+ DC was found in normal testicular tissues, but, CD83+ mature DC and CD123+ Plasmacytoid DC (pDC)were signi cantly increased in testicular tissues of azoospermia and there was a statistical signi cance among these groups(P<0.05). Conclusion CD1a+ Langerhans cells (LCs), DC-SIGN+ Stromal DC, CD123+ pDCs and CD11c+ Myeloid DC (mDC) were signi cantly increased and associated with the development of a mature phenotype in testicular tissues of azoospermia, indicating that these DC subtypes may play an important role in the development of azoospermia.
azoospermia; Dendritic Cells; immunophenotyping
10.3969/j.issn.1008-0848.2015.08.001
R 698.2
资助: 国家自然科学基金(No.No.81572513)、广东省自然科学基金(S2012010008200)、深圳市科技创新委员会基础研究计划(JCYJ20150403091443334)
**通信作者, E-mail: xianxinli@163.com

