地衣芽孢杆菌的生长及对养殖水体中残饵的降解特性
杭小英 周冬仁 罗毅志等
摘要:从自然养殖池塘中筛选获得了1株能有效抑制水产养殖常见致病菌的功能菌株DSY002-2011,经鉴定为地衣芽孢杆菌。通过人工模拟养殖水体中残饵浓度,研究地衣芽孢杆菌对饲料中蛋白质、淀粉的降解特性。结果表明,分离株DSY002-2011在水温28 ℃、pH值7的1%饲料培养液中培养24 h后,对饲料蛋白质、淀粉的降解率分别达到58.8%、62.9%,说明在养殖水体中添加地衣芽孢杆菌对水体残余饵料的降解是非常有效的。地衣芽孢杆菌降解蛋白质、淀粉的合适条件为pH值6~7、盐度0~1.0%。
关键词:地衣芽孢杆菌;降解;盐度;pH值
中图分类号: X714 文献标志码: A
文章编号:1002-1302(2015)03-0206-02
在高密度、集约化的水产养殖过程中,由于缺乏科学规范的养殖管理,养殖户一味追求高产量往往会过度投饵,导致养殖水体中积存了大量残余饵料,加上养殖动物的排泄物,使得养殖水体中的有机物浓度增加,水质环境恶化,从而诱发各类水产疾病。微生态制剂的调控技术已成为解决养殖水体污染病害问题的有效手段之一[1-2]。以往研究表明,硝化细菌[3]、光合细菌[4]、芽孢杆菌[5-6]等有益菌在减少病害、净化水质和促进动物生长等方面均有显著效果,但对降解水体残余饵料蛋白质、淀粉的功能研究报道较少。本试验用从自然养殖池塘筛选到的1株地衣芽孢杆菌DSY002-2011,对其饵料蛋白质、淀粉的降解特性进行研究,获得其降解规律,为养殖水体的饲料残饵去除探求一种更为有效的办法,也为今后在水产养殖中科学使用地衣芽孢杆菌制剂提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 地衣芽孢杆菌(Bacillus licheniformi)DSY002-2011由笔者所在实验室分离、鉴定并保存。
1.1.2 饲料 市售鳖配合饲料,由优质白鱼粉、淀粉、酵母粉、维生素、矿物质等组成。
1.1.3 药品与试剂 菌株生长及试验所需药品与试剂:营养肉汤培养基、0.85%无菌生理盐水、氯化钠、蒸馏水、氢氧化钠溶液、稀盐酸等。
淀粉测定所需药品与试剂:碘、碘化钾、硝酸钙[Ca(NO3)2·H2O]、可溶性淀粉。
蛋白质测定所需药品与试剂:硫酸铜(CuSO4·5H2O)、硫酸钾、硫酸、20 g/L硼酸溶液、混合指示液(1份1 g/L甲基红乙醇溶液与5份1 g/L溴甲酚绿乙醇溶液临用时混合)、400 g/L氢氧化钠溶液、0.050 0 moL/L硫酸标准溶液。所有试剂均用不含氨的蒸馏水配制。
1.1.4 仪器 生化培养箱、振荡培养箱、离心机、分光光度计、凯氏定氮仪、高压灭菌锅、超净工作台、取样器、试管、培养皿等。
1.2 方法
1.2.1 1%饲料培养基 鳖饲料1.0 g,纯净水100 mL,混合后溶解均匀。
1.2.2 菌株生长与养殖水体中饲料残饵降解的关系
将保存的地衣芽孢杆菌DSY002-2011在普通营养肉汤培养基上培养24h,接种于pH值为7、灭菌后的1%鳖饲料培养基,28 ℃ 振荡培养。接种后在0、24、48、72、96、120 h时取样测定(从24 h时开始测定)、蛋白质含量、淀粉含量。
1.2.3 初始pH值对地衣芽孢杆菌降解饲料残饵能力的影响
配制1%鳖饲料培养基5份,pH值分别调为5、6、7、8、9,灭菌后接种地衣芽孢杆菌,28 ℃振荡培养,培养至72 h时取样测定蛋白质、淀粉含量。
1.2.4 盐度对地衣芽孢杆菌降解饲料残饵能力的影响
配制pH值为7的1%鳖饲料培养基6份,盐度分别为0、0.5%、10%、1.5%、2.0%,灭菌后接种地衣芽孢杆菌,28 ℃振荡培养,培养至72 h时取样测定蛋白质、淀粉含量。
1.2.5 细菌计数及细菌蛋白氮测定
地衣芽孢杆菌DSY002-2011接种于普通营养肉汤中,28 ℃摇床培养24 h。将细菌培养液于4 ℃、3 000 r/min离心10 min,弃上清液,用生理盐水反复吹打,重复以上步骤3次。将细菌悬液进行适当稀释,分别用血球计数板法(此方法可测得活菌和死菌的总量)和平板菌落计数法(此方法测得活菌数量即细菌生长量)进行计数,计算两者的比例。
细菌培养液润洗后于10 000 r/min离心10 min,弃液体,平铺在滤纸上,37 ℃鼓风干燥30 min,称质量,计算1 g细菌的数量(活菌和死菌的总量),并通过干燥恒重法(105 ℃)测定细菌水分含量,从而得出1 g细菌干物质的质量,再测定 1 g 细菌干物质中的氮元素,采用半微量凯氏定氮法[7]。
1.2.6 饲料蛋白质降解率的计算
地衣芽孢杆菌的生长并不会使培养液中氮总量发生变化,只是将饲料蛋白质转化成了细菌蛋白质,所以转化的饲料蛋白质可以根据地衣芽孢杆菌培养前后含量变化来换算。培养前的初始饲料蛋白质含量由半微量凯氏定氮法测定,氮换算为蛋白质的系数是6.25。
饲料蛋白质降解率=细菌生长转化的饲料蛋白质含量/培养前饲料蛋白质含量×100%。
1.2.7 饲料淀粉降解率的测定
淀粉含量的测定采用碘显色法[8]。饲料淀粉降解率=(培养前淀粉浓度-培养后淀粉浓度)/培养前淀粉浓度×100%。
2 结果与分析
2.1 细菌计数及细菌蛋白氮测定
平板计数法测得地衣芽孢杆菌活菌浓度为9.8×1010 CFU/mL,血球计数板法测得24 h培养的地衣芽孢杆菌数量为3.0×1011 CFU/mL,两者比例为1 ∶3.06。测得1 g地衣芽孢杆菌为5.3×1011个,细菌菌体水分含量为76%。半微量凯氏定氮法测得1 g地衣芽孢杆菌干物质中含氮量为128%。测得2 mL模拟残饵培养基蛋白质含量为0.010 2 g, 100 mL培养瓶中饲料蛋白含量为0.51 g。
2.2 地衣芽孢杆菌生长与水体中饲料残饵降解的关系
经半微量凯氏定氮法测定,1%鳖饲料培养基中的初始饲料蛋白质含量为5.1 mg/mL。在pH值为7的含1%鳖饲料培养基中,接种地衣芽孢杆菌后于28 ℃振荡培养,表1结果表明,在培养液中,细菌数量迅速增加,并在96 h达到最大值;接种后24 h饲料蛋白质、淀粉降解率分别为588%、629%;蛋白质降解率在96 h时达到最大值74.5%,淀粉降解率在72 h时达到最大值72.1%。由此说明,在培养液中地衣芽孢杆菌的生长与蛋白质、淀粉的降解具有同步的相关性。
2.3 初始pH值对地衣芽孢杆菌降解饲料残饵能力的影响
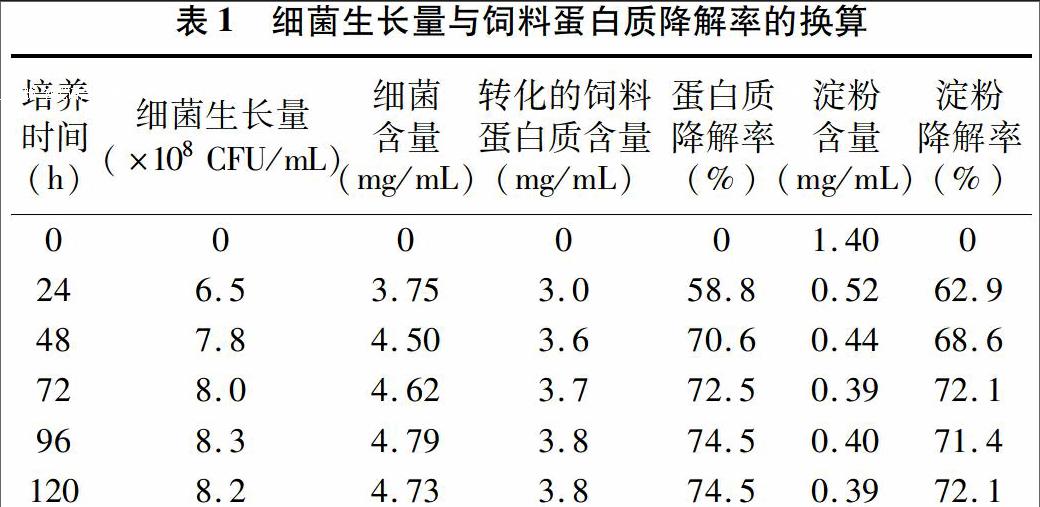
图1结果表明,pH值为6~7时,地衣芽孢杆菌对蛋白质和淀粉的降解效果比较好,在pH值为7时,蛋白质、淀粉降解率达到最大值,分别为72.5%、72.1%。另外,pH值为 5~9 条件下,地衣芽孢杆菌饲料蛋白质、淀粉降解率均接近或高于60%,说明菌株降解饲料残饵能力受pH值影响较小。
2.4 盐度对地衣芽孢杆菌降解饲料残饵能力的影响
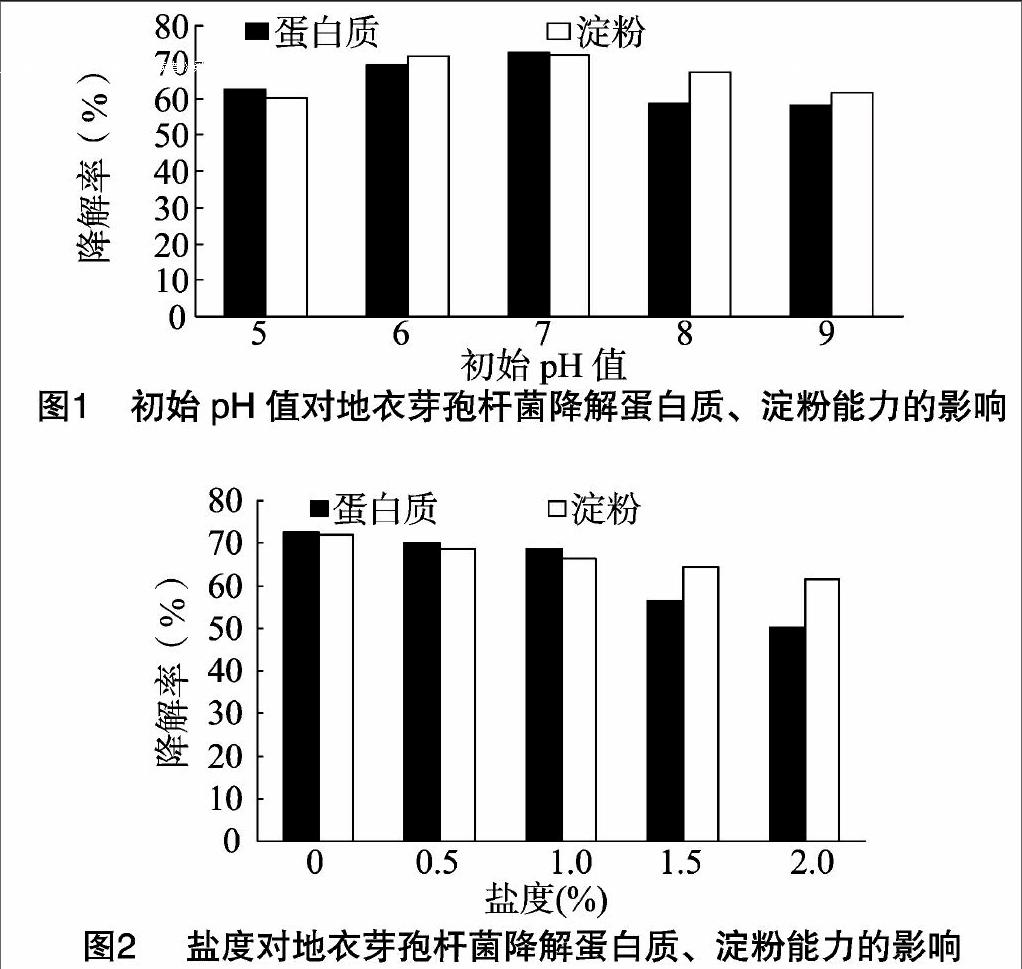
由图2可见,盐度为0~2.0%条件下,地衣芽孢杆菌的蛋白质降解率在50.2%~72.5%之间,淀粉降解率在 61.7%~72.1% 之间;盐度为0时,地衣芽孢杆菌的蛋白质、淀粉降解率均最高,随着盐度增加,蛋白质、淀粉降解率均逐渐下降;盐度超过1.0%后,蛋白质降解率下降更快。试验结果表明,在盐度为0~1.0%条件下,地衣芽孢杆菌对饲料蛋白质、淀粉的降解效果较好。
3 结论与讨论
高密度的养殖水体中,水质的污染主要来源于大量残余饵料、养殖动物的粪便以及浮游生物的尸体等[9],这些有机物的主要成分是蛋白质和淀粉。这种水质污染情况会随着养殖期的发展越来越严重,尤其到养殖后期,成为各种病害频发的诱因。本试验从自然养殖池塘筛选到1株地衣芽孢杆菌DSY002-2011,对其饲料蛋白质、淀粉的降解特性进行研究,结果表明,该菌株在水温28 ℃、pH值为7的1%饲料培养液中培养24 h后,对饲料蛋白质、淀粉的降解率分别达到588%、62.9%,说明在养殖水体中添加地衣芽孢杆菌对水体残余饵料的降解是非常有效的。有研究报道,地衣芽孢杆菌能产生多种具有重要生物活性的胞外产物,如肽类或非肽类的抗菌物、小分子活性物质及多种胞外消化酶[10],因此它可促进养殖水体的营养循环,从而净化水质[11-13]。
在实际应用中,地衣芽孢杆菌的生长、产酶能力及胞外产物的活性均会受到水质环境因子的影响[14],如温度、盐度和pH值等除了影响菌株的生长,也会影响菌株的酶系活性[15],从而影响菌株对饲料蛋白质、淀粉的降解能力。本试验中,较合适的降解条件为偏酸性至中性(pH值6~7) 、 适温(25~30 ℃) 、低盐浓度(0~1.0%),这与谢航等的研究结果[16]一致。朱彦博等研究表明,随着盐度增加,菌株相对蛋白酶的活性趋于减弱[17],这与本研究蛋白降解率随着盐度增加而降低的结果一致。另外,从很多报道看,不同菌株在相同pH值条件下蛋白酶活性存在显著差异[14,17-18],最大酶活性出现在pH值7.0~10.5之间不等,这可能是因为涉及了不同地衣芽孢杆菌菌株,说明不同菌株的最适pH值是存在差异的,在今后工作中,要特别注意不同菌株环境因子的研究。
参考文献:
[1]杨学芬,杨瑞斌,齐振雄. 微生态制剂在水质调控中的应用[J]. 水利渔业,2003,23(3):40-42.
[2]王彦波,邓岳松. 微生态制剂对虾池水质影响的研究[J]. 水利渔业,2003,23(2):16-17.
[3]张 巍,赵 军,郎咸明,等. 硝化细菌在不同温度下对氮素的去除效能研究[J]. 环境科学与管理,2010,35(6):83-86.
[4]丁爱中,陈繁忠,雷剑泉,等. 光合细菌调控水产养殖业水质的研究[J]. 农业环境保护,2000,19(6):339-341,344.
[5]尹文林,沈锦玉,沈智华,等. 枯草芽孢杆菌B115株对水质改良效果研究[J]. 渔业现代化,2006,06(6):9-11,20.
[6]Lin Y,Kong H N,He Y L,et al. Simultaneous nitrification and denitrification in a membrane bioreactor and isolation of heterotrophic nitrifying bacteria[J]. Japanese Journal of Water Treatment Biology,2004,40(3):105-114.
[7]马广慈,唐任寰,郑斯成. 药物分析方法与应用[M]. 北京:科学出版社,2000:189-190.
[8]沈 萍,范秀容,李广武. 微生物学实验[M]. 3版.北京:高等教育出版社,1999.
[9]曹煜成,李卓佳,林小涛,等. 地衣芽孢杆菌De株对凡纳滨对虾粪便的降解效果[J]. 热带海洋学报,2010,29(4):125-131.
[10]曹煜成,李卓佳,冯 娟,等. 地衣芽孢杆菌胞外产物消化活性的研究[J]. 热带海洋学报,2005,24(6):6-12.
[11]Moriarty D J. The role of microorganisms in aquaculture ponds[J]. Aquaculture,1997,151(1):333-349.
[12]Sahu M K,Swarnakumar N S,Sivakumar K,et al. Probiotics in aquaculture:importance and future perspectives[J]. Indian Journal of Microbiology,2008,48(3):299-308.
[13]曹煜成,李卓佳,林黑着,等. 地衣芽孢杆菌De在优质草鱼养殖中的应用研究[J]. 南方水产,2008,4(3):15-19.
[14]曹煜成,李卓佳,吴灶和,等. 地衣芽孢杆菌胞外蛋白酶的纯化及特性分析[J]. 水生生物学报,2006,30(3):262-268.
[15]张庆华,封永辉,王 娟,等. 地衣芽孢杆菌对养殖水体氨氮、残饵降解特性研究[J]. 水生生物学报,2011,35(3):498-503.
[16]谢 航,邱宏端,王秀彬,等. 地衣芽孢杆菌降解水产养殖中残余饵料的特性研究[J]. 福建水产,2008,26(3):31-35.
[17]朱彦博,唐叶玲,陈圣丰,等. 盐度、温度和pH对2株海南地衣芽孢杆菌相对蛋白酶活性的影响[J]. 海南大学学报:自然科学版,2013,31(2):133-138.
[18]袁 铸,王忠彦,胡 承,等. 地衣芽孢杆菌JF-UN122碱性蛋白酶的分离纯化与性质[J]. 工业微生物,2003,33(3):25-29.

