猪伪狂犬病病毒泰州株的分离鉴定
郭广富 曹军平 朱爱萍等

摘要:从泰州市姜堰区某猪场发生的疑似伪狂犬病病猪中采集病料,接种PK15细胞,收取细胞病毒液并提取DNA,经PCR检测及间接免疫荧光鉴定,结果表明该分离株为猪伪狂犬病毒,命名为TAIZ130417。分离的病毒在PK15细胞上的生长滴度可以达到108.12 TCID50/mL。将该病毒接种家兔,家兔很快出现奇痒并最终死亡等伪狂犬症状。
关键词:猪伪狂犬病毒;分离;鉴定
中图分类号: S858.285.3 文献标志码: A
文章编号:1002-1302(2015)03-0200-03
伪狂犬病(pseudorabies,PR) 是由伪狂犬病病毒 (pseudorabies virus,PRV)引起多种家畜和野生动物以发热、奇痒(猪除外)和脑脊髓炎为主要症状的急性传染病[1]。以猪的感染最为普遍,该病毒能引起母猪的繁殖障碍,主要表现为流产、死胎、木乃伊胎等;新生仔猪发生感染时,死亡率可高达100%;此外,育肥猪感染往往致使其生长缓慢,种公猪感染则导致精液品质下降甚至丧失种用价值[2]。伪狂犬病最早在美国发现,我国于20世纪40年代末在猫中首次发现了该病毒,60年代初在猪群中也出现了该病毒流行。目前,该病在我国广泛流行,严重威胁着猪群的健康,并造成了养猪业严重的经济损失[3-4]。本研究对泰州市某猪场疑似伪狂犬病患猪采集肝、肾及脾等组织病料,进行PRV的分离、鉴定,以期为今后深入研究和科学地防控该病提供参考依据。
1 材料与方法
1.1 病料
疑似伪狂犬病病猪的肝、肾及脾等组织,于2013年4月17日采自泰州市姜堰区某猪场。将采集的病料研碎,按 1 g ∶5 mL 加入无菌含双抗的PBS溶液,混匀,反复冻融3次,离心取上清,用孔径0.22 μm滤器过滤后,-20 ℃保存备用。
1.2 试剂、细胞、阳性血清及家兔
基因组DNA快速抽提试剂盒(动物)、Taq DNA聚合酶、dNTP Mix、25 mmol/L MgCl2及10×PCR buffer均为上海生工生物工程有限公司产品,100 bp DNA Ladder和6×DNA 凝胶载入染料(Loading Dye)购自Fermentas公司。PK15细胞由江苏省动物流行病学研究中心保存。猪源抗PRV阳性血清,购自VMRD公司,羊抗猪IgG-FITC,购自SANTN CRUZ公司。胰酶细胞消化液,购自上海碧云天生物技术有限公司;新生牛血清和DMEM培养基购自上海生工生物工程有限公司。健康的家兔4只,购自江苏农牧科技职业学院农场。
1.3 引物的设计与合成
根据文献[5]方法,合成1对PRV引物,片段针对PRV gH基因中的一段序列,扩增片段长355 bp。引物序列为:上游引物5′-GCGTGTACTGCGACTGCGTGTT-3′;下游引物 5′-CGACCTGGCGTTTATTAACCGAGA-3′,由上海生工生物工程有限公司合成。
1.4 病毒核酸的提取及PCR
用基因组DNA快速抽提试剂盒,按说明书上的操作方法提取组织病料DNA。以提取的组织病料DNA为模板进行PCR扩增,PCR采用50 μL反应体系:5 μL 10×buffer、3 μL 25 mmol/L MgCl2、1 μL 10 mmol/L dNTPs、20 μmol/L上下游引物各1 μL,用灭菌超纯水补足50 μL。反应条件为94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。用15 g/L琼脂糖凝胶电泳,在紫外灯下观察电泳图谱,拍照记录结果。
1.5 病毒的分离
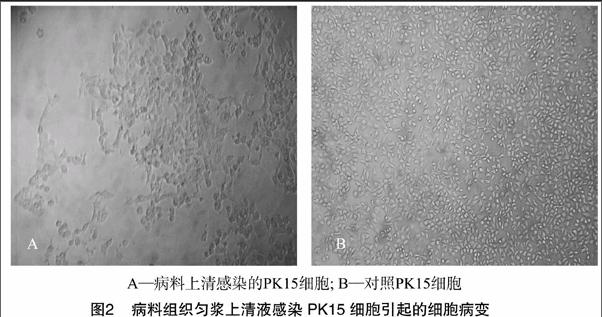
将上述“1.1”节处理的经PCR检测呈PRV阳性的病料悬液接种于PK15单层细胞上,37 ℃孵育1 h后弃接种液,加入含2%新生牛血清的DMEM培养液,置于37 ℃、50 mL/L CO2培养箱,每日观察,盲传至细胞病变稳定、病变率达80%时收毒,对收获的病毒液PCR检测PRV。
1.6 病毒的IFA鉴定
将分离毒接种至长满单层的PK15细胞,37 ℃孵育1 h后,吸取病毒液,PBS洗涤2次,加入维持液于37 ℃、5% CO2培养箱中培养72 h;同时以未接种病毒的PK15细胞作为阴性对照。待检细胞使用PBS洗涤3次,冰甲醇4 ℃固定 30 min;PBS洗涤3次,加入猪源抗PRV阳性血清,37 ℃孵育1 h;PBS洗涤3次,再加入FITC标记的羊抗猪抗体,37 ℃孵育1 h,PBS洗涤3次后,置于Olympus倒置荧光显微镜下观察。
1.7 病毒滴度测定
将病毒液稀释成10-1~10-10,分别接种到96孔培养板中长成融合单层的PK15细胞上,每个稀释度接种8孔,培养板最后2列孔接种稀释液作对照,置于37 ℃、5% CO2的细胞培养箱中培养,96 h后观察细胞病变,按照Reed-Muench法计算病毒的TCID50。
1.8 家兔接种试验
用PRV分离毒株腹侧皮下接种2只家兔,2 mL/只;另取2只作为阴性对照组,分别注射细胞维持液,2 mL/只。试验组和对照组隔离饲养,每日观察记录家兔的临床表现。
2 结果与分析
2.1 病料的PCR检测
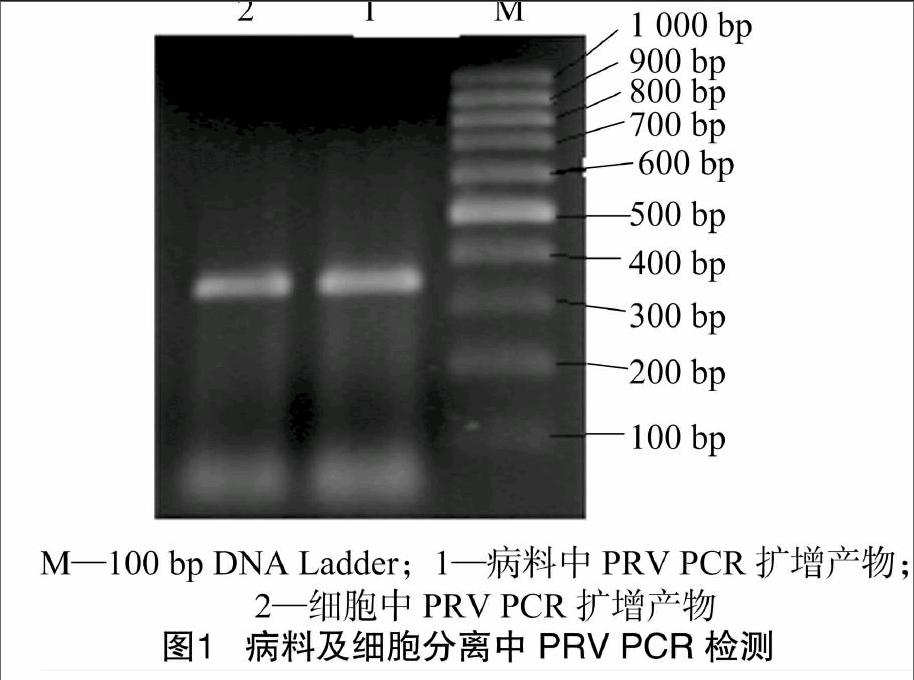
对疑似PRV感染猪组织病料提取DNA,然后进行PCR检测,扩增出片段大小为355 bp的目的条带,与预期结果相符(图1)。
2.4 病毒滴度
统计不同稀释度的分离毒在96孔细胞板上PK15细胞中出现的致细胞病变效应(cytopathic effect,CPE),按Reed-Muench法测得分离毒滴度可达108.12 TCID50/mL。
2.5 家兔感染试验
2只试验组家兔在接种细胞病毒液后约48 h表现奇痒症状,不断啃咬腹侧注射部位,掉毛出血;接种后62 h时出现角弓反张而死亡。注射细胞维持液的对照组家兔观察7 d后均无异常表现。死亡兔剖检可见脑膜充血、肺瘀血,并有大小不等的出血斑点,气管环充、出血,肝瘀血肿大、有坏死灶等(图4)。
3 结论与讨论
PR是危害养猪业的重要传染病[6],我国是一个养猪大国,因而对该病病原的深入研究具有非常重要的意义。
PCR技术是从分子水平对病毒进行诊断的一种方法,能检出痕量病毒。PCR具有快速、敏感、特异性强等优点,不仅可以检测细胞培养的PRV,而且可以直接检测临床样品[7]。本试验先对临床PR可疑病猪采集病料进行PCR检测,检测阳性后才接种到细胞,提高了细胞分离的成功率。
PRV具有泛嗜性,能在许多细胞中增殖。猪的PK-15、SK6、PS细胞,仓鼠的BHK-21,猴的Vero细胞、GMK细胞和兔的EP细胞等都能用于增殖该细胞,其中PRV对猪肾细胞和兔肾细胞最为敏感,生产上常使用猪细胞系PK-15或 SK-16 细胞进行PRV的培养。本试验选用PK-15细胞分离培养,除了PRV对其具有较强的敏感性外,该细胞还具有易培养、增殖速度快等特点[8]。
IFA是我国目前用于PR快速诊断的一种较好方法,该方法具有特异性高,不与细小病毒、腺病毒、血凝性脑炎病毒及肠道病毒发生交叉反应,以及敏感性较高等特点[9]。对本次细胞病毒的鉴定采用了IFA方法,发现分离病毒感染PK15后呈现明显的特异性绿色荧光,而未接种PRV的PK15细胞没有观察到任何特异性荧光。
动物接种试验是PR常用的检测方法。将病料或分离的病毒上清液皮下接种到家兔或小鼠,根据家兔或小鼠的临床症状做出判定。若接种液中含有PRV,家兔会不停啃咬接种部位,随即后肢麻痹,卧地不起,最后抽搐死亡;小鼠接种含有PRV的病料,也会出现神经症状,最后死亡。本试验使用学校牧场饲养的健康家兔,接种细胞毒后3 d内发病死亡,观察到典型的神经症状,且解剖见到明显的内脏病理变化。
本试验将PCR检测后PRV阳性的病料接种PK15细胞,经IFA鉴定、病毒滴度测定及家兔接种试验,结果成功分离出一泰州株PRV。该毒株的获得,为今后深入研究该病毒的分子生物学特性及开发有效的免疫制剂提供了科学的参考依据。
参考文献:
[1]斯特劳 B E. 猪病学[M]. 8版.赵德明,译. 北京:中国农业大学出版社,2000:239-253.
[2]初小辉. 吉林省猪伪狂犬病流行病学调查与防控措施的研究及应用[D]. 长春:吉林大学,2011.
[3]Tamba M,Calabrese R,Finelli E,et al. Risk factors for Aujeszkys disease seropositivity of swine herds of a region of northern Italy[J]. Preventive Veterinary Medicine,2002,54(3):203-212.
[4]童 武,张青占,郑 浩,等. 免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J]. 中国动物传染病学报,2013,21(3):1-7.
[5]胡 慧,贾艳艳,杨春华,等. 多重PCR检测猪伪狂犬病毒、猪细小病毒和猪圆环病毒2型的研究[J]. 河南农业大学学报,2010,44(4):421-424.
[6]彭金美,安同庆,赵鸿远,等. 猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J]. 中国预防兽医学报,2013,35(1):1-4.
[7]Echeverría M G,Pecoraro M R,Pereyra N B,et al. Rapid diagnosis of pseudorabies virus infection in swine tissues using the polymerase chain reaction(PCR)[J]. Revista Argentina de Microbiología,2000,32(3):109-115.
[8]吴云飞,朱 玲,徐志文,等. 伪狂犬病病毒四川株的分离鉴定及增殖特性[J]. 中国兽医科学,2013,43(6):557-564.
[9]倪 娇,周绪斌,张馨玉,等. 近期部分规模化猪场猪伪狂犬病野毒抗体监测情况调查[J]. 中国畜牧兽医,2007,34(9):102-104.

