不同酸度对火焰原子吸收分光光度法测钙的影响
吴丹丹,胡文英,范金松
(1.莆田学院 环境与生物工程学院;2.莆田学院福建省生态环境及其信息图谱重点实验室,福建 莆田350011)
不同酸度对火焰原子吸收分光光度法测钙的影响
吴丹丹1,2,胡文英1,2,范金松1
(1.莆田学院 环境与生物工程学院;2.莆田学院福建省生态环境及其信息图谱重点实验室,福建 莆田350011)
摘要:采用盐酸、硝酸以及冰乙酸作为酸性介质,分别实验不同酸度的酸性介质对火焰原子吸收法测钙吸光度的影响,探讨其对钙的影响机理,进而选择出较为适宜的酸度范围与酸性介质.
关键词:火焰原子吸收分光光度法;酸度;钙标准液;吸光度
测定微量或者痕量钙,火焰原子吸收分光光度法(FAAS)是较快速度及准确的方法之一,该方法具有操作简单、灵敏度高、准确性好、选择性好、抗干扰能力强等诸多优点[1].样品在处理过程中,常会用到不同的酸,常见的有硝酸[2-3]、盐酸[4]、冰乙酸[5]等;适宜酸度的酸性介质可以使钙的原子吸收信号增强,从而提高仪器的灵敏度、精密度及测试的准确性,但是,如不控制其酸度也会对测定产生干扰,通过实验针对不同的干扰影响因素采用不同的消除方法,以确定实验效果较佳的酸性介质及相应的最佳酸度范围,可更准确地测定钙含量.
1 实验部分
1.1主要仪器及试剂
仪器:火焰原子吸收分光光度计(AA-6300C,日本岛津);电子天平(BS-224S,北京赛多利斯仪器系统有限公司);钙空心阴极灯(LTL-2,贺利氏沈阳特种光源有限公司);自动进样器(ASC-6100,日本岛津).酸:硝酸;盐酸;冰乙酸均为优级纯.1 000 μg·mL-1钙标准储备液.
钙标准溶液:将钙标准储备液用重蒸水稀释至100 μg·mL-1.
1.2实验方法
1.2.1仪器测试条件

表1 钙测定的实验条件
1.2.2标准曲线及线性回归方程
从100 μg·mL-1钙标准溶液中分别吸取0.00、2.00、4.00、6.00、8.00、10.00 mL至50 mL比色管,用重蒸水定容,配制成浓度为0.00、4.00、8.00、12.00、16.00、20.00 μg·mL-1的钙标准液,在1.2.1的实验条件下,测定吸光度,取得标准曲线方程为:A=0.033 4 C+0.022.其线性相关系数R=0.997 1.
1.2.3酸性介质种类的选择
取5.00 mL 100.00 μg·mL-1的钙标准液分别置于50 mL的比色管中,分别加入0.00 mL、0.10 mL、0.20 mL、0.30 mL、0.40 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL的酸性介质(硝酸、盐酸与冰乙酸,以下同),用重蒸水定容,摇匀备用.此时钙标准液的浓度为10.00 μg·mL-1,酸性介质的百分含量分别为:0.00%、0.20%、0.40%、0.60%、0.80%、1.00%、2.00%、3.00%、4.00%.以相应百分含量的酸性介质为空白样,测其吸光度并比较影响效果.
2 结果与讨论
2.1酸性介质种类的选择
将1.2.3实验步骤配得的样品,在1.2.1的实验条件下,测定吸光度,得到的实验数据如表2.
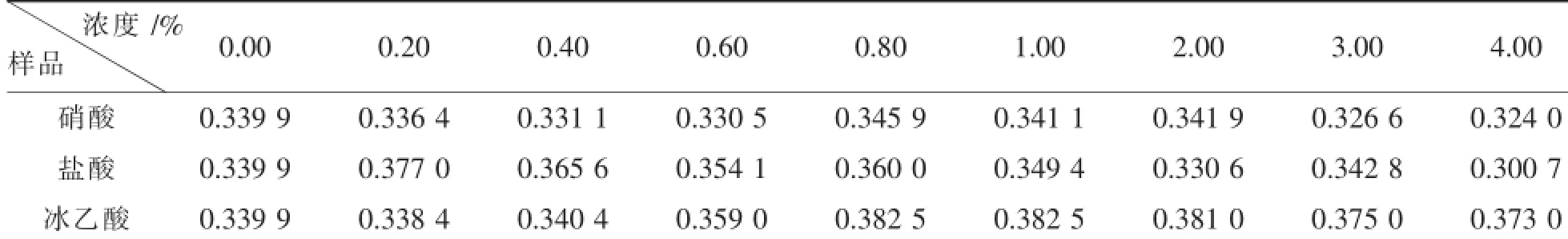
表2 硝酸、盐酸、冰乙酸的浓度对吸光度的影响
从表2可以看出:(1)当以硝酸为酸性介质时,样品的吸光度随着硝酸浓度的增高先下降,后升高再急剧下降,当硝酸浓度为0.80%时,吸光度为0.345 9达到最高;(2)当以盐酸作为酸性介质时,样品的吸光度随着盐酸浓度的增高先快速升高,后缓慢下降,当盐酸浓度为0.20%时,吸光度为0.377 0达到最高;(3)当以冰乙酸作为酸性介质时,样品的吸光度随着冰乙酸浓度的增高先快速升高,后平缓下降,当冰乙酸浓度达到0.80%时,吸光度为0.382 5达到最高;(4)硝酸、盐酸的最佳用量范围(硝酸为0.80%~2.00%,盐酸为0.20%~1.00%)与冰乙酸(0.40%~4.00%)相比较窄,虽然在一定程度上对钙标准溶液的吸光度有增强作用,但作用明显不如冰乙酸.
以表2中酸性介质溶液的不同浓度为横坐标,其对应的吸光度为纵坐标绘制曲线,得到下图1.
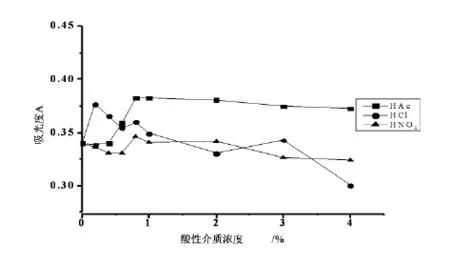
图1 不同酸性介质浓度下的吸收曲线
分析认为:(1)本实验所选的硝酸、盐酸属于无机酸,由于氢离子的存在促进了钙元素的电离程度,从而提高了火焰中钙元素的离子浓度;(2)盐酸在比较高的浓度时可以使钙元素的吸光度随着浓度的提高,吸光度明显下降,主要是由于氯离子的存在使钙元素解离原子化效率降低[6-7]:加盐酸后的钙标准溶液在原子化过程中由于氯化钙的原子化温度远高于火焰温度,所以有氢氧化钙生成[8]:CaCl2+H2O(Ca(OH)2+H++Cl-,当溶液中盐酸浓度较低时,即氯离子含量较低时,氯化钙与氢氧化钙组成低熔点的混合物以游离的氯化钙为主,熔点降低,钙元素的原子化效率得到提高,钙标准溶液的吸光度增大;而当盐酸浓度增加,溶液中氯离子含量较高时,反应向左移,使得混合物中氢氧化钙固体为主,熔点升高,钙元素的原子化效率降低,从而吸光度下降.(3)冰乙酸为一种有机酸,其化学性质与EDTA和三氯醋酸相似,属于金属螯合物试剂,其分子本身具有一定的螯合基团[9].当冰乙酸加入到钙标准溶液中时会与钙元素形成螯合物,由于形成螯合物后电子对配位键比一般化合物中化学键的稳定性要低,从而使得从金属螯合物中释放出钙原子的解离能较低,有利于钙基态原子的生成,故而能够提高火焰原子化效率,提高待测元素的吸光度,进而提高灵敏度[10];同时冰乙酸又属于有机酸,有机酸的存在使得火焰温度升高,燃烧产物改变了火焰的还原性,从而对钙化合物气溶胶的熔融蒸发速率产生一定的影响.
2.2标准曲线的比较
在1.2.1的实验条件下,分别对加入0.00%(A组)与0.80%(B组)冰乙酸的钙标准溶液,测定其浓度从0.00~20.00 μg·mL-1的吸光度,实验数据如表3所示.

表3 钙标准溶液的标准曲线
表3中钙标准溶液浓度(0.00~20.00 μg·mL-1)与吸光度的函数关系如表4.

表4 钙标准溶液曲线方程
由表3、表4可以看出,加入0.80%冰乙酸的钙标准溶液后吸光度显著提高,而且钙标准曲线线性更好.
2.3灵敏度、检出限、回收率、精密度的比较
在1.2.1的实验条件下,以10.00 μg·mL-1浓度的钙标准溶液,分别在0.00%(样品C)和0.80%(样品D)冰乙酸的酸性介质条件下测定其灵敏度、检出限、回收率、精密度,并对实验结果进行比较,如表4:

表5加入酸性介质与不加酸性介质的钙标准溶液灵敏度、检出限、回收率、精密度的比较
表5实验结果显示:火焰原子吸收分光光度法测定钙时,在加入0.8%冰乙酸作为酸性介质的条件下,仪器的灵敏度提高了1.1倍,检出限降低1.1倍,回收率比不加冰乙酸的高,精密度提高2倍.
3 结论
综合上述分析,硝酸、盐酸虽然在一定程度上对钙标准溶液的吸光度有增强作用,但作用明显不如冰乙酸的作用大,硝酸和盐酸的影响效果随浓度的变化不稳定,到达一定的浓度反而会使钙元素的吸光度值下降,因此选择冰乙酸作为本实验的最佳酸性介质,最佳用量在0.80%,最佳酸度用量范围应控制在0.40% ~4.00%.建议在采用硝酸或盐酸对样品进行预处理时,应控制溶液中的酸含量,硝酸浓度宜控制在0.80%~ 2.00%,盐酸浓度宜控制在0.20%~1.00%,以减少对钙元素测定的影响.
参考文献:
[1]吴丹丹,黄海生,沈高扬.火焰原子吸收分光光度法测定铅时增效剂的选择[J].韶关学院学报,2014,35(8):58-60.
[2]GB13580.13-92.大气降水中钙、镁的测定原子吸收分光光度法[S].
[3]景丽洁,马甲.火焰原子吸收分光光度法测定污染土壤中5种重金属[J].中国土壤与肥料,2009(1):74-77.
[4]邢书才.酸度介质对原子吸收法测定钙元素灵敏度的影响[J].干旱环境监测,2008,22(2):111-113.
[5]李维霞,张宝黔.酸对原子吸收测定钙的影响[J].玻璃与搪瓷,2002,30(6):30-31.
[6]李建强.空气-乙炔火焰原子吸收法测定钙时氯离子的干扰[J].污染防治技术,1997,10(2):121-124.
[7]姜典镇.火焰原子吸收法测定元素钙的影响因素及其校正[J].微量元素与健康研究,2005,22(4):43.
[8]朱晨华,施敬文,冷桃花.酸及镧盐对钙测定的影响[J].光谱实验室,2012,29(1):357-360.
[9]周志瑞,王凯雄.火焰原子吸收中配位体对铜原子吸光度的增感效应[J].高等学校化学学报,1982,8(4):459-462.
[10]周志瑞,徐宏亮,庄向平.401螯合树脂富集原子吸收法测定海盐中微量重金属元素[J].高等学校化学学报,1982,12(6): 519-521.
(责任编辑:李婉)
中图分类号:O657.31
文献标识码:A
文章编号:1007-5348(2015)08-0037-04
[收稿日期]2015-05-15
[基金项目]莆田市科技计划项目(2014S03-1);莆田学院教育教学改革研究项目(JG201432).
[作者简介]吴丹丹(1982-),女,福建莆田人,莆田学院环境与生物工程学院实验师,硕士;研究方向:光谱仪器分析测试.
The Effects of Different Acidities on the Calcium Contents Determination by FAAS
WU Dan-dan1,2,HU Wen-ying1,2,FAN Jin-song1(1.College of Environmental and Biological Engineering,Putian University; 2.University Key Laboratory of Ecological Environment and Information Atlas,
Putian University,Putian 350011,Fujian,China)
Abstract:The purpose of this experiment was to explore the effects of different acidities on the determination of calcium contens by flame atomic absorption spectrometry(FAAS).Different acidity media of hydrochloric acid, hydrogen nitrate and acetic acid are respectively experimented.And the effect mechanism of calcium was analyzed.Thus the suitable range of acidity and acid medium can be selected.
Key words:flame atomic absorption spectrometry;acidity;the standard fluid of calcium;absorbency
——酸度

