改性Fe3O4纳米粒子的定性及对功能菌固定化与脱氮特性
郑永杰,尚明慧,田景芝,王志刚,徐伟慧
(1 齐齐哈尔大学化学与化学工程学院,黑龙江 齐齐哈尔 161006;2 齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006)
随着工农业的快速发展,废弃物的排放导致水体富营养化现象愈发严重。水体污染中氨氮过高不仅导致水体恶臭,还会使鱼类鳃、肝、肾等明显受到损伤,生长受到限制间接危害人体健康[1];硝氮含量过高会使人类特别是婴儿血液中变性血红蛋白增加引起高铁血红蛋白症,甚至会致癌致死等[2]。为解决这一系列问题,全球范围内普遍采用生物脱氮技术改善水质[3]。生物脱氮技术是在微生物作用下,将有机氮和NH3-N 转化为N2和NxO 气体的过程[4],而水体的生物脱氮主要通过固定化菌株的方式进行。肖晶晶[5]通过筛选并固定化 AGMR 脱氮菌群颗粒,发现固定化菌群脱氮能力明显优于游离状态。张会萍等[6]以陶粒为载体对高效脱氮菌群进行固定化,并通过多次富集,最后获得了脱氮率级高的陶粒固定化脱氮菌群。刘少敏等[7]用聚乙烯醇/海藻酸钠作为包埋载体固定硝化细菌,对生活污水中氨氮的去除效果显著。Pranee 等[8]运用生物聚合壳聚糖对亚硝酸氧化菌进行固定化研究,其对亚硝氮有良好的去除效果等。本文提出的用二氧化硅(SiO2)和壳聚糖(CS)改性的Fe3O4磁性纳米微球具有粒径小、比表面积大、极性强的特点;磁性微球和表面带有电荷的细菌之间通过静电力结合来实现菌株的固定化,而且磁性对菌株有一定的稳固与活化作用,并且可以在磁场的作用下实现分 离[9-10]。本文还利用微球磁性对菌株功能进行改善,通过吸附与微胶囊包埋双重作用固定化功能性脱氮菌株,并研究其脱氨氮与硝氮性能,为进一步应用提供理论基础与技术支撑。
1 实验部分
1.1 实验材料
(1)菌株来源 实验室筛选的具有脱氮性能的Enterobacter hormaechei QDTN-34 菌株,该菌株保藏在中国典型培养物保藏中心(CCTCC M 2013670)。
(2)反硝化培养基 C6H5Na3O7·2H2O,3.00g;KNO3,0.7210g;KH2PO4,1.0g;MgSO4·7H2O,1.0g;蒸馏水1000mL,pH=7.0,121℃灭菌20min。
(3)异养硝化培养基 C6H5Na3O7·2H2O,5.0g;(NH4)2SO4,0.45g;K2HPO4,0.25g;FeSO4·7H2O,0.0025g;NaCl 0.125g;MgSO4,0.06g;MnSO4·H2O,0.001g;蒸馏水1000mL,pH=7.0,121℃灭菌20min。
1.2 共沉淀法制备Fe3O4 磁性纳米微球
将5.406gFeCl3·6H2O 和2.7803gFeSO4·6H2O 溶于100mL 水中混匀,在80℃下剧烈搅拌30min,期间缓慢加入NH4·H2O 至pH≈10。反应完全后分离固相,将分离物用乙醇洗涤3 次后水冲洗至中性,60℃下真空干燥24h,备用,记为FG。
1.3 溶剂热法制备Fe3O4 磁性纳米微球
分别称取2.20g FeCl3·6H2O、5.40g NaAc 和0.20g 柠檬酸钠,将其溶解于25mL 的乙二醇中,磁力搅拌至全部溶解。将溶液转移至内衬为聚四氟乙烯100mL 的反应釜中,封好后将反应釜放入鼓风干燥箱中进行梯度加热:0~80℃反应2h,80~150℃反应10h,150~200℃反应4h。冷却后将产物用磁铁分离,得到的黑色沉淀分别用乙醇和蒸馏水冲洗数次,最后用蒸馏水冲洗至中性,60℃下真空干燥24h,备用,记为FR。
1.4 Fe3O4@SiO2 磁性微球的制备
将0.1g FR 与0.1gFG 分别超声扩散在40mL 乙醇中,加入1.0mL TEOS、2.5mL(3-氯丙基)三甲氧基硅烷和0.2mLTrition-100,超声10min,再加入10mL 去离子水,超声10min。加入1.0mL NH3·H2O(质量分数28%),超声至混合均匀后30℃剧烈搅拌2h。反应完全后,磁分离固相经乙醇洗涤3 次再用水冲洗至中性,与60℃下真空干燥24h,备用,记为FR@SiO2与FG@SiO2。
1.5 Fe3O4@SiO2@CS 的制备
称取FR@SiO2与FG@SiO2各0.1g ,超声分散于50mL 壳聚糖溶液中(质量分数0.5%),将水相中缓慢滴加50mL 液体石蜡、7mL 石油醚、7mL Trition-100 混合物,剧烈搅拌1h 后,加入10mL 1.0%戊二醛交联1h。反应结束后磁分离沉淀物,用乙醇和丙酮分别冲洗3 次,在60℃下真空干燥24h,备用,记为FR@SiO2@CS 与FG@SiO2@CS。
1.6 改性Fe3O4@SiO2@CS 对QDTN-34 菌株的吸附试验
在3 个等体积的锥形瓶中分别加入10mL OD600为0.1 的菌悬液,分别记为1 号、2 号、3 号。1 号瓶中不加入任何物质(参比);2 号瓶中加入0.01g FG@SiO2@CS 磁性微球;3 号瓶中加入 0.01g FR@SiO2@CS 磁性微球。在10℃震荡下,分别在0min、5min、10min、20min、30min、45min、60min
时用紫外分光光度法在600nm 波长下检测吸附前后菌液的吸光度变化,计算吸附率并通过血球计数法[11]计算出菌株个数。
1.7 PVA/海藻酸钠-CS 固定化微胶囊包埋载体的制备
称取一定量的聚乙烯醇(PVA)溶于100mL 沸水中,向溶液中加入3%的海藻酸钠,加热溶解后冷却至27℃。将吸附菌株的两种Fe3O4@SiO2@CS磁性微球分别加入到包埋材料中,使磁性微球与包埋材料按1∶2 混匀,用注射器注入到含有0.5%CS与4%CaCl2的溶液中,搅拌钙化一段时间后,加入1mL 1.0%的戊二醛交联2h。反应结束后,用生理盐水进行冲洗3 次,冷藏备用。
1.8 固定化载体在水中的脱氮性能
1.8.1 脱氨氮的性能测定
取2 个锥形瓶分别加入100mL NH4+-N 浓度为100mg/L 的异养硝化培养基,记为a 瓶、b 瓶。在a瓶中加入10mL OD600为0.1 的菌悬液;在b 瓶中加入10mL 的固定化载体。27℃下恒温震荡48h,每4h 取2mL 于600nm 波长处测定菌体的光密度值,再将样品4000r/min 离心10min,取上清液用纳氏试剂分光光度法[12]在波长420nm 下比较两瓶溶液中氨氮的含量。
1.8.2 脱硝氮的性能测定
取2 个锥形瓶分别加入100mL NO3+-N 浓度为100mg/L 的反硝化培养基,记为c 瓶、d 瓶。在c瓶中加入10mL OD600为0.1 的菌悬液;在d 瓶中加入10mL 的固定化载体。27℃下恒温震荡48h,每4h 取2mL 于600nm 波长处测定菌体的光密度值,再将样品4000r/min 离心10min,取上清液用紫外分光光度法[13]在波长220nm 下比较溶液中硝氮的 含量。
2 结果与讨论
2.1 反应机理
在溶剂热法制备单分散Fe3O4颗粒过程中,稳定剂乙酸钠分布在Fe3O4表面,其中羧基使Fe3O4在乙二醇中有很好的分散性。加入(3-氯丙基)三甲氧基硅烷偶联剂,NH4+使Fe3O4表面包覆的SiO2更加稳定,再通过反相乳液分散-化学交联法[14]获得均匀包覆有壳聚糖的Fe3O4磁性微球,此时微球表面呈阳性,会更容易吸附带有负电荷的菌株[18]。包覆原理如图1 所示。
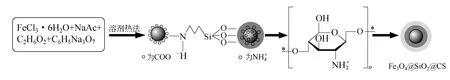
图1 反应机理图
2.2 Fe3O4 磁性纳米粒子的表征
图2(a)、(b)为共沉淀法与溶剂热法制备的Fe3O4的SEM 图像。(a)中纳米粒子呈相对规则的球形,颗粒尺寸均一,但团聚现象较为严重;(b)中磁性纳米颗粒形状较规则,呈球形,且相对单一分散。图2(c)为溶剂热法制备的Fe3O4TEM 图像,从图中可以看出纳米粒子分散良好,平均粒径为200nm 左右;图2(d)为Fe3O4@SiO2TEM 图像,可以看出粒子外围包覆了一层30nm 左右的SiO2;图2(e)为Fe3O4@SiO2@CS TEM 图像,可以看出包覆有CS的磁性微球分散性良好,能明显地看出壳核结构,平均粒径在300nm。综上所述,在制备方法上溶剂热法制备的Fe3O4纳米粒子(FR)及包覆是较理想的状态,以下的试验会以溶剂热法制备的Fe3O4及改性材料为主要研究对象[15]。
图3 为用溶剂热法制备的柠檬酸钠磁性粒子Fe3O4、Fe3O4@SiO2及Fe3O4@SiO2@CS 的红外对比图。图中位于3433cm-1处的震动峰分别属于O—H 键;在1631cm-1和1395cm-1处的伸缩振动峰属于—COOH,这也证明了Fe3O4粒子的表面存在羧基基团,在586cm-1处的振动峰为典型的Fe—O 键,同时在700cm-1处无亚铁氧键的特征吸收峰,说明样品为纯相Fe3O4;在Fe3O4@SiO2图中,位于1110cm-1和791cm-1处的峰位分别对应为Si—O—Si 的反对称及对称伸缩振动峰;位于1629cm-1和971cm-1的峰归属于表面Si—OH 的振动峰,这可以得出SiO2成功包覆于Fe3O4微球表面,在2924cm-1处是—NH 的伸缩振动吸收峰,表明—NH 成功接在磁性微球表面;在Fe3O4@SiO2@CS 图中,1076cm-1处有明显的C—O—C 伸缩振动峰,说明壳聚糖已共价结合到磁性Fe3O4纳米粒子上。

图2 Fe3O4 磁性纳米粒子的SEM 及TEM 图像

图3 Fe3O4 磁性微球红外图
图4 为用溶剂热法制备的柠檬酸钠磁性 Fe3O4纳米粒子的XRD 谱图。通过与Fe3O4的标准XRD谱图比较,在18.8°、 30.11°、35.45°、43.13°、53.54°、56.93°、62.54°、70.34°和74.21°左右出现了9 个特征衍射峰,分别对应立方相(111)、(220)、(311)、(400)、(422)、(511)、(440)、(620)、(533)且主要衍射峰较尖锐,表明样品为反尖晶石型 Fe3O4且晶型良好[16-17]。

图4 Fe3O4 磁性微球XRD 图
图5 为溶剂热法制备的Fe3O4、Fe3O4@SiO2及Fe3O4@SiO2@CS 的热重对比图。图中20~150℃之间的质量减少是由于水和小分子溶剂的分解所引起;当温度200℃时, Fe3O4和Fe3O4@SiO2开始失重但不明显;当达到800℃时,二者分别失重8.23%、10.28%。Fe3O4@SiO2@CS 磁性微球在150℃时开始失重,当达到 250℃左右时,样品质量减轻最为迅速,此时共价结合到磁性Fe3O4@SiO2纳米微球上的壳聚糖迅速分解,单位时间内分解量达到最大,随温度的不断升高,结合到磁性微球上的物质逐渐分解,热重分析显示质量损失约占 42.07%。根据上述结果可以得出,Fe3O4纳米粒子表面小分子活性基团的接枝率为8.23%,Fe3O4@SiO2表面活性基团接枝率为2.05%,CS 表面接枝率为31.79%。

图5 Fe3O4 磁性微球热重图
图6 为振动磁强计VSM 对Fe3O4磁性纳米粒子的磁学性能对比图。从图中可知,溶剂热法制备得到的Fe3O4样品的剩磁强度M 约为1.7emu/g,磁饱和强度Ms约为62.7emu/g,磁矫顽力Hc约为11.1 Oe;Fe3O4@SiO2@CS 磁性纳米粒子的磁饱和强度约为51.7emu/g,剩磁强度M 约为0.5emu/g,磁矫顽力Hc约为3.2Oe,占磁性 Fe3O4纳米粒子饱和磁化强度的82.46%。这个结果进一步说明实验合成的磁性 Fe3O4@SiO2@CS 微球具有较强的饱和磁化 强度。
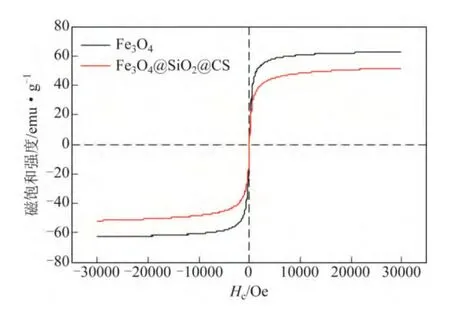
图6 Fe3O4 磁性微球磁学性能分析
2.3 改性Fe3O4@SiO2@CS 对脱氨除臭菌的吸附试验
图7 为Fe3O4磁性微球对菌株吸附的对比试验图。可以看出,溶剂热法制备的FR@SiO2@CS 磁性微球对菌株的吸附速度较快(3 号瓶),在20min时吸附率达85.0%,活菌吸附量达2.11×106cfu/mL;共沉淀法制备的FG@SiO2@CS 磁性微球对菌株的吸附速度较前者相对较慢(2 号瓶),在30min 时达到最大值为67.7%,活菌吸附量为1.41×106cfu/mL,这也进一步证明FR 磁性粒子其分散与吸附性能优 于FG 磁性粒子。这一结果与一些研究人员的结论相符,且吸附率与活菌吸附量相对良好[18]。当45min后,磁性微球的吸附性能有下降趋势但并不明显,这可能是当吸附到一定程度,微球表面的菌株逐渐团聚导致少量脱落现象所导致。
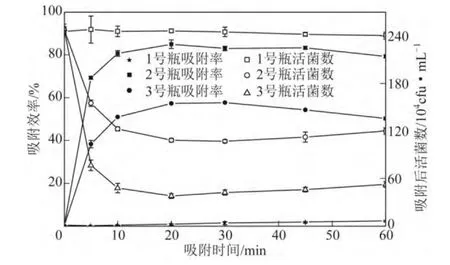
图7 不同方法制备的Fe3O4@SiO2@CS 磁性微球对菌株吸附率与活菌量的对比
2.4 固定化微胶囊包埋载体
图8 为包覆有Fe3O4@SiO2@CS(吸附菌株)磁性微球的PVA/海藻酸钠-CS 微胶囊小球。图8(a)微胶球呈球状,外表光滑,直径在400μm 左右。图8(b)为饱和微胶囊剖面结构,从图中可以清晰地看出,微胶囊的单核双壁结构分别为PVA/海藻酸钠复合膜与CS 膜,其壳厚度分别在120μm、30μm 左右。如图8(c)、(d)可知 ,饱和的微胶囊小球直径在2~3mm 左右,而脱水的胶球直径在0.4~1.0mm 左右,水分占80%以上,这非常适合菌株生长,并为菌株提供良好的营养与水分[19]。
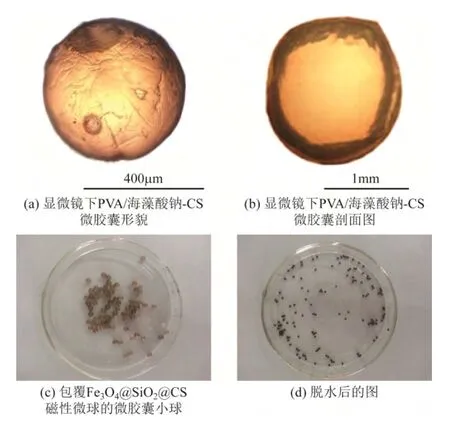
图8 包覆有Fe3O4@SiO2@CS(吸附菌株)磁性微球的PVA/海藻酸钠-CS 微胶囊小球
2.5 固定化载体在水中的脱氮性能
由图9(a)可知,在18h 之前固定化的菌株生长速度较游离菌株相对较慢,其原因主要是固定化菌株需要一定的活化过程[7]。18h 后,固定菌株繁殖速度加快, 42h 左右达到稳定期,OD600值达2.143,而游离菌株OD600值为1.630,说明在相同体积下固定化的菌株量比游离状态的菌株数量多。当氨氮初始浓度为100mg/L 时,固定化菌株在异养硝化培养基中48h 的培养,培养基中氨氮的浓度从100mg/L下降到27.73mg/L,去除率达72.26%;游离菌株在异养硝化培养基中48h 的培养,培养基中氨氮的浓度从100mg/L 下降到45.87mg/L,去除率达54.13%。这也进一步说明了在相同体积下固定化菌株量大于游离状态,具有良好的脱氨氮效果。由图9(b)可知,相同体积下固定化菌株量仍然大于游离状态,OD600最大值达2.116。在硝氮初始浓度为100mg/L 时,固定化菌株通过48h 的培养,培养基中硝氮的浓度从100mg/L 下降到25.44mg/L,去除率达74.56%;游离菌株在反硝化培养基中培养48h,培养基中氨氮的浓度从100mg/L 下降到40.83mg/L,去除率达 59.17%。以上均说明固定化菌株能更好了去除培养基中的氨氮与硝氮。
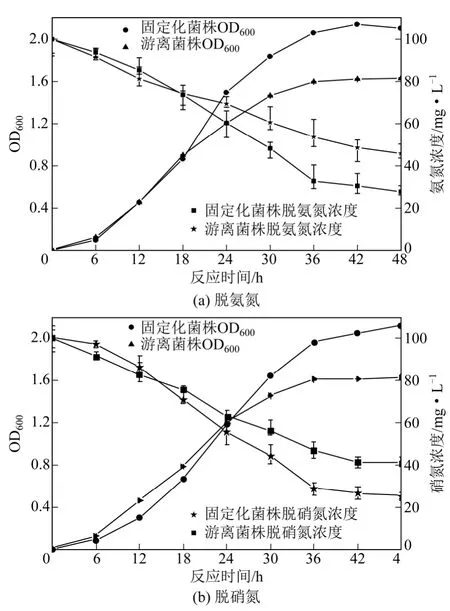
图9 菌株固定化胶球在培养基中生长及脱氨氮与硝氮 能力
3 结 论
(1)本研究运用共沉淀与溶剂热两种方法合成Fe3O4磁性纳米粒子并进行对比实验,结果显示溶剂热法制备的磁性粒子分散性优于共沉淀法。
(2)对Fe3O4磁性纳米粒子进行改性实验,(3-氯丙基)三甲氧基硅烷做偶联剂使SiO2很好的共价结合到磁性粒子表面,再通过反相乳液分散-化学交联法包覆壳聚糖,制备的磁性微球形状较均匀、分散性较好、粒径为 300nm 左右,壳聚糖在磁性纳米粒子表面的接枝率达 31.79%。
(3)改性后的溶剂热Fe3O4磁性纳米微球对菌株的吸附能力优于改性后共沉淀法制备的Fe3O4磁性纳米微球。FR@SiO2@CS 吸附20min 时,磁性微球对菌株的吸附率达到最大值为85%,活菌量为2.11×106cfu/mL;FG@SiO2@CS 吸附30min 时,磁性微球对菌株的吸附率达到最大值为67.7%,活菌量为1.41×106cfu/mL。
(4)研究发现固定化菌株比游离态菌株有更好的脱氮效果。在相同体积下,通过吸附-包埋的QDTN-34 菌株稳定期时其OD600在2.1~2.2 之间,48h 后对氨氮和硝氮的去除率分别达到72.26%和74.56%;游离状态的QDTN-34 菌株到达稳定期时其OD600为1.630,48h 后对氨氮和硝氮的去除率分别为54.13 %和59.17%。
[1] 张卫强,朱英. 养殖水体中氨氮的危害及其检测方法研究进展[J]. 环境卫生学杂志,2012,2(6):324-327.
[2] 黄国鑫,刘菲,黄园英,等. 零价铁与甲醇支持的生物-化学法去除富氧水中的硝酸盐氮[J]. 环境工程学报,2014,10(8):4254-4260.
[3] Lu H J,Chandran K,Stensel D. Microbial ecology of denitrification in biological wastewater treatment[J]. Water Research,2014(64):237-254.
[4] 缪应祺. 水污染控制工程[M]. 南京:东南大学出版社,2002:156-159.
[5] 肖晶晶. 固定化脱氮菌群处理含氮污水的研究[D]. 北京:中国农业科学院,2011.
[6] 张会萍,陈畅,侯文华,等. 陶粒固定化脱氮菌群对景观水中NO3¯-N 的去除[J]. 环境科学研究,2013,26(6):684-688.
[7] 刘少敏,储磊,朱敬林. 固定化硝化细菌去除生活污水中的氨氮[J]. 环境工程学报,2014,8(10):4261-4266.
[8] Pranee L,Duangcheewan B,Wiboonluk P,et al. Immobilization of nitrite oxidizing bacteria using biopolymeric chitosan media[J].Journal of Environmental Sciences,2013,25(2):262-267.
[9] 韩朝晖. 改性磁性微球对蛋白质纯化和细菌分离的研究[D]. 武汉:中南民族大学,2012.
[10] 张妍. 磁场作用下Pseudomonas sp. WQ-03 降解苯酚的试验研究[J]. 工业用水与废水,2009,40(1):32-35.
[11] 沈萍,陈向东. 微生物实验[M]. 第4 版. 北京:高等教育出版社,2007:51-55.
[12] 中华人民共和国环境保护部. HJ 535—2009,水质 氨氮的测定 纳氏试剂分光光度法[S]. 北京:中国环境科学出版社,2010.
[13] 陕红,张庆忠,张晓娟,等. 保存、分析方法等因素对土壤中硝氮测定的影响[J]. 分析测试学报,2013,32(12):1466-1471.
[14] 周利民. 磁性壳聚糖改性以及对金属离子的吸附特性研究[D]. 天津:天津大学,2007.
[15] Sheng F W,Yu M T. A novel amperometric immunosensor based on Fe3O4magnetic nanoparticles/chitosan composite film for determination of ferritin[J]. Anal. Bioanal. Chem.,2007,387:703-708.
[16] 陈志军,朱海燕,郝营,等. Fe3O4-壳聚糖磁性微球的制备及对Cu2+的吸附性能[J]. 郑州轻工业学院学报:自然科学版,2012,27(2):1-4.
[17] 郑红,韩景田,丁媛媛,等. 壳聚糖修饰磁性纳米粒子对BSA 的吸附性能[J]. 化工进展,2014,33(1):174-177.
[18] Hailan L,QingZ L,QingY C,et al. Detection of pathogen escherichia coli O157:H7 with a wireless magnetoelastic-sensing device amplified by using chitosan-modified magnetic Fe3O4nanoparticles[J]. Sensors and Actuators B:Chemical,2010,147:343-349.
[19] 王家荣,金谊,刘望才,等. 海藻酸钠-壳聚糖-海藻酸钠生物微胶囊的制备[J]. 宁波大学学报:理工版, 2007,20(4):516-519.

