糖尿病足发生鲍曼不动杆菌感染的危险因素及耐药性分析
王 敏,杨彩哲,关小宏
糖尿病足 (diabetic foot,DF)是糖尿病常见而严重的并发症之一,有研究指出我国糖尿病患者并发DF发生率为12%~25%[1],约20%的糖尿病患者因DF感染引起足部溃疡或坏疽[2],在DF合并溃疡的患者中40% ~80%合并感染[3],85%的足部溃疡最终需要截肢,其1、3、5年病死率分别为1% ~41%、20% ~50%、39% ~69%[1]。DF有别于普通创面,致病因素复杂、治疗难度大、病程长,对患者身体造成巨大痛苦,给个人及其家庭带来较高的精神和经济负担,对整个国家而言其带来的医疗开支也是巨大的。
DF合并感染患者的截肢风险是无感染者的150余倍,而糖尿病患者在神经性缺血的情况下易于被病原菌侵入,且创面渗出的糖类、蛋白质也利于细菌生长,故DF易诱发感染且难愈[4]。因此,预防和控制感染是DF研究的重点和难点。鲍曼不动杆菌 (acinetobacter baumannii,Ab)是一种需氧的革兰阴性菌,其基因组中含有孤立、小片段外源基因,以群居或两个相连生长为主,具有极高毒性,对多种抗生素抵抗耐受,是广泛流行的病原体。Ab虽不是DF感染中的首位病原菌,但Ab广泛耐药,一旦感染控制难度大。2010年及2011年中国CHINET细菌耐药性监测网统计数据显示,我国10省市14家教学医院临床分离细菌中Ab占革兰阴性菌的16.11%,位于第3位 (仅次于大肠埃希菌和肺炎克雷伯杆菌),Ab占伤口脓液分离革兰阴性菌的7.2%[5]。因此,分析Ab在DF感染中的相关危险因素及其耐药情况,对DF感染的防护具有特殊意义。临床鲜见此方面报道,本研究对感染Ab的DF患者情况进行观察,分析有关危险因素及耐药性的变化,为临床防治提供参考。
1 资料与方法
1.1 一般资料 2009年1月—2014年6月中国人民解放军空军总医院共收治住院糖尿病患者2 980例,其中确诊DF者655例。
1.2 纳入与排除标准 纳入标准:(1)糖尿病诊断符合2010年美国糖尿病学会标准:空腹血糖 (fasting plasma glucose,FPG)≥7.0 mmol/L和/或糖耐量试验2 h血糖 (two hours postprandial blood glucose,2 hPBG)≥11.1 mmol/L和/或糖化血红蛋白 (HbA1c)≥6.5%[6]。 (2)DF诊断标准符合1999年世界卫生组织定义:因高血糖所致的糖尿病患者足部感染、溃疡及深层组织破坏,与下肢远端神经异常、周围血管病变相关[7]。(3)符合DF的Wagner分级标准:0级高危足,有发生溃疡的危险但目前无溃疡;Ⅰ级浅表溃疡,临床一般无感染,常见于第1趾骨;Ⅱ级较深的溃疡,可合并疏松结缔组织炎但无脓肿或骨感染;Ⅲ级深部溃疡,常伴脓肿、骨组织病变或骨髓炎;Ⅳ级缺血性溃疡,局限性坏疽 (趾、前足背、足跟);Ⅴ级广泛坏疽,常需截肢[8]。 (4)DF感染分级符合2004年国际糖尿病足工作小组和美国感染协会制定的标准:Ⅰ级无感染、无症状者;Ⅱ级局部感染,感染限于皮肤或浅层皮下组织,出现局部皮温升高、疼痛、硬结、化脓、红斑(直径<2 cm)两种以上征象者;Ⅲ级全身情况良好,血糖水平控制良好,有疏松结缔组织炎 (直径>2 cm)、波散至浅筋膜下、深组织 (肌肉、肌腱、关节、骨)脓肿、局部淋巴结肿大之一者;Ⅳ级出现全身中毒症状或出现发热、寒颤、意识模糊、呕吐、严重高血糖或氮质血症、低血压、心动过速等代谢异常者[9]。(5)Ab感染:创面感染标本中检出Ab,DF确诊为Ab感染。
排除标准:(1)静脉曲张所致的下肢营养不良性溃疡;(2)自身免疫性疾病、血液系统疾病、肿瘤等;(3)处于妊娠、哺乳期。
1.3 分组方法 共235例患者符合纳入与排除标准,其中Ab感染者45例,作为A组;其余190例未发生Ab感染,采用随机数字表法并对应于A组时段选择60例作为B组。
1.4 检测方法
1.4.1 Ab鉴定 严格按照《全国临床检验操作规程》(第3版)原卫生部医政司制定的细菌分离、培养流程,用无菌棉拭子提取DF患者足部溃疡、坏疽部位伤口处的分泌物和/或脓液,并置于无菌试管内送检。将采集的标本涂于血琼脂平板上,在35℃恒温培养箱内培养24 h,运用全自动细菌分析仪(VITEK-2 Compact梅里埃公司,法国)及配套GN鉴定卡,在去除同一患者相同部位的重复菌落的情况下对菌株进行鉴定。每周用质控菌大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853(购自国家卫生和计划生育委员会临床检验中心)进行1次细菌室内质量检测及控制。
1.4.2 生化指标 入选者于空腹12 h后清晨采集静脉血,并离心分离血清,对FPG、2 hPBG、HbA1c、血清蛋白 (Alb)、三酰甘油 (TG)、低密度脂蛋白胆固醇 (LDL-C)、高密度脂蛋白胆固醇 (HDL-C)、总胆固醇进行检测。其中 FPG、2 hPBG、Alb、TG、LDL-C、HDL-C、胆固醇应用生化分析仪 (HITACHI 7600-020,日本日立公司)进行检测;HbA1c应用糖化血红蛋白分析仪 (As721883上海艾测电子科技有限公司)进行测定。
1.4.3 药敏试验 采用纸片扩散法 (K-B)进行药敏试验,药敏试验纸片购自赛默飞世尔科技公司,按照2010年临床和实验室标准协会抗微生物药物敏感性试验的执行标准和规则进行判读。药敏试验纸片包括:头孢曲松、头孢他啶、头孢吡肟、头孢哌酮舒巴坦、环丙沙星、阿米卡星、左氧氟沙星、亚胺培南、美罗培南、四环素、多粘菌素、哌拉西林、米诺环素、哌拉西林钠他唑巴坦钠。
1.5 统计学方法 采用SPSS 19.0软件进行统计学分析,计量资料以 (±s)表示,采用t检验;计数资料的分析采用χ2检验;DF患者发生Ab影响因素的分析采用多因素Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 两组患者性别、收缩压、舒张压比较,差异均无统计学意义 (P>0.05);A组患者年龄高于B组,BMI大于B组,糖尿病病程长于B组,差异均有统计学意义(P<0.05,见表1)。

表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
表2 两组患者生化指标比较 (±s)Table 2 Comparison of biochemical indicators between the two groups
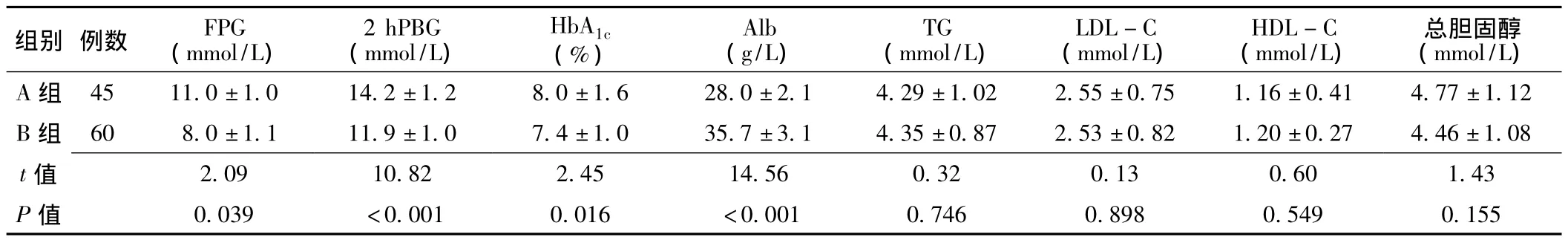
表2 两组患者生化指标比较 (±s)Table 2 Comparison of biochemical indicators between the two groups
注:FPG=空腹血糖,2 hPBG=糖耐量试验2 h血糖,HbA1c=糖化血红蛋白,Alb=清蛋白,TG=三酰甘油,LDL-C=低密度脂蛋白胆固醇,HDL-C=高密度脂蛋白胆固醇
组别 例数 FPG(mmol/L)2 hPBG(mmol/L)HbA1c(%)Alb(g/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)总胆固醇(mmol/L)A 组 45 11.0 ±1.0 14.2 ±1.2 8.0 ±1.6 28.0 ±2.1 4.29 ±1.02 2.55 ±0.75 1.16 ±0.41 4.77 ±1.12 B 组 60 8.0 ±1.1 11.9 ±1.0 7.4 ±1.0 35.7 ±3.1 4.35 ±0.87 2.53 ±0.82 1.20 ±0.27 4.46 ±1.08 t 155 2.09 10.82 2.45 14.56 0.32 0.13 0.60 1.43 P 值 0.039 <0.001 0.016 <0.001 0.746 0.898 0.549 0.值
表3 不同DF感染分级患者生化指标比较 (±s)Table 3 Comparison of biochemical indicators in DF patients between two infection grades

表3 不同DF感染分级患者生化指标比较 (±s)Table 3 Comparison of biochemical indicators in DF patients between two infection grades
感染分级(级) 例数 FPG(mmol/L)2 hPBG(mmol/L)HbA1c(%)Alb(g/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)总胆固醇(mmol/L)Ⅰ ~ Ⅱ 12 10.8 ±1.6 13.9 ±1.9 8.0 ±0.9 27.9 ±1.8 4.18 ±0.88 2.47 ±0.53 1.11 ±0.65 4.71 ±0.85Ⅲ ~ Ⅴ 33 11.1 ±1.1 14.8 ±1.0 8.8 ±1.2 28.0 ±0.6 4.31 ±0.21 2.58 ±0.68 1.20 ±0.33 4.80 ±0.63 t 0.78 1.97 2.37 0.41 0.80 0.51 0.61 0.39 P 值 0.439 0.055 0.023 0.683 0.427 0.616 0.542 0.702值
2.2 两组生化指标比较 两组TG、LDL-C、HDL-C、总胆固醇水平比较,差异均无统计学意义 (P>0.05);A组FPG、2 hPBG、HbA1c水平均高于B组,Alb水平低于B组,差异均有统计学意义 (P<0.05,见表2)。
按照Wagner感染程度标准划分,A组中Ⅰ~Ⅱ级感染者12例,Ⅲ~Ⅴ级感染者33例,两者生化指标比较,仅Ⅰ~Ⅱ级感染者HbA1c水平低于Ⅲ~Ⅴ级者,差异有统计学意义 (P<0.05);其余各指标比较,差异均无统计学意义 (P>0.05,见表3)。
2.3 单因素分析 单因素分析结果显示,住院天数、感染前使用抗生素、HbA1c、Alb水平是DF感染Ab的危险因素 (P<0.05,见表 4)。
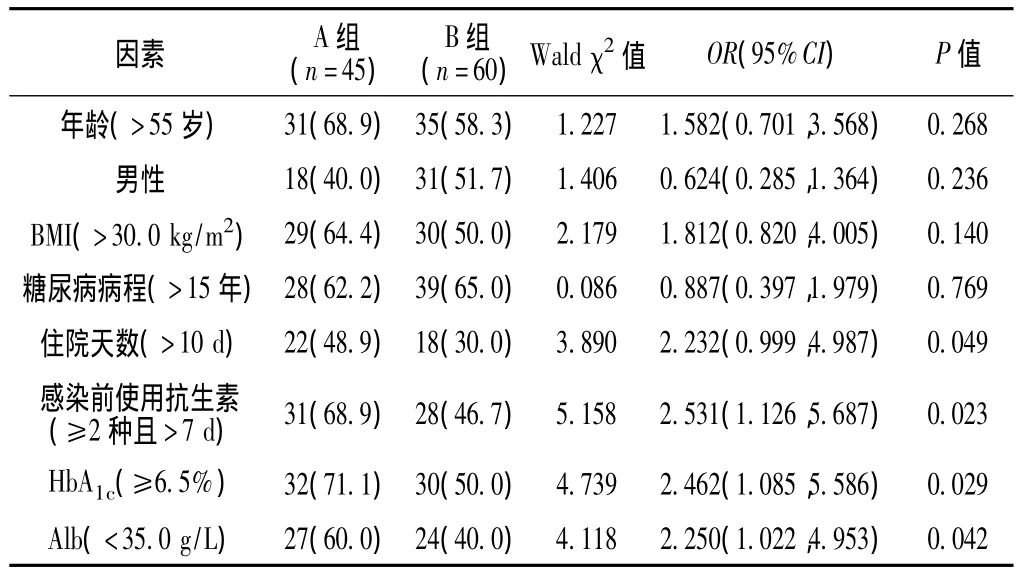
表4 DF患者感染Ab影响因素的单因素分析Table 4 Univariate analysis on influencing factors for DF patients infected with Ab
2.4 多因素分析 参阅Ab感染情况的临床报道结合本研究单因素分析结果,以糖尿病病程、住院天数、感染前使用抗生素、HbA1c、Alb为自变量,以DF患者是否感染Ab为因变量进行多因素Logistic回归分析,结果显示,住院天数 (>10 d)、感染前使用抗生素 (≥2种且 >7 d)及 HbA1c(≥6.5%)、Alb(<35.0 g/L)水平是 DF感染 Ab的危险因素(P<0.05,见表 5)。Logistic回归方程为:ln〔P/(1-P)〕=-25.033+0.197×住院天数 +1.712×感染前使用抗生素 +0.560×HbA1c+0.499×Alb。当各变量均取1时,预测概率(P)为95.07%。
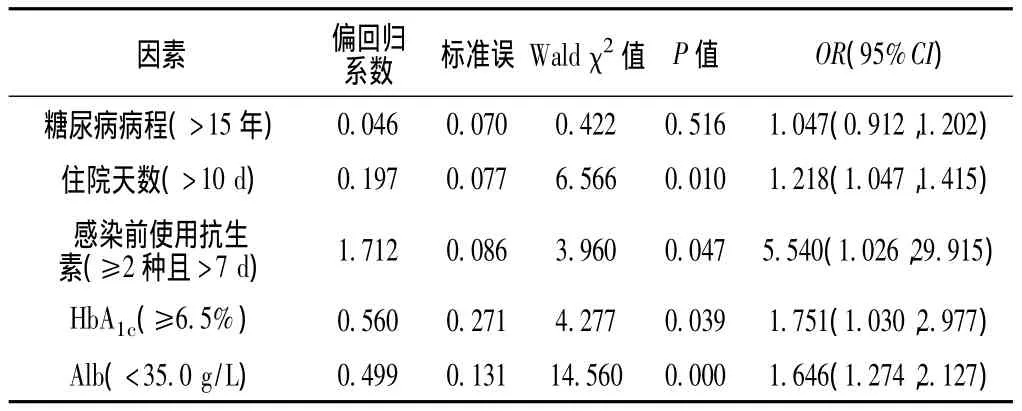
表5 DF患者感染Ab影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic analysis on influencing factors for DF patients infected with Ab
2.5 药敏分析 2009—2011年DF感染Ab者15例,2012—2014年DF感染Ab者30例。2009—2011年与2012—2014年感染Ab者多粘菌素、米诺环素耐药率比较,差异无统计学意义 (P>0.05);其他抗生素Ab耐药率比较,差异均有统计学意义 (P<0.05,见表6)。Ab对头孢曲松、头孢他啶、头孢吡肟、亚胺培南、美罗培南、哌拉西林、哌拉西林钠他唑巴坦钠的耐药率在近3年增长迅速,均在80.0%以上。Ab对环丙沙星、阿米卡星、左氧氟沙星、四环素的耐药率在近3年的增长率接近50.0%。

表6 不同时间监测抗菌药物敏感性Table 6 Monitoring of antimicrobial susceptibility in different time ranges
3 讨论
糖尿病是一种严重危害人类健康的慢性疾病,在世界范围内呈流行趋势,且发病率逐年递增。Wilds等[10]预测,到2030年,全球糖尿病患者将达3.66亿 (患病率达4.40%)。世界卫生组织和国际糖尿病联合会 (IDF)预测,全球糖尿病患者在未来15年将增加1倍,发展中国家的比率将更高[11]。1980年我国糖尿病患病率不足1%,1994年为2.5%,2000—2001年为4.2%,2007—2008 年为9.7%,2010 年为 11.6%[12-14]。徐瑜等[15]在2010年中国糖尿病调查报告的分析中指出,2010年我国糖尿病患者约1.139亿,糖尿病前期人群为4.934亿,糖尿病已经成为我国重大公共卫生问题。糖尿病主要的并发症之一为DF,本次观察的2 980例确诊糖尿病患者中有655例发生了DF(22.0%)。Ab曾被认为是低毒力的条件致病菌,近年来Ab感染率不断增加,成为主要的院内感染致病菌之一。本次观察的655例DF患者中,有45例确诊为Ab感染者(6.9%)。赵艳红等[16]对2011年4月—2013年6月奉化市各大医院收治的160例DF患者进行耐药菌鉴定,其中不动杆菌属4株 (5.3%)。黄德斌等[17]对本院内分泌和骨科2006年9月—2011年3月收治的DF患者进行病原菌培养鉴定,在51株病菌中不动杆菌有4株 (7.8%)。
本研究单因素分析结果显示,A组与B组年龄、性别、BMI、糖尿病病程均无显著差异。与马明远等[18]和王海立等[19]研究结果一致。对A、B两组生化指标观察发现,A组FPG、2 hPBG、HbA1c均高于B组,Alb低于B组,提示血糖水平偏高、Alb偏低与DF感染Ab有关。在单因素分析中,HbA1c、Alb、住院天数、抗生素使用情况的OR值均>1,提示此4项均是DF发生Ab感染的相关危险因素。通过多因素分析,住院天数、抗生素使用情况及HbA1c、Alb水平为DF感染Ab的独立危险因素。陈春艳[20]对院内感染Ab患者进行危险因素分析时认为感染前抗生素使用天数、数目是Ab感染的危险因素。刘成军等[21]认为,住院总天数、抗生素使用天数是多重耐药鲍曼不动杆菌 (MDRAB)医院获得性肺炎的独立危险因素。罗婉莹等[22]指出,HbA1c、Alb是铜绿假单胞菌感染的独立危险因素。因此,HbA1c、Alb水平是否与DF感染的多种病原菌相关,尚有待进一步研究观察。此外,本研究结果显示,DF感染Ab的严重分级与HbA1c水平相关。Liu等[14]对284例DF患者观察时发现,86.5%的患者HbA1c>6.5%,且指出HbA1c是重型DF发生及截趾/肢的危险因素。可见,HbA1c水平不仅是DF患者发生Ab的危险因素,且是危险严重度的表现。
Ab具有强大的耐药性和克隆传播性。Ab的耐药机制主要包括:(1)药物靶位改变,主要包括利福霉素类抗生素、β内酰胺类、喹诺酮类、大环内酯类、氨基糖苷类抗生素的靶位改变;(2)产生抗生素的灭活酶或钝化酶,主要有氨基糖苷类钝化酶和β内酰胺酶;(3)细菌主动药物排外机制,通过排外泵将已经扩散至细菌体内的药物排除膜外;(4)细菌胞膜通透性降低,阻碍抗生素进入膜内靶位点;(5)细菌生物被膜形成,减少药物渗透,降低对抗生素的敏感性,产生免疫逃逸[23]。Ab的遗传方式主要有固有耐药和获得性耐药[24]。2002年台湾学者报道了几乎对所有抗生素耐药的不动杆菌[25]。2011年由32位国内知名专家发起,326位专家参与探讨而形成的《中国鲍曼不动杆菌感染诊治与防控专家共识》对MDRAB定义为:对抗假单胞菌头孢菌素、氟喹诺酮类抗菌药物、抗假单胞菌碳氢霉烯类抗生素、氨基糖苷类抗生素、含有β内酰胺酶抑制剂的复合制剂这5类抗菌药物中至少3类耐药,若全部耐药仅对1~2种抗菌药 (主要是多粘菌素、替加环素)敏感的为广泛耐药鲍曼不动杆菌 (XDRAB)[26]。本研究45例DF感染Ab患者中,有20例发生MDRAB,有5例发生XDRAB,治疗难度均较大,其中XDRAB有3例发展为截趾/肢。
本研究对2009—2014年DF患者Ab耐药情况进行监测,Ab对14种抗生素的耐药率均呈上升趋势,其中,对头孢吡肟、阿米卡星、亚胺培南、美罗培南、哌拉西林钠他唑巴坦钠的耐药率增长均大于60%,尤以对亚胺培南的耐药率增长最高。Héritier等[27]报道,法国一家大学医院烧伤病房在2003—2004年爆发亚胺培南耐药Ab院内感染;2005年Jeon等[28]报道,韩国一家医院发生了对亚胺培南耐药的Ab引起的院内感染。提示Ab耐亚胺培南较常见,临床用药应注意选择。2010年中国CHINET监测不动杆菌对亚胺培南、阿米卡星、环丙沙星、头孢他啶、头孢吡肟、美罗培南的耐药率均在50%以上[29],与本次观察结果吻合。戎群芳等[30]在总结2006年1月—2011年9月儿童重症监护病房的99例Ab感染者资料时发现,Ab的耐药水平呈明显上升趋势,Ab在2006—2008年对头孢吡肟、美罗培南、阿米卡星、环丙沙星、头孢哌酮舒巴坦的耐药率均<30%,而2009—2011年均在50%以上。
综上所述,DF感染Ab的危险因素包括住院时间、感染前抗生素使用情况及HbA1c、Alb水平。因此,在DF患者的治疗中应增强消毒意识、做好隔离措施,贯彻执行《多重耐药菌及其感染管理制度》;科学合理使用抗生素,根据药敏试验结果尽量使用窄谱抗菌药,Ab对多粘菌素、米诺环素的耐药性较低,在发生Ab感染时可联合用药;严格控制血糖水平,降低感染和感染后的恶化程度。
[1]张净.臭氧治疗对糖尿病足影响及作用机制研究 [D].广州:南方医科大学,2010.
[2] Fu YL,Li JB,Zhang YM.Pathogenic bacteria causing diabetic foot infections and analysis of risk factors[J].Chinese Journal of Nosocomiology,2013,23(15):3629-3633.(in Chinese)
付永丽,李婧波,张宜默.糖尿病足感染病原菌耐药性及相关危险因素分析[J].中华医院感染学杂志,2013,23(15):3629-3633.
[3] Chow I,Lemos EV,Einarson TR.Management and prevention of diabetic foot ulcers and infections:a health economic review [J].Pharmacoeconomics,2008,26(12):1019-1035.
[4] Yang XJ,Zhang C,Qi WS,et al.Analysis of drug resistance in Acinetobacter baumannii in intensive care unit and relation with traditional Chinese medicine syndrome[J].Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care,2007,14(4):222-224.(in Chinese)
杨秀捷,张晨,齐文升,等.重症加强治疗病房鲍曼不动杆菌耐药性分析及其与中医证候的关系[J].中国中西医结合急救杂志,2007,14(4):222-224.
[5] Zhu DM,Wang F,Hu FP,et al.CHINET 2010 surveillance of bacterial resistance in China[J].Chinese Journal of Infection and Chemotherapy,2011,11(5):321-329.(in Chinese)
朱德妹,汪复,胡付品,等.2010年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2011,11(5):321-329.
[6] American Diabetes Association.Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2010,33 Suppl 1:S81-90.
[7] ApelqvistJ, BakkerK, Van Houtum WH, et al. Practical guidelines on the management and prevention of the diabetic foot:based upon the International Consensus on the Diabetic Foot(2007)Prepared by the International Working Group on the Diabetes Foot[J].Diabetes Metab Res Rev,2008,24 Suppl 1:S181-187.
[8] Liu SP,Zhang Z,Zhou ZG.Clinical analysis of 284 diabetic foot cases[J].Chinese Journal of Arteriosclerosis,2013,21(3):257-261.(in Chinese)
刘石平,张志,周智广.284例糖尿病足患者的临床分析 [J].中国动脉硬化杂志,2013,21(3):257-261.
[9]涂静.糖尿病周围血管病变及糖尿病足的危险因素分析 [D].武汉:华中科技大学,2013.
[10] Wilds S,Roglic G,Green A,et al.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030 [J].Diabetes Care,2004,27(5):1047-1053.
[11] In W,Gruber N,Lander T,et al.The Economics of Diabetes and Diabetes Care(2007).A Report of Diabetes Health Economics Study Group[J].The Indian Journal of Medical Research,2007(125):473-482.
[12]全国糖尿病研究协作组调查研究组.全国14省市30万人口中糖尿病调查报告 [J].中华内科杂志,1981,20(11):678-683.
[13] Pan XR,Yang WY,Li GW,et al.Prevalence of diabetes and its risk factors in China,1994.National Diabetes Prevention and Control Cooperative Group [J].Diabetes Care,1997,20(11):1664-1669.
[14] Liu S,Wang W,Zhang J,et al.Prevalence of diabetes and impaired fasting glucose in Chinese adults,China National Nutrition and Health Survey,2002 [J].Prev Chronic Dis,2011,8(1):A13.
[15] Xu Y,Bi YF,Wang WQ,et al.Prevalence and control of diabetes in Chinese adults - the interpretation of a 2010 China Noncommunicable Disease Surveillance report[J].Chinese Journal of Endocrinology and Metabolism,2014,30(3):184-186.(in Chinese)
徐瑜,毕宇芳,王卫庆,等.中国成人糖尿病流行与控制现状——2010年中国慢病监测暨糖尿病专题调查报道解读 [J].中华内分泌代谢杂志,2014,30(3):184-186.
[16] Zhao YH,Li H,Fan HH.Distribution and drug resistance of pathogenic bacteria in diabetic foot infection [J].Chinese Journal of Hospital Infection,2014,24(7):1620-1622.(in Chinese)
赵艳红,李红,范惠惠.糖尿病足部感染的多耐药菌分布及耐药性分析[J].中华医院感染学杂志,2014,24(7):1620-1622.
[17] Huang DB,Li XX,Shao F,et al.Risk factors for infections of the diabetic foot with multidrug resistant microorganisms[J].Chinese General Practice,2012,15(5):1689-1692.(in Chinese)
黄德斌,李晓行,邵芬,等.糖尿病足发生多重耐药菌感染的危险因素分析[J].中国全科医学,2012,15(5):1689-1692.
[18]Ma MY,Xu J,Yu N,et al.Analysis of drug resistance of acinetobacter baumannii and its related factors in ICU[J].Chinese Critical Care Medicine,2013,25(11):686-689.(in Chinese)
马明远,徐杰,于娜,等.综合ICU内鲍曼不动杆菌的耐药性和相关因素分析 [J].中华危重病急救医学,2013,25(11):686-689.
[19] Wang HL,Sui WJ,Wang JR,et al.Risk factors for acquired multidrug- resistantAcinetobactor baumanniicolonization in respiratory intensive care unit[J].National Medical Journal of China,2012,92(14):960-963.(in Chinese)
王海立,隋文君,王俊瑞,等.呼吸重症监护病房患者多重耐药鲍曼不动杆菌获得性定植的危险因素分析[J].中华医学杂志,2012,92(14):960-963.
[20]陈春艳.院内感染鲍曼不动杆菌临床特征、耐药性及危险因素分析[D].郑州:郑州大学,2012.
[21] Liu CJ,Long JH,Li J,et al.Analysis of risk factors of 27 cases of hospitalacquired pneumonia caused by pandrug - resistant acinetobacter baumannii in the pediatric intensive care unit[J].Acta Medicine University Scientiae ET Technologiae Huazhong,2013,42(2):219-222.(in Chinese)
刘成军,龙江海,李 静,等.儿科重症监护室27例广泛耐药鲍曼不动杆菌医院获得性肺炎的危险因素分析 [J].华中科技大学学报:医学版,2013,42(2):219-222.
[22] Luo WY,Zou YF,Rong XH.Analysis of risk factors of Pseudomonas aeruginosa infection in diabetic foot[J].International Journal of Laboratory Medicine,2014,35(10):1256-1260. (in Chinese)
罗婉莹,邹原方,荣秀华.糖尿病足合并铜绿假单胞菌感染的危险因素分析 [J].国际检验医学杂志,2014,35(10):1256-1260.
[23]李明,王超,刘跃平,等.鲍曼不动杆菌耐药机制的研究进展[J].现代中西医结合杂志,2013,22(4):449-452.
[24]周曙俊.ICU广泛耐药鲍曼不动杆菌性肺炎临床危险因素探讨及β内酰胺酶耐药基因分析[D].兰州:兰州大学,2013.
[25]胡智臻.鲍曼不动杆菌临床病例回顾性分析 [J].广州:广州医学院,2012.
[26] Markogiannakis H,Pachylaki N,Samara E,et al.Infections in a surgical intensive care unit of a university hospital in Greece [J].Int J Infect Dis,2009,13(2):145-153.
[27] Héritier C,Dubouix A,Poirel L,et al.A nosocomial outbreak of Acinetobacter baumanniiisolatesexpressing the carbapenem -hydrolysing oxacillinase OXA-58 [J].J Antimicrob Chemother,2005,55(1):115-118.
[28] Jeon BC,Jeong SH,Bae IK,et al.Investigation of a nosocomial outbreak of imipenem-resistant Acinetobacter baumannii producing the OXA-23 beta-lactamase in korea [J].J Clin Microbiol,2005,43(5):2241-2245.
[29] Chen BY,He LX,Hu BJ,et al.Chinese Bauman Acinetobacter infection diagnosis and prevention expert consensus[J].National Medical Journal of China,2012,92(2):76-85.(in Chinese)
陈佰义,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊治与防控专家共识[J].中华医学杂志,2012,92(2):76-85.
[30] Rong QF,Zhang YC,Wang C,et al.Risk factors and drug resistance of Acinetobacter baumannii infection in pediatric intensive care unit[J].Journal of Clinical Pediatrics,2012,30(1):25-28.(in Chinese)
戎群芳,张育才,王春,等.儿科重症监护病房鲍曼不动杆菌感染的危险因素与耐药性分析[J].临床儿科杂志,2012,30(1):25-28.

