产普鲁兰酶菌株ZXYG5的分离鉴定及其普鲁兰酶活性
孙会忠,王小东,宋月芹,朱金峰,李广良,孙明辉,侯小改
(1.河南科技大学农学院 ,河南洛阳471003;2.河南省烟草公司漯河市公司 ,河南漯河462000),
产普鲁兰酶菌株ZXYG5的分离鉴定及其普鲁兰酶活性
孙会忠1,王小东1,宋月芹1,朱金峰2,李广良2,孙明辉2,侯小改1
(1.河南科技大学农学院 ,河南洛阳471003;2.河南省烟草公司漯河市公司 ,河南漯河462000),
通过以支链淀粉为唯一碳源的分离培养基和以普鲁兰糖为唯一碳源的鉴别培养基复筛 ,从烟草甲(Lasioderma serri-corne)肠道中分离得到一株产普鲁兰酶菌株 ,编号为ZXYG5.该菌株在以普鲁兰糖为碳源的产酶培养基35℃、160 rűmin-1条件下发酵42 h时 ,普鲁兰酶活性达到最大值4.2 UűmL-1.通过光学显微镜和扫描电子显微镜的形态观察、生理生化特性和16S rDNA保守序列分析 ,将菌株ZXYG5初步鉴定为泛菌属Pantoea sp. ,命名为Pantoea sp.ZXYG5.该菌株具有较高的初始产普鲁兰酶活性 ,可作为常规诱变育种和全基因组育种的良好备选菌株.
普鲁兰酶;肠道细菌;分离;16S rDNA;酶活性
淀粉酶主要分为4大类 ,分别是α-淀粉酶(α-amylase ,EC3.2.1.1)、β-淀粉酶(β-amylase ,EC3.2.1.2)、葡萄糖淀粉酶(glucoamylase ,EC3.2.1.3)和脱支酶(isoamylase ,EC3.2.1.9).普鲁兰酶(pullulanase ,EC3.2. 1.41)属于脱支酶范畴 ,它只水解糖原或支链淀粉分支点的α-1 ,6糖苷键 ,使支链淀粉脱支形成长短不一的直链淀粉[1].自然界的淀粉大多含有80%的支链淀粉[2],所以 ,普鲁兰酶是淀粉高效利用不可缺少的关键酶 ,是微生物功能酶研究的热点之一[3-5].但不同来源的普鲁兰酶对底物的作用专一性不同 ,因此 ,普鲁兰酶产生菌的筛选分离工作一直在进行.截至目前 ,除了丹麦NOVO公司成功研发的由酸性普鲁兰芽孢杆菌生产的普鲁兰酶外[6],文献报道的绝大多数野生菌株活性普遍较低 ,即使是通过基因工程技术构建的工程菌株[7-9],也远没有达到理想的发酵产酶效果.所以 ,筛选分离发酵产酶活性较高的产普鲁兰酶菌株仍然是一项长期而艰巨的工作.
资料显示 ,动物肠道菌在发酵产酶方面往往更具优势 ,而且在产酶活性、生物安全等方面也更容易得到保障[10].昆虫是一个种类多、数量庞大的生物群体 ,从其肠道中分离各类有益菌也逐渐得到重视[11 ,12].烟草甲(Lasioderma serricorne)是一种隶属窃蠹科(Anobiidae)的世界性昆虫[13],该虫具有取食广泛、生存能力强的特点 ,主要以幼虫蛀食贮存期烟叶、粮粒、药材等农资而完成生活史发育.迄今为止 ,关于烟草甲内生细菌来源的产普鲁兰酶菌株分离鉴定方面的研究尚未见报道.基于以上背景 ,本文拟以烟草甲为试验材料 ,分离鉴定产普鲁兰酶菌株 ,旨在丰富高效产普鲁兰酶菌株生物资源库.
1 材料与方法
1.1 试验材料
烟草甲:采自河南科技大学农学院烟草研究室烤烟仓储室.
固体分离培养基:蛋白胨8 gűL-1,酵母提取物6 gűL-1,支链淀粉3 gűL-1,NaCl 5 gűL-1,琼脂粉18 gűL-1,蒸馏水定容 ,pH 7.0.
鉴别培养基:蛋白胨6 gűL-1,酵母提取物4 gűL-1,NaCl 5 ,普鲁兰糖2 gűL-1,琼脂粉18 gűL-1,蒸馏水定容 ,pH 7.0.
LB种子培养基:蛋白胨10 gűL-1,酵母粉5 gűL-1,NaCl 5 gűL-1,蒸馏水定容 ,pH 7.0.
产酶培养基:普鲁兰糖3 gűL-1,酵母粉10 gűL-1,KH2PO40.5 gűL-1,K2HPO40.5 gűL-1,FeSO40.01 gűL-1,MgSO47H2O 0.5 gűL-1,蒸馏水定容 ,pH 7.0.
1.2 试验方法
1.2.1 产普鲁兰酶菌株的筛选 从仓储烤烟上挑取8头4龄健康烟甲虫老熟幼虫 ,先饥饿24 h ,用无菌水冲洗 ,然后用灭菌细线将分别口器和肛门两端绑扎.接着用75%乙醇进行体表浸泡消毒3 min ,再用0.1 molűL-1升汞消毒3 min ,在超净工作台中将消毒后的虫体固定于蜡盘解剖 ,取肠道 ,并划破 ,用无菌水冲洗内容物 ,收集于灭菌离心管.加入0.5 mL无菌水稀释后 ,分别取20 μL、50 μL、80 μL不同体积稀释液涂布于固体分离培养基 ,恒温培养箱中30℃培养48 h后 ,选取典型菌落连续进行3次平板划线纯化 ,并将纯化菌种斜面4℃保存.
通过固体分离培养基初筛后 ,将初筛菌株转接于普鲁兰糖鉴别培养基.30℃恒温培养48 h ,滴加卢氏碘液 ,将具有水解圈者初步确定为具有普鲁兰酶活性菌株.
1.2.2 产普鲁兰酶菌株的产酶活性测定 粗酶液制备:将具有水解圈菌株接种到装有50 mL LB种子培养基的三角瓶中 ,35℃、160 rűmin-1摇床培养16 h ,然后取6 mL转接于装有75 mL产酶培养基的1 000 mL三角瓶中 ,相同条件下摇床培养58 h ,期间每隔4 h取样1次 ,发酵上清液即为粗酶液.
采用DNS法对粗酶液进行酶活性测定[14].
1.2.3 菌株的鉴定 应用普通光学显微镜和扫描电子显微镜对菌株进行形态观察[15];生理生化指标测定方法参考文献进行[16 ,17].菌株的16S rDNA分析:将ZXYG5菌株接种于LB液体培养基 ,37℃ ,200 rű min-1摇床培养12 h ,获取菌液.采用TaKaRa MiniBEST Bacterial Genomic DNA Extraction kit Ver.2.0试剂盒提取ZXYG5基因组DNA.
16S rDNA PCR扩增引物为:正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′ ,反向引物:1492R:5′-TAGGGTTACCTTGTTACGACTT-3′.PCR扩增体系(20 μL):10×Ex Taq PCR buffer 2 μL ,dNTP(10 mmolű mL-1)1.6 μL ,正、反向引物(20 μműmL-1)各1 μL ,DNA模板1 μL ,Ex Taq DNA聚合酶0.2 μL ,双蒸水13.2 μL.扩增程序:94℃预变性5 min;94℃变性45 s ,50℃退火45 s ,72℃延伸1 min 40 s ,循环30次;72℃最终延伸10 min.目的片段长度为1.5 kb左右 ,PCR产物经过1%琼脂糖凝胶电泳 ,目的条带采用TaKa-Ra MiniBEST Agarose Gel DNA Extraction kit Ver.3.0进行胶回收 ,回收产物与TaKaRa pMDTM18-T Vecter连接 ,并将重组质粒转化于DH5α感受态细胞 ,37℃培养过夜 ,经蓝白斑筛选 ,挑选阳性克隆摇菌 ,测序由北京奥克鼎盛生物科技有限公司完成.
将测序获得的ZXYG5的16S rDNA碱基序列提交NCBI进行相似性比对 ,并采用MEGA 6.06软件的Neighbor-Joining方法构建系统发育进化树.菌株鉴定按照参考文献进行[18 ,19].
2 结果与分析
2.1 产普鲁兰酶菌株的分离
通过固体分离培养基的分离培养 ,获得一株水解圈大而显著的菌株 ,编号为ZXYG5;将初筛菌株ZXYG5再通过普鲁兰糖鉴别培养基的鉴别培养 ,进一步明确该菌株具有较高的普鲁兰糖降解活性(图1) ,故将ZXYG5确定为目标菌株.
2.2 菌株ZXYG5的产普鲁兰酶活性测定
对ZXYG5菌株采用DNS法进行普鲁兰酶活性测定 ,结果显示 ,在ZXYG5菌株的发酵产酶历程中 ,发酵42 h时 ,普鲁兰酶活性达到最高4.2 UűmL-1,说明该菌株具有较高的产普鲁兰酶活性(图2).与同类文献资料相比 ,无论从产普鲁兰酶活性和发酵周期来看 ,ZXYG5菌株都具有一定的优势 ,是下游研究良好的备选菌株 ,具有一定的开发应用潜力.

图1 ZXYG5在普鲁兰糖平板上的水解圈Fig.1 Hydrolysis circle of strain ZXYG5 in pullulan plate
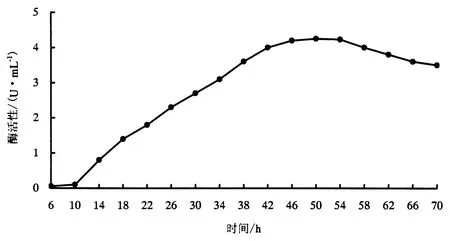
图2 ZXYG5菌株的普鲁兰酶活性Fig.2 Enzyme production of strain ZXYG5
2.3 菌株ZXYG5的鉴定
2.3.1 菌株ZXYG5的形态特征 ZXYG5菌株为杆型细菌 ,大小(0.5-1.6)μm×(0.8-2.5)μm ,无荚膜 ,能运动.在LB平板上35℃培养48 h ,菌落近圆形 ,边缘不整齐 ,直径2-3 mm ,表面光滑 ,扁平 ,有黄色素产生(图3A ,B).扫描电镜下放大到60 000倍时 ,可见菌体的两端钝圆 ,具周生鞭毛(图3C).
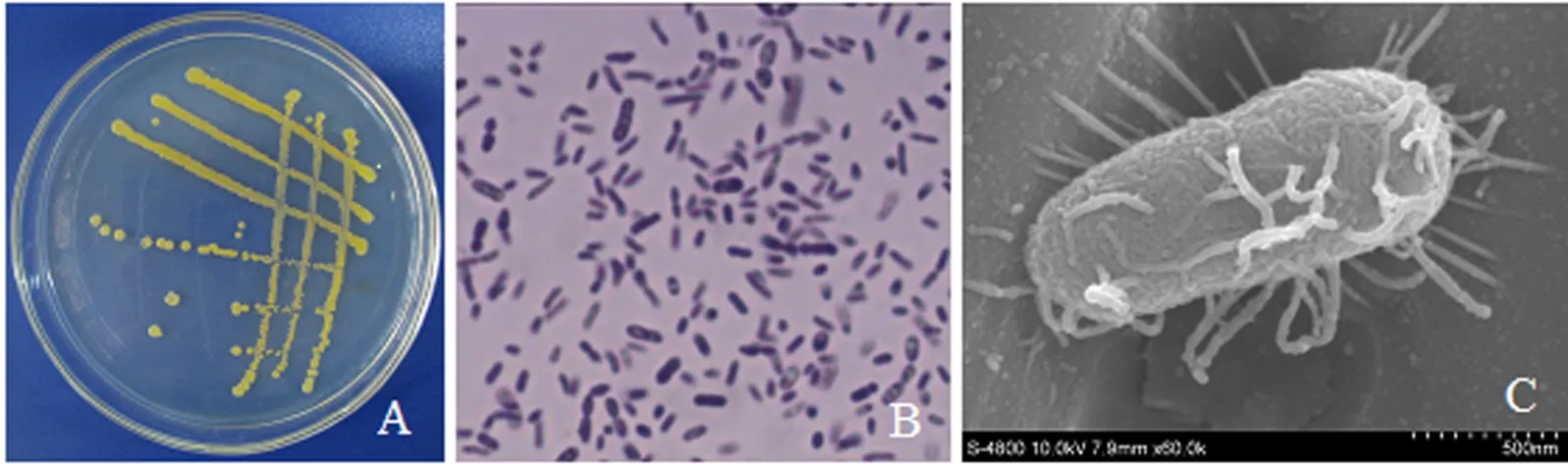
图3 ZXYG5菌株的形态特征Fig.3 General characteristics of strain ZXYG5 colony
2.3.2 ZXYG5菌株的生理生化鉴定 ZXYG5菌株的生理生化测定结果表明 ,结果与文献[18]和[19]中泛菌属(Pantoea)的描述基本一致(表1).

表1 ZXYG5菌株的生理生化指标测定结果1)Table 1 Physiological and biochemical indexes of strain ZXYG5
2.3.3 菌株ZXYG5的16S rDNA分析 通过测序 ,获得ZXYG5菌株的16S rDNA基因序列长度为1501 bp ,序列号为KR362557.将基因序列提交NCBI(美国国家科技情报研究中心)的BLAST进行在线相似性比对 ,并选取相似度高的序列构建ZXYG5的系统发育进化树(图4).结果显示 ,ZXYG5与肠杆菌科(Enter-obacteriaceae)泛菌属(Pantoea)的Pantoea sp.GYPB18(JF346891)等聚为同一分支 ,且它们相似度达到83% ,说明它们遗传进化关系最近 ,再综合形态特征、生理生化特性 ,初步将菌株ZXYG5鉴定为泛菌Pan-toea sp. ,命名为Pantoea sp.ZXYG5.
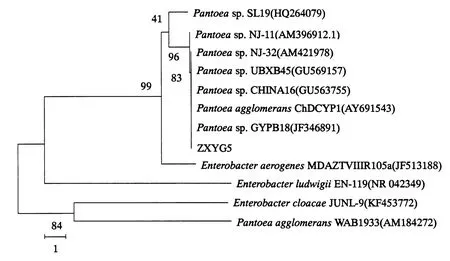
图4 基于16S rDNA基因序列的ZXYG5系统发育进化树Fig.4 Phylogenetic tree based on 16S rDNA gene sequences of ZXYG5
3 讨论
文献报道的产普鲁兰酶微生物资源主要类群有:海栖热袍菌(Thermotoga maritima)、嗜热厌氧乙醇杆菌(Thermoactinomyces ethanolicus)、Bacillus flavocaldarius、嗜热脂肪芽孢杆菌(B.Stearothermophilus)、多形拟杆菌(B.Thetaiotaomicron)、克雷伯肺炎菌(Kiebsiella.Pneumoniae)、热解纤维素菌属(Caldicellulosiruptor sac-charolyticus)、嗜热厌氧闪光杆菌(Fervidobacterium pennavorans)等[1 ,3 ,4],但真正用于工业化生产的菌株却极少.原因主要有两个 ,一个是相当一部分产酶菌株是从土壤中分离获得 ,而许多土著野生菌株并不适合发酵产酶;二是很多菌株产酶活性大幅度提高的潜力有限 ,即使是通过基因操作构建了表达工程菌 ,也往往达不到理想的发酵产酶效果.随着交叉学科的不断深入发展 ,人们已逐渐将筛选分离产普鲁兰酶菌株的范围拓展到新的领域 ,如动物内生菌、植物内生菌、极端环境、深海环境等 ,并已初见成效[2-4 ,7-8].郭宏文等[20]研究表明 ,产普鲁兰酶菌株PUG12的初始产酶活性为0.64 UűmL-1,发酵条件优化后经64 h发酵 ,酶活性达到2.45 UűmL-1;马晓军等[21]筛选出一株产普鲁兰酶菌株Bacillus sp.SX-12 ,初始酶活性为2.42 UűmL-1,经紫外线诱变后 ,经48 h发酵培养酶活性提高到6.87 UűmL-1.本研究从烟草甲肠道分离出的菌株ZXYG5在未优化发酵条件和诱变育种的情况下 ,菌株最高产普鲁兰酶酶活性就达到了4.2 UűmL-1,与部分同类文献相比 ,产酶活性和发酵周期均具有一定优势.另外 ,来源于动物内生性的产功能酶菌株 ,在酶活性的生物安全方面更容易得到保障[10],开发应用潜力更大 ,普鲁兰酶在食品、饲料领域使用广泛 ,所以ZXYG5具有较大的开发前景;从ZXYG5菌株多项分类鉴定结果的归属来看 ,还未见有泛菌属产普鲁兰酶菌株的报道 ,因此 ,ZXYG5菌株的分离、鉴定及产酶活性的确定 ,丰富了产普鲁兰酶菌株诱变育种和全基因组育种的遗传资源.
[1]袁振宏.能源微生物学[M].北京:化学工业出版社 ,2012:69-76.
[2]孙劭靖 ,路福平 ,姜楠 ,等.一株耐热普鲁兰酶菌株Anoxybacillus sp.LM14-2分离鉴定及酶学性质研究[J].生物技术通报 ,2011(9):136-140.
[3]焦豫良 ,王淑军 ,吕明生.GH57家族高温淀粉普鲁兰酶的结构与功能分析[J].微生物学报 ,2011 ,51(1):447-454.
[4]乔宇 ,丁宏标 ,王海燕.普鲁兰酶的研究进展[J].生物技术进展 ,2011 ,1(3):189-194.
[5]SUZUKI Y ,HATAGAKI K ,ODA H.A hyperthermostable pullulanase produced by an extreme thermophile ,Bacillus flavocal-darius KP 1228 ,and evidence for the proline theory of increasing protein thermostability[J].Appl Microbiol.Biotechnol ,1991 (34):707-714.
[6]郭宏文 ,江成英 ,冮洁 ,等.普鲁兰酶产生菌的筛选[J].科学研究 ,2008 ,29(9):52-55.
[7]KANG J ,PARK K M ,CHOI K H ,et al.Molecular cloning and biochemical characterization of a heat stable typeⅠpullula-nase from Thermotoga neapolitan[J].Enzyme Microb Technol ,2011 ,48(3):260-266.
[8]LI Y R ,ZHANG L ,NIU D D ,et al.Cloning ,expression ,characterization ,and biocatalytic investigation of a novel Bacilli thermostable typeⅠpullulanase from Bacillus sp.CICIM 263[J].Journal of Agricultural and Food Chemistry ,2012 ,60(44): 11164-11172.
[9]RÜDIGER A ,JORGENSEN P L ,Antranikian G.Isolation and characterization of a heat-stable pullulanase from the hyperther-mophilic archaeon Pyrococcus woesei after cloning and expression of its gene in Escherichia coli[J].Appl Environ Microbiol ,1995 ,61(2):567-575.
[10]徐丽华 ,娄恺 ,张华 ,等.微生物资源学(第二版)[M].北京:科学出版社 ,2010:243-249.
[11]王在贵 ,杨文静 ,刘朝良 ,等.家蚕肠道产蛋白酶菌株的分离与鉴定及其发酵条件[J].农业生物技术学报 ,2011 ,19(1): 149-156.
[12]王保军 ,刘缨 ,姜嘉 ,等.蝎子肠道内微生物多样性研究[J].微生物学报 ,2007 ,47(5):888-893.
[13]袁锋 ,张雅林 ,冯纪年 ,等.昆虫分类学[M].北京:中国农业出版社 ,2006:360-361.
[14]魏丙卓 ,孙杰.普鲁兰酶产生菌的筛选、鉴定及发酵条件研究[J].武汉生物工程学院学报 ,2008 ,4(8):174-177.
[15]谢家仪 ,董光军 ,刘振英.扫描电镜的微生物样品制备方法[J].电子显微学报 ,2005 ,24(4):440-440.
[16]刘国生.微生物学实验技术[M].北京:科学出版社 ,2007:141-155.
[17]黄亚东 ,时小燕.微生物实验技术[M].北京:中国轻工业出版社 ,2013:67-80 ,198-216.
[18]陶天申 ,杨瑞馥 ,东秀珠.原核生物系统学[M].北京:化学工业出版社 ,2007:313-322.
[19]陈瑜.临床常见细菌、真菌鉴定手册[M].北京:人民卫生出版社 ,2009:62-70.
[20]郭宏文 ,江成英 ,冮洁 ,等.普鲁兰酶产生菌的筛选[J].食品研究与开发 ,2008 ,29(9):52-55.
[21]马晓军 ,张晓君 ,王锐 ,等.碱性普鲁兰酶产生菌选育和发酵条件的研究[J].西北植物学报 ,2002 ,22(4):883-888.
(责任编辑:吴显达)
Isolation ,identification and enzyme activity of pullulanase-producing strain ZXYG5
SUN Hui-zhong1,WANG Xiao-dong1,SONG Yue-qin1,ZHU Jin-feng2,LI Guang-liang2,SUN Ming-hui2,HOU Xiao-gai1
(1.College of Agriculture ,Henan University of Science and Technology ,Luoyang ,Henan 471003 ,China;2.Henan Tobacco Companies Luohe branch ,Luohe ,Henan 462000 ,China)
After being inoculated with amylopectin and pullulan as sole carbon source successively ,strain ZXYG5 with potential of pullulanase production was isolated from gut of tobacco beetle(Lasioderma serricorne).The optimal fermentation condition was 35℃ ,160 rűmin-1and 42 h with maximum pullulan yield of 4.2 UűmL-1.Subsequent standard morphological observation ,physio-logical and biochemical property analysis ,and 16S rDNA sequencing test indicated strain ZXYG5 was Pantoea sp. ,and was named Pantoea sp.ZXYG5.Strain ZXYG5 with satisfactory initial pullulanase activity can be used as a good alternative to conventional mu-tation and genome breeding.
pullulanase;gut bacteria;isolation;16S rDNA;enzyme activity
Q939.9
A
1671-5470(2015)06-0629-05
10.13323/j.cnki.j.fafu(nat.sci.).2015.06.012
20150-02-25
2015-05-12
河南省烟草公司科学研究与技术项目(HYKJ2012M04、HYKJ201302);河南科技大学博士科研启动基金(4024-13480045、4026-13480047);上海烟草集团责任有限公司项目(SZBCW2014-00830).
孙会忠(1976-) ,男 ,副教授 ,博士.研究方向:生物资源学.Email:huizhong66@163.com.通讯作者王小东(1978-) ,男 ,副教授 ,博士.研究方向:烟草学.Email:lylhsys@126.com.

