异丙肾上腺素对大鼠心脏功能的动态影响
左 琳,宋 峰,赵 锐,李端端,石山慧,贺忠梅,刘慧荣
异丙肾上腺素对大鼠心脏功能的动态影响
左 琳1,2,宋 峰1,赵 锐3,李端端1,2,石山慧1,2,贺忠梅1,2,刘慧荣4
目的观察异丙肾上腺素(ISO)对在体大鼠心脏功能、心室肌细胞功能以及胞内相关下游蛋白表达的动态影响。方法采用血流动力学方法及乳鼠心肌细胞培养,观察ISO对在体及离体大鼠心肌收缩能力的影响;通过Fura-2荧光探针法观察ISO对成鼠心肌细胞内游离钙水平的影响;Western blot检测ISO下游胞内相关蛋白表达水平的变化。结果(5~500)nmo l/L ISO对成鼠在体心功能有一个剂量依赖性增强效应,100 nmo l/L为其最佳实验浓度:0.1μm o I/LISO作用大鼠心室肌细胞(1 000~1 200)s,胞内游离钙水平达高峰。0.1μmo I/LISO作用于乳鼠心肌细胞30min可使其跳动频率达高峰,维持至60min后开始下降,与胞内钙变化规律一致。心室肌细胞内钙调蛋白激酶Ⅱ(Calm odulin kinaseⅡ,CaMKⅡ)水平在ISO干预后3 h达高峰;G蛋白偶联受体激酶2 (GRK2)和β-arrestin也在ISO作用后48 h达高峰。结论 ISO可通过兴奋胞内Ca2+_CaMKⅡ信号通路参与心肌细胞功能活动的动态调节;同时,ISO长期作用可升高胞内GRK2-β-arrestin水平,参与受体的脱敏调节。
异丙肾上腺素;细胞内游离钙;心脏功能;钙调蛋白激酶Ⅱ;G蛋白偶联受体激酶2;β-arrestin
在心肌重构以及心衰的发生、发展过程中。体内儿茶酚胺类物质的长期持续升高是导致以上病理改变的主要原因[1]。长期持续存在的儿茶酚胺类物质可通过兴奋β1-肾上腺素受体(β1-AR),导致细胞内过去第二信使环磷酸腺苷(cAMP)水平的升高[2],激活蛋白激酶A(Pro tein Kinesse A,PKA)及下游信号通路引起心脏重塑、心功能降低,以致心力衰竭等严重后果[3]。
异丙肾上腺素(ISO)作为儿茶酚胺类物质的一种,可以同时作用于β1-AR和β2-AR[2],其中对于心脏的作用以兴奋β1-AR为主。医学基础研究中,ISO常被用于心律失常[4]及心肌重构[5]动物模型的制备,它同时也是实验最常用的β-AR激动剂。体内儿茶酚胺类物质长期作用会导致其靶受体的脱敏[6]。具有类激动剂样作用的β1-肾上腺素受体自身抗体(β1-AAbs)和ISO的作用类似[7],二者都可以激动β1-AR。本研究以ISO为切入点,观察ISO对大鼠心功能的动态影响,以及其下游信号通路的变化情况,以期为ISO的基础实验应用提供资料。
1 材料与方法
1.1 材料 健康雄性成年W istar大鼠及乳鼠,由山西医科大学实验动物中心提供。
1.2 方法
1.2.1 血流动力学测定[8]健康成年雄性SD大鼠20只,随机分为ISO处理组和PBS组。2%三溴乙醇(阿佛丁)腹腔麻醉后,沿颈部前正中线做一纵向切口,将带有探头的导管(TX)通过右颈总动脉进入左心室腔,通过左侧颈外静脉给入不同浓度的ISO,记录大鼠心功能的各项参数:心率、室内压上升和下降的最大速率(±dp/dtmax)。
1.2.2 乳鼠心肌细胞培养 出生(2~3)d的SD大鼠,采用组织块酶解法分离单个心肌细胞[9]。用F10完全培养基(10%胎牛血清,1%青链霉素)重悬细胞,按照1×106的密度接种于6孔板上,第二天施加处理因素,收集细胞用于Western blot实验。
1.2.3 胞内游离钙测定 采用Langendorff离体心脏灌流法分离单个心室肌细胞[10]。将分离获得的单个心室肌细胞与钙离子荧光指示剂Fura 2-AM(5 μm o l/L)避光孵育30min(37℃),PBS洗涤后,采用O lym pus FV1000采集ISO给药前后胞内游离钙水平的动态变化,用蔡司LSM 5软件分析胞内游离钙荧光强度的平均值(F值)。
1.2.4 Western b lo t[11]培养的乳鼠心肌细胞加入ISO(终浓度0.1μmo l/L),分别作用0.5 h、1 h、3 h、6 h、12 h、24 h、48 h、72 h后收集细胞标本,用4%~ 20%的梯度胶进行电泳;TBS-T洗膜后加显影剂(超敏发光液,App lygentechno logies Inc,北京),用KODAK X-OMAT blue Autoradiography进行显影。
2 结 果
2.1 ISO可剂量依赖性引起大鼠在体心功能的增强随着ISO剂量的增加,心功能逐渐增强。100 nmol/L ISO可使+dp/dtmax增加到(10 183±564.4)mmHg/s,显著高于PBS组(6 279±625.3 mmHg/s,P<0.05);同时,可使-dp/dtmax增加到(-8 163±475.2)mmHg/s,显著高于PBS组(-4 818±448.2 mmHg/s,P<0.05)。同时,ISO对心率也产生一个剂量依赖性的增强作用。在100 nmo l/L时,ISO可显著增加大鼠的心率(621± 7.8次/min,vs 507±11.7次/min PBS,P<0.05)。在ISO浓度达到100 nm ol/L以上时,其对心功能的增强作用逐渐减缓。详见图1。
2.2 ISO可诱发成鼠心肌细胞内游离钙水平先升高后降低 0.1μm o l/L ISO可对单个心室肌细胞0内游离钙水平产生一过性增强效应。加入ISO后400 s可出现游离钙水平的升高(612±34 vs PBS组509±13, P<0.05);1 000 s达到高峰(1 104±34 vs PBS组525±19,P<0.05),并维持约200 s;此后,游离钙水平开始快速下降;在ISO作用1 400 s时基本接近基线水平(719±19 vs PBS组530±14,P<0.05)。详见图2。
2.3 ISO可导致乳鼠心肌细胞跳动频率先增快后减慢的动态性改变 通过乳鼠心肌细胞跳动频率(图3A)的观察来进一步验证ISO的作用特点是否具有脱敏性。用ISO组与PBS组心率的比值来表示。0.1 μm o l/L ISO作用于跳动的乳鼠心肌细胞后,可时间依赖性增强心肌细胞的跳动频率,该效应在ISO作用后的30 min达高峰(2.46±0.10,P<0.05,vs PBS组,图3B),并维持至60 min(2.46±0.07,P<0.05,vs PBS组);此后,ISO对心肌细胞跳动频率的影响逐渐减弱,在作用后72 h基本恢复至基础水平。详见图3。

图1 ISO对成鼠心功能影响的血流动力学影响

图2 ISO对成鼠心肌细胞胞内游离钙水平的影响

图3 ISO对乳鼠心肌细胞跳动频率的影响
2.4 ISO可导致乳鼠心肌细胞中CaMKⅡ、GRK2及β-arrestin蛋白水平渐增高后降低 Western blot检测结果显示:0.1μm o l/L ISO作用于乳鼠心肌细胞后,可在作用后3显著升高细胞内CaMKⅡ水平(0.48± 0.004,P<0.05,vs 0.27±0.004 0 h),此后CaMKⅡ水平逐渐下降,在24 h时接近给药前水平(0.26± 0.004,P>0.05,vs 0 h),并一直维持至48 h;72 h的CaMKⅡ的胞内水平略有下降,低于给药前水平(0.17± 0.005,P<0.05,vs 0 h)。细胞内GRK2水平在ISO作用后3h开始显著升高(0.57±0.0 06,P<0.05,vs 0 h 0.48±0.002),并在48 h达到高峰(0.88± 0.005,P<0.05,vs 0 h),72 h时GRK2略低于给药前水平(0.46±0.002,P>0.05,vs 0 h)。β-arrestin的检测结果显示:在ISO作用后的观察时间内,β-arrestin水平从3 h开始升高(0.42±0.004,P<0.05,vs 0h 0.38±0.0 06),48 h达高峰(0.5 3± 0.003,P<0.05,vs 0 h),72 h时β-arrestin水平开始下降(0.44±0.011,P<0.05,vs 0 h)。详见图4。
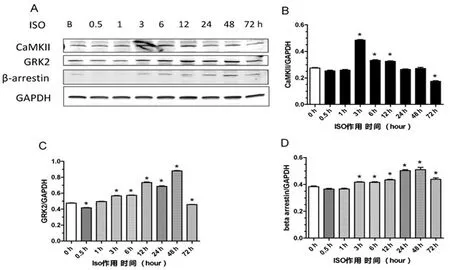
图4 ISO对乳鼠心肌细胞内CaMkⅡ、GRK2以及βa-rrestin表达的影响
3 讨 论
心衰过程中,体内存在儿茶酚胺类物质升高现象[12],这些物质长期存在会通过兴奋心肌细胞膜表面的β1受体引起心脏正性调节作用[13],但其在体内长期高水平存在时,机体会保护性下调位于心肌细胞膜表面的β1受体密度[14],以此来对抗儿茶酚胺类物质的作用,也称为脱敏现象。ISO也是一类重要的儿茶酚胺类物质[15]。在基础实验研究中,其常被用作β受体激动剂[16],但多数研究只把ISO当做对照,而对ISO生物学功能的研究常常不够深入,其脱敏现象的动态变化规律尚不十分清楚。
为了研究ISO对大鼠心肌细胞的脱敏性生物学效应及其可能的机制,本实验观察了ISO对正常大鼠在体心功能的剂量依赖性效应,结果表明:在(5~500) nmol/L浓度范围内,ISO对成鼠心功能有一个剂量依赖性的增强效应。在ISO浓度达到100 nmol/L时,± dp/d t以及心率的升高幅度都基本接近峰值;在500 nmol/L时,心功能增强已不十分显著。这与已有的研究报道相一致[17]。ISO对成年大鼠在体心功能有一个剂量依赖性的增强作用;100 nmol/L的ISO可产生比较显著的增强效应,因此,在接下来的实验中会以该浓度作为观察浓度。
Ca2+是和心肌收缩密切相关的偶联因子,其胞内水平的高低直接影响心肌收缩力的强弱[18]。本研究采用离子成像技术,观察了100 nmol/L ISO对成鼠心室肌细胞内游离钙水平的影响,100μmo l/L ISO作用400s时,胞内游离钙水平开始显著升高;在(1000~ 1 200)s时达高峰,此后又逐渐降低。ISO对在体心功能的增强效应是通过增加胞内游离钙水平实现的。与此同时,Ca2+下游的重要调节蛋白CaMKⅡ的水平在ISO干预后3 h达高峰,此后逐渐下降。ISO的作用可使收缩期内流进入细胞内的钙离子增多,其一方面可以直接通过和肌钙蛋白结合诱发肌肉收缩的增强[19];同时Ca2+还可与钙调蛋白结合,并活化下游的CaMKⅡ[20],有可能参与了心肌肥厚[21]、心律失常[22]以及心肌顿抑等疾病的发生发展过程。但在ISO作用1 200 s后,胞内游离Ca2+开始下降,出现这一变化的机制尚不十分清楚。
为了搞清楚ISO细胞内游离钙水平下降的原因,通过乳鼠心肌细胞培养动态观察了ISO对乳鼠心肌细胞跳动频率的影响。0.1μm o l/L ISO亦可导致乳鼠心肌细胞跳动频率的增加。在ISO干预后30 min,乳鼠心肌细胞的跳动频率达高峰,该效应维持至60 min后开始下降,在ISO作用72 h后,乳鼠心肌细胞跳动频率基本接近静息水平。这与以往的研究相一致[23],同时也能解释ISO对大鼠在体心功能影响的变化规律,但由于在体及离体实验条件的差异,因此,关键作用时间点并不完全重叠。
在心肌细胞膜受体脱敏研究中存在两个关键蛋白,即GRK2和β-arrestin。GRK2作为一种激酶,可以磷酸化底物蛋白-G蛋白-上的特定位点,使之不能与G蛋白偶联受体(GPCRs)结合,反而与β-arrestin结合,终止了GPCRs下游G蛋白信号的转导;而结合了GPCRs的β-arrestin可作为衔接蛋白进一步结合网格蛋白和β2衔接蛋白,形成内吞小窝,在动力蛋白Dynamin的帮助下形成胞吞囊泡,促进GPCRs的内化和脱敏[24]。因此,GRK2和β-arrestin表达的改变可在一定程度上代表GPCRs内化的程度。针对ISO干预后出现以上脱敏现象的可能原因,对ISO干预乳鼠心肌细胞后不同时间点的胞内相关蛋白水平进行了检测,参与受体脱敏调节的蛋白GRK2和β-arrestin也在ISO作用后出现了表达水平的上调,其中GRK2和β-a rrestin均在ISO作用4 8 h达高峰,此后开始下降。
ISO作为经典的β-AR激动剂,对心脏的早期效应表现为通过增加细胞内游离钙水平,产生正性调节作用,该效应具有剂量依赖性;ISO对心脏的晚期效应表现为生物学功能的脱敏,主要是由于胞内GRK2及β-a rrestin蛋白表达增加导致了该现象的发生。对于ISO作用后,心肌细胞膜表面β1-AR的密度及亲和力的改变将是进一步研究的重点。
[1] 彭应心.儿茶酚胺-β受体-cAMP系统在高血压和心力衰竭中的调控作用[D].杭州:浙江大学,2005.
[2] Lohse MJ,Engelhard t S,Eschenhagent.What is the role of beta-adrenergic signa ling in heart failure[J].Circ Res,2003,93: 896-906.
[3] Ma X,Song Y,Chen C,et al.Distinct actions of intermittent and sustainedβadrenocep to rstim ulation on cardiacrem odeling [J].Sci China Life Sci,2011,54(6):493-501.
[4] Kumar N,Aksoy I,Phan K,et al.Coronary spasm during card-i ac electrophysio logical study fo llow ing isop rotereno l infusion [J].Interv Med App l Sci,2014,6(4):183-186.
[5] W illis BC,Sa lazar-CantúA,Silva-Platas C,et al.Impaired oxidative m etabolism and ca lcium m ishand ling unde rlie card iac dysfunction in a ratmode l of post acu te isopro terenol-induced cardiom yopathy[J].Am J Physiol Heart Circ Physiol,2014:19.
[6] Cannavo A,Rengo G,Liccardo D,et al.β1-adrenergic receptor and sphingosine-1-phospha te receptor 1(S1PR1)reciproca l downregulation influences cardiac hypertrophic response and progression to heart failure:pro tective role of S1PR1 card iac gene therapy[J].Circu lation,2013,128(15):1612-1622.
[7] Zuo L,Zhao R,Wang L,et al.Presence of autoantibodies againstβ1-ad renocepto r aggrava tes the kidney inju ry in rats[J]. Acta Physio logica Sinica,2014,66(2):175-185.
[8] Gao E,Lei YH,Shang X,et al.A novel and efficient m odel of coronary artery liga tion and m yocardial infarction in the mouse [J].Circ Res,2010,107(12):1445-1453.
[9] Qian F,Mai Chen,Lin Zuo,et al.Myocardial ablation of G protein-coup led recepto r kinase 2(GRK2)decreases ischem ia/ reperfusion in jury through an anti-in trinsic apopto tic pathway [J].Plos One,2013,8(6):e66234.
[10] Wang W,Zhu W,Wang S,et al.Sustained beta1-ad renergic stimu lation modulates ca rdiac contractility by Ca2+/calmodulin kinase signaling pathway[J].Circ Res,2004,95(8):798-806.
[11] 左琳,王可,田珏,等.抗β1肾上腺素受体细胞外第二环自身抗体长期存在对大鼠心肌组织钙调蛋白激酶Ⅱδ-亚型表达的影响[J].中国心血管病研究,2009,7(8):604-608.
[12] Szentm iklosi AJ,Szentandrassy N,Hegyi B,et al.Chem istry, physiology,and pha rmaco logy of βAdrenergic m echanism sin the heart.Why areβ-b locker antiarrhythm ics superior[J].Curr Pharm Des,2015,21(8):1030-1041.
[13] Wengrowski AM,Wang X,Tapa S,et al.Optogenetic re lease of norepineph rine from card iac sym pa thetic neurons a lters mechanicaland electrica lfunction[J].Card iovas Res,2015,105(2): 143-150.
[14] de Lucia C,Femmine lla GD,Gam bino G,et al.Ad renal ad renoceptors in heart failure[J].Front Physiol,2014,5:246.
[15] Jing L,Wang Y,Zhao XM,et al.Cardiopro tective e ffect of hydrogen-rich saline on isop rotereno l-induced m yocardial in farction in rats[J].Heart Lung Circ,2014S1443-9506(14)00800-802.
[16] Copik AJ,Baldys A,Nguyen K,et al.Isoprote reno l acts as a b-i ased agonist of the alpha-1A-ad renoceptor that selective ly activates the MAPK/ERK Pathway[J].PloS One,2015,10(1): e0115701.
[17] W oodallMC,Cicca relliM,Wooda ll BP,et al.G protein-coup led recepto r kinase 2:A link be tween m yocardial contractile function and ca rdiac me tabo lism[J].Circ Res,2014,114(10):1661-1670.
[18] ZuÈhlke RD,Pitt GS,Deisseroth K,et al.Calmodulin supports bo th inactivation and facilitation of L-type ca lcium channe ls[J]. Natu re,1999,399(6732):159-162.
[19] Camors E,Moh ler PJ,Bers DM,et al.Ankyrin-B reduction enhances Ca spark-med iated SR Ca release p romo ting card iac myocyte arrhythm ic activity[J].JMol Cell Cardio l,2012,52(6): 1240-1248.
[20] Pagel PS,Kro likowski JG,Ne ff DA,et al.Inhibition of g lycogen synthase kinase enhances isoflurane-induced protection againstm yocard ial infarction du ring early reperfusion in vivo[J]. Anesthesia&Ana lgesia 2006,102(5):1348-1354.
[21] Branco AF,Sam paio SF,W ieckowski MR,et al.Mitochondrial disrup tion occurs downstream fromβad rene rgic ove ractivation by isopro terenol in d ifferentiated,but not und ifferentiated H9c2 cardiom yoblasts:Diffe rentia l activation of stress and su rvival pa thways[J].In t J Biochem Ce ll Bio l,2013,45(11):2379-2391.
[22] Pe reira L,Cheng H,Lao DH,et al.Epac2 mediates cardiacβ1 adrenergic-dependent sa rcop lasm ic reticu lum Ca2+leak and arrhythm ia[J].Circulation,2013,127(8):913-922.
[23] Panda S,Kar A.Combined e ffects of vincristine and que rcetin in reducing isop roterenol-induced cardiac necrosis in ra ts[J]. Ca rdiovasc Toxico l,2014,24.
[24] 范恒,廖奕,唐庆,等.βarrestin信号转导通路在炎症性肠病发生过程中的作用机制[J].世界华人消化杂志,2010,18(29): 3114-3120.
R285 R255
A
10.3969/j.issn.1672-1349.2015.05.011
1672-1349(2015)05-0589-05
2014-06-30)
(本文编辑 王雅洁)
国家自然科学基金青年基金资助项目(No.81200120);山西省回国留学人员科研资助项目(No:2014-036);山西医科大学细胞生理学省部共建教育部重点实验室主任基金(No.2010-14)
1.山西医科大学基础医学院生理学系(太原030001);2.山西医科大学细胞生理学省部共建教育部重点实验室;3.山西省儿童医院临床医学检验中心;4.首都医科大学基础医学院生理学与病理生理学系
刘慧荣,E-m ail:liuihr2000@126.com

