应用响应面法优化复合酶提取绣球菌多糖工艺
洪小君,林端权,王春莲,张增明,王益晨,郑明锋
(福建农林大学食品科学学院,福建 福州350002)
绣球菌(Sparassis crispa)又名绣球菇、花瓣覃、花椰菜菌等,是药食两用菌[1],具有抗肿瘤、抗病毒、促进人体新陈代谢、降低血压血脂、提高造血及免疫调节等功能[2-6]。多糖是绣球菌多种生理功能的最主要活性成分之一,其中以葡聚糖含量最高,可达40% -50%[7-8]。因此,提取绣球菌多糖具有良好的市场开发前景和经济价值。
酶法提取条件比热水浸提或酸法提取更为温和,不易引起多糖分子的降解,且能显著提高多糖提取率[9]。本文采用3 种酶复合协同辅助绣球菌多糖的提取,并进一步应用响应面法优化提取工艺,以提高绣球菌多糖提取率,为绣球菌的开发利用提供依据。
1 材料与方法
1.1 原料与设备
1.1.1 原料 绣球菌子实体由福州市福清火麒麟食用菌有限公司提供。
1.1.2 设备 UV-1800PC 型紫外分光光度计(上海美谱达仪器有限公司);XH-B 漩涡振荡仪(江苏康健医疗用品有限公司);低速大容量多管离心机(上海安亭科学医学仪器厂);KD-1000KC 型电子分析天平(奥豪斯仪器有限公司)。
1.2 试验方法
1.2.1 多糖提取及测定 将洗净的绣球菌子实体经过真空冷冻干燥,超微粉碎处理(过200 目筛)。干粉用缓冲液溶解并称取适量复合酶加入溶液中。混匀后,恒温水浴酶解180 min,灭酶,离心,上清液经浓缩加入其3 倍体积的95%乙醇溶液,4 ℃静置过夜,离心取沉淀。沉淀用无水乙醇洗涤后复溶,采用苯酚—硫酸法[10]进行多糖测定。测得的吸光度值通过葡萄糖标准曲线换算成葡萄糖质量,计算粗多糖提取率。

1.2.2 葡萄糖标准曲线的绘制 参考葡萄糖标准曲线[11],本试验标准曲线方程为:y =9.9675x +0.0572,R2=0.9974。
1.2.3 酶解工艺的优化 (1)酶解条件单因素试验。取适量绣球菌干粉,加入复合酶(纤维素酶0.6%、果胶酶0.6%、木瓜蛋白酶0.6%),酶解,固定其他条件,分别考察酶解pH 值(3.4、3.8、4.2、4.6、5.0、5.4、5.8)、酶解时间(1.0、1.5、2.0、2.5、3.0、3.5 h)、酶解温度(30、40、50、60、70、80 ℃)、液料比(5∶1、10∶1、15∶1、20∶1、25∶1、30∶1)等对多糖提取率的影响。每组平行3 次试验,取平均值。
(2)中心组合试验设计。在单因素试验的基础上,采用中心组合(central composite)试验设计进行4 因素3 水平试验,并对31 个试验点加以响应面分析。试验因子及水平编码如表1 所示,每组试验重复3 次,取平均值。

表1 中心组合试验设计因素水平表Table 1 Factors and levels of the central composite-design
2 结果与分析
2.1 单因素试验结果
2.1.1 pH 值 由图1 可知,绣球菌多糖提取率随着酶解pH 值的不断增大,呈现先升高后降低的趋势,在pH 值为4.2 时多糖提取率达到最大值,之后提取率逐渐降低。pH 值不仅影响酶活性,也影响酶的催化反应速度。在适宜的pH 下通过静电作用,酶活性中心的最佳三维构象得以较好维持,而在过酸或过碱条件下,酶和底物所带电荷、亲和力、酶的空间结构都会受到破坏,影响了酶与底物的结合[12],从而使多糖提取率下降,故选择pH 值为4.2。
2.1.2 酶解时间 由图2 可知,绣球菌多糖提取率在酶解时间达到3 h 后未继续增高,说明酶解的充分性与酶解时间密切相关。长时间的酶解将菌体中的物质溶出,达到了溶解平衡,即使酶解时间继续延长也无法显著提高多糖提取率。因此,考虑到实际操作及防止多糖水解,选用3 h 作为最佳酶解时间。
2.1.3 酶解温度 由图3 可知,随着酶解温度的提高,多糖提取率呈现先升高后降低的趋势,50 ℃时多糖提取率达到最高。由于酶解温度不仅影响酶催化反应速率,而且影响酶的活性,温度太低无法催化酶解反应,温度过高则会使酶活力减弱、变性、失活,甚至导致多糖变性,从而使得多糖提取率下降[13]。故本研究选择最佳酶解温度为50 ℃。
2.1.4 液料比 由图4 可知,绣球菌多糖提取率随着液料比增大不断升高,当液料比达到15∶1 时,多糖提取率最高,之后呈现降低的趋势。究其原因,可能由于加水太少则提取不彻底;加水太多,反应浓度降低,酶和底物结合的概率大大减小,从而使得浸提出的多糖量减少。因此,本研究选用15∶1 作为最佳液料比。

图1 pH 值对绣球菌多糖提取率的影响Fig.1 Effect of pH value on the polysaccharide extraction rate

图2 酶解时间对绣球菌多糖提取率的影响Fig.2 Effect of enzymolysis time on the polysaccharide extraction rate

图3 酶解温度对绣球菌多糖提取率的影响Fig.3 Effect of enzymolysis temperature on the polysaccharide extraction rate

图4 液料比对绣球菌多糖提取率的影响Fig.4 Effect of liquid-to-solid ratio on the polysaccharide extraction rate
2.2 应用响应面法优化绣球菌多糖最佳提取工艺
在单因素试验的基础上,本研究中心组合试验设计与试验结果见表2。

表2 响应面分析方案及试验结果1)Table 2 The design and results of the response surface analysis
2.2.1 回归模型的建立与检测 对表2 试验数据用多元回归拟合后,得到回归方程为:
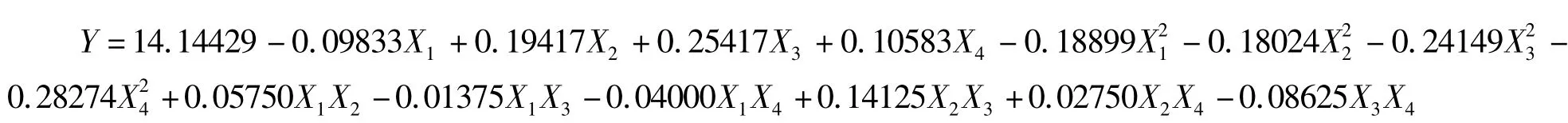
对该回归方程进行方差分析,结果见表3。由表3 可知,该模型达到极显著水平,失拟项不显著(P >0.05),决定系数R2为0.9890,说明该回归方程拟合度和可信度均很高,使用该方程模拟真实的四因子五水平的分析可行。在α=0.05 水平上,对指标值具有显著交互作用影响的为:X1X2、X1X4、X2X3、X3X4。剔除不显著项,简化后的回归方程为:Y = 14.14429 -0.09833X1+0.19417X2+0.25417X3+0.10583X4-0.18899X21-0.18024X22-0.24149X23-0.28274X24+0.05750X1X2-0.04000X1X4+0.14125X2X3-0.08625X3X4。

表3 回归模型方差分析1)Table 3 The variance analysis of the regression model
2.2.2 因素间交互效应分析 由表3 可知,在α =0.05 水平上,交互项X1X2、X1X4、X2X3、X3X4对提取率均有显著交互作用影响(图5 -8)。

图5 酶解pH 值与酶解时间对绣球菌多糖提取率的影响Fig.5 Effects of the pH value and time on polysaccharide extraction yield
对比响应面的三维立体图,在试验所选的范围内有极值,即响应面出现最高点,同时也是等值线最小椭圆的中心点。从图5 可见,在时间适中的情况下,pH 较高或较低都会影响多糖的提取率。而在特定的pH 下随着酶解的进行即使提高温度,多糖提取率也未呈现上升趋势。从图6 可见,在-2 到0 水平,多糖提取率均随着液料比和pH 值的提高呈现逐渐上升的的趋势,大于0 水平的情况下不利于多糖的溶出。温度对多糖提取率的影响大于时间对多糖提取率的影响(图7)。在特定的液料比和温度下,多糖提取率均呈现先增后减的趋势(图8)。

图6 pH 值与液料比对绣球菌多糖提取率的影响Fig.6 Effects of the pH value and liquid-to-solid ratio on polysaccharide extraction yield

图7 酶解温度与酶解时间对绣球菌多糖提取率的影响Fig.7 Effects of the time and temperature on polysaccharide extraction yield

图8 酶解温度与液料比对绣球菌多糖提取率的影响Fig.8 Effects of the temperature and liquid-to-solid ratio on polysaccharide extraction yield
基于以上分析可知,pH 值在4.2 左右、酶解时间3.0 -3.5 h、酶解温度50 -55 ℃、料液比在1∶14 -1∶16 之间,多糖提取率较高。总的来看,4 个试验因素对多糖提取率的影响不仅仅是单一的线性关系,平方项以及交互项之间对响应值也有较大的影响。
2.2.3 最佳条件及验证结果 对所建立的回归模型进行参数优化,得出最佳提取工艺条件为:酶解pH 值4.16、酶解时间3.41 h、酶解温度53.73 ℃、液料比15.63∶1,在此条件下多糖提取率可达14.33%。为检验响应面模型结果的可靠性,对此优化条件进行验证。考虑实际操作,选取酶解pH 值4.2、酶解时间3.4 h、酶解温度54 ℃、液料比16∶1 为条件,重复3 次,实测平均提取率为:14.12% ±0.52%,与预测值基本吻合,表明该回归模型具有较好的预测性,提取参数准确可靠,具有实用价值。
3 小结
本研究采用纤维素酶(0.6%)、果胶酶(0.4%)和木瓜蛋白酶(0.6%)复合提取绣球菌多糖。在单因素试验的基础上采用响应面法建立多糖提取率与酶解时间、酶解温度、酶解pH 值、液料比之间的二次回归模型,通过回归方程优化获得了最佳提取工艺参数为:酶解pH 值4.16、酶解时间3.41 h、酶解温度53.73℃、液料比15.63∶1。在此条件下提取率可达(14.12% ±0.52%),与预测值(14.33%)基本一致。综合来看,本模型具有较好的预测性能,对生产实践具有一定的借鉴意义。
[1]禹国龙,叶琳,苑世婷,等.绣球菌多糖的提取与抗氧化活性研究[J].天津农业科学,2013,19(4):11 -14.
[2]江晓凌,马璐,应正河,等.绣球菌的生物学特性研究[J].食药用菌,2012,20(6):341 -343.
[3]袁巍,潘宗琴,潘攀,等.真菌菌丝多糖的提取研究进展[J].安徽师范大学学报:自然科学版,2008,31(6):576 -579.
[4]应芝,励建荣,韩晓祥.响应面分析法优化桑叶多糖提取工艺的研究[J].中国食品学报,2008,8(4):39 -45.
[5]YOSHITOMI H,IWAOKA E,KUBO M,et al. Beneficial effect of Sparassis crispa on stroke through activation of Akt/eNOS pathway in brain of SHRSP[J]. Journal of Natural Medicines,2011,65(1):135 -141.
[6]黄建成,李开本,林应椿,等.绣球菌子实体营养成分分析[J].营养学报,2007,29(5):514 -515.
[7]崔丽霞,张莹,郑义,等.绣球菌多糖的提取工艺优化及其抗氧化作用[J].食品工业,2013,34(6):24 -27.
[8]薛道帆,周立平,何传俊,等.绣球菌的研究开发概况[J].杭州农业科技,2008(3):27 -29.
[9]赵前程,滕钊,汪秋宽,等.复合酶法提取海带多糖的研究[J].沈阳农业大学学报,2007,38(2):220 -223.
[10]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1998:10 -12.
[11]中华人民共和国农业部.GB/T 15672 -2009 食用菌中总糖含量的测定[S].北京:中国标准出版社,2009.
[12]于淑娟,高大维,李基,等.超声波酶法提取灵芝多糖的机理研究[J].华南理工大学学报,1998,26(2):123 -126.
[13]马春,董秀萍,朱蓓薇.复合酶法提取姬松茸胞内多糖[J].大连轻工业学院学报,2005,24(3):195 -198.

