‘阿里山’蝴蝶兰组织培养及其驯化移栽技术
林秀莲,马骁勇
(惠州农业学校,广东 惠州516023)
蝴蝶兰(Phalaenopsis spp.)属兰科蝴蝶兰属植物,有“兰中皇后”之美誉,观赏价值和经济价值较高,备受消费者青睐。引进台湾地区新品种可丰富蝴蝶兰市场,在引进新品种的同时,建立快速繁殖优化体系显得尤为重要。惠州市近年畅销的蝴蝶兰品种包括内山姑娘、大辣椒等,这些品种有性繁殖的品系后代易分离,颜色深浅不一,随着栽培年数的增加,易发生颜色淡化等品种退化现象。组织培养技术可以克服这些问题。从现有文献资料[1-5]来看,蝴蝶兰的组织培养技术较为成熟,但对生根组培苗驯化移栽研究相对较少,而生根苗的移栽成活率是商品效益高低的关键因素之一[6],对移栽的基质、水分、温度、湿度等研究尤为重要。本文拟对台湾引进的大红蝴蝶兰新品种‘阿里山’进行花梗诱导、丛生芽增殖、生根培养等研究,并初步分析了该品种的驯化移栽技术,以期建立简便、实用、高效的产业化蝴蝶兰繁殖体系,满足花卉市场需求。
1 材料与方法
1.1 材料
‘阿里山’蝴蝶兰取自惠州绿湖公司蝴蝶兰圃,为温室栽培的2年生优良蝴蝶兰品种。3月份花开过后,剪取生长健壮、无病虫害的‘阿里山’花梗。选择天气晴朗的下午进行采样。
1.2 方法
1.2.1 花梗诱导 将剪下的花梗用洗衣粉浸泡10 min,流水冲洗30 min 左右,置于超净工作台,用酒精消毒30 s,升汞消毒8 -10 min,再用无菌水清洗。在1/4MS +0.3 mg·L-1NAA+20%蔗糖+7%琼脂的培养基上,分别添加2.0、3.0、4.0、5.0、6.0、7.0 mg·L-1BA,比较不同BA 浓度对花梗诱导芽的影响。培养基代号分别为Ⅰ1-Ⅰ6,pH 值为5.8,在1.1 kg·cm-2、121 ℃下消毒20 min。每个处理40 瓶,每瓶接种1个花梗芽,每3 天观察记录1 次,14 d 后统计污染率:污染率/% =污染植株总数/接种总数×100,30 d 后统计诱导分化率:诱导分化率/% =植株分化总数/接种总数×100。
1.2.2 丛生芽增殖 在1/2MS+20%蔗糖+7%琼脂+200 mL·L-1椰汁的培养基上,分别添加6.0、7.0、8.0 mL·L-1BA 与0.2、0.5、0.8 mL·L-1NAA,比较不同BA、NAA 浓度对丛生芽增殖的影响。培养基代号分别为Ⅱ1-Ⅱ9,pH 值为5.8,在1.1 kg·cm-2、121 ℃下消毒20 min。每个处理40 瓶,每瓶接2 丛,每5天观察记录1 次,40 d 后统计增殖系数:增殖系数/% =40 d 后丛生芽数/接种数×100。
1.2.3 生根培养 以改良1/2KC 为基本培养基,添加30 g·L-1蔗糖、6 g·L-1琼脂、100 g·L-1香蕉泥,比较0、0.1、0.5、1.0、1.5 mg·L-1NAA 对生根的影响。培养基代号分别为:Ⅲ1-Ⅲ5,pH 值均为5.8,并在1.1 kg·cm-2、121 ℃下消毒20 min。选取2 cm 以上,有3 片完整叶片的无根苗转入生根培养基中培养生根。每个处理40 瓶,每瓶接种2 株,每3 天观察记录1 次,30 d 后统计生根率。
1.2.4 驯化移栽 将具有3 -4 片叶的‘阿里山’生根组培苗进行大棚驯化7、14、21、28 d,以水草为基质。每个处理30 株生根组培苗,设3 次重复,移栽45 d 后记录小苗长势情况。
1.3 培养条件
培养室、温室大棚温度(25 ±2)℃,生根培养与驯化移栽光照3000 lx,其他为暗培养,湿度保持在70%。
2 结果与分析
2.1 BA 浓度对‘阿里山’蝴蝶兰花梗诱导的影响
‘阿里山’蝴蝶兰培养25 d 后可见腋芽萌发(图1A)。培养14 d 后,测量污染植株总数及接种总数,统计‘阿里山’蝴蝶兰污染率(约90%),表明常规的消毒方法基本能够控制其污染率。培养30 d 后统计其诱导分化率(表1)。由表1 可知,BA 浓度太高或太低均不利于花梗的诱导分化。当BA 浓度为4 mg·L-1时,分化率最高,达82.5%。而过高或者过低的BA 浓度,均导致‘阿里山’蝴蝶兰分化率下降。

图1 ‘阿里山’蝴蝶兰组培过程Fig.1 Tissue culture of P.spp.cv.Ali Mountain
2.2 NAA、BA 浓度对‘阿里山’蝴蝶兰丛生芽增殖的影响
‘阿里山’蝴蝶兰增殖培养23 d 后陆续有新芽萌发(图1B)。NAA、BA 浓度对‘阿里山’蝴蝶兰增殖系数影响不同(表2)。由表2 可知,NAA 从0.2 mg·L-1增加到0.8 mg·L-1时,增殖系数不断提高。添加0.8 mg·L-1NAA 与7.0 mg·L-1BA 对‘阿里山’蝴蝶兰丛生芽增殖效果最佳。培养18 d后开始分化,增殖系数达306.3%。但随着BA 浓度的继续增加,其增值系数有下降趋势,这可能是由于高浓度的分裂素对丛生芽的分化有抑制作用。与此同时,表明NAA 与BA 具有协同作用。
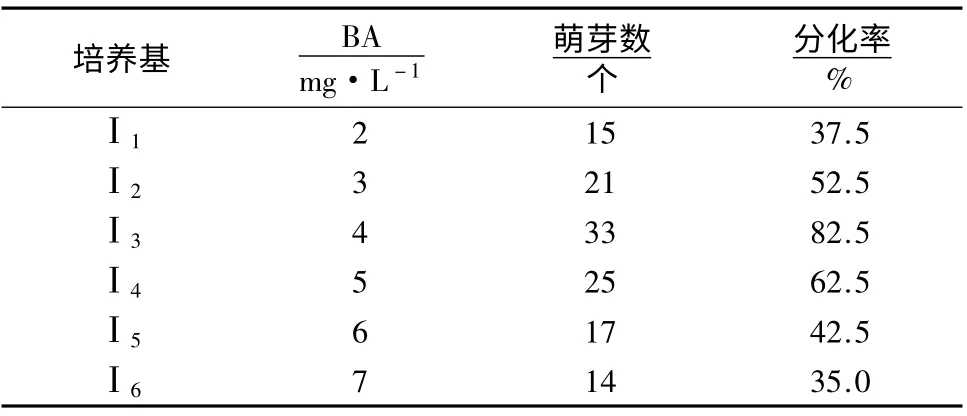
表1 BA 浓度对‘阿里山’蝴蝶兰花梗诱导的影响Table 1 Effect of BA concentration on pedicel inducing of P.spp.cv.Ali Mountain
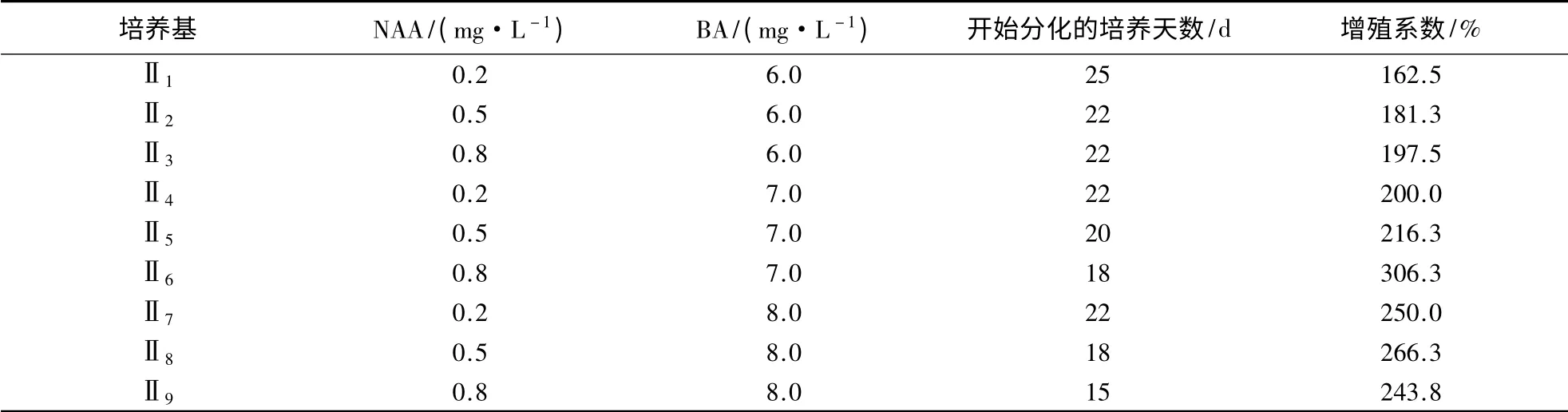
表2 NAA、BA 浓度对‘阿里山’蝴蝶兰丛生芽增殖的影响Table 2 Effects of NAA and BA concentrations on proliferation of bud clusters in P.spp.cv.Ali Mountain
2.3 培养基对‘阿里山’蝴蝶兰生根率的影响
‘阿里山’蝴蝶兰生根培养26 d 后陆续有新根长出(图1C)。NAA 浓度对‘阿里山’蝴蝶兰生根率的影响见表3。由表3 可知,添加1.0 mg·L-1NAA,‘阿里山’蝴蝶兰生根率最高,在8 d 左右就可见乳白色根系,且苗健壮、根长势较强,不添加NAA 或者NAA 浓度高于1.0 mg·L-1,其生根率均较低。该结果与谭鹏鹏等[5]研究结果相似,表明生长素有助于提高植物生根率,但生长素高于1.0 mg·L-1对‘阿里山’蝴蝶兰的生根反而有所抑制。

表3 NAA 浓度对‘阿里山’蝴蝶兰生根率的影响Table 3 Effect of NAA concentration on rooting of P.spp.cv.Ali Mountain
2.4 驯化时间对‘阿里山’蝴蝶兰组培苗移栽成活率的影响
驯化7、14、21、28 d 后将蝴蝶兰移栽至水草中,45 d 后记录移栽成活率。驯化7、14、21、28 d 后,移栽成活株数分别为19、21、25、28,成活率分别达63.3%、70.0%、83.3%、93.3%。表明在温度27 ℃、湿度约60% -70%时,驯化时间越长(28 d),‘阿里山’蝴蝶兰组培苗的移栽成活率越高,可达93.3%。与此同时,试验用蝴蝶兰常以水草为栽培基质,能够基本满足‘阿里山’蝴蝶兰的生长需求。
3 讨论
目前,‘阿里山’蝴蝶兰尚未在市面上普及,其组培技术的研究对整个蝴蝶兰花卉组培有一定的借鉴作用。本研究表明,以1/4MS 为基本培养基的无机盐浓度适合‘阿里山’蝴蝶兰的花梗诱导,同时1/2MS的无机盐浓度适合丛生芽的增殖快繁,这与钟海丰等[7]研究一致。褐化是组织培养过程中常见的现象,也是较难克服的问题之一[8]。蝴蝶兰的褐变现象在花梗诱导期就出现,生根阶段添加香蕉泥能明显促进生根和苗的生长,香蕉泥不仅能缓冲pH 值,还含有天然的植物激素,能促进植物根系的形成[9-10]。本试验中增殖芽苗也不同程度出现了褐变现象,因此在今后的研究中,可通过添加香蕉汁来缓解褐变。
组培苗在无菌、有营养供给、适宜光照、温度、100%相对湿度环境中生长[6],但在驯化移栽过程中,环境发生了剧烈变化,如果不能谨慎处理好与环境因子的关系,就有可能造成大量死苗,进而影响整体经济效益。‘阿里山’蝴蝶兰更喜低温,因此,调节环境条件,特别是移栽前期的湿度与温度控制是提高移栽成活率的重要环节。
[1]张颖,郭晓东,王芳,等.蝴蝶兰组织培养快繁技术研究[J].北方园艺,2010(8):122 -124.
[2]王仁睿,李明福,翰林波,等.蝴蝶兰组织培养体系的建立及其关键技术研究[J].中国农学通报,2010,26(10):197-201.
[3]张敏,黄利斌,蒋泽平.蝴蝶兰组织培养生根影响因子的筛选[J].江苏林业科技,2011(1):20 -22.
[4]陈玲,徐信,李苇洁,等.蝴蝶兰组织培养技术研究进展[J].安徽农业科学,2011(5):2565 -2566.
[5]谭鹏鹏,彭方仁,江荣翠,等.蝴蝶兰丛生芽快繁体系的建立[J].林业科技开发,2013,27(4):80 -84.
[6]周文兰.蝴蝶兰组培苗的炼苗移栽技术研究[J].现代园艺,2013(6):6 -8.
[7]钟海丰,钟淮钦,黄敏玲,等.蝴蝶兰丛生芽增殖培养条件优化研究[J].福建农业学报,2013,28(7):675 -679.
[8]李杰,黄敏仁,王明庥,等.植物外源激素对大花蕙兰体胚发生影响的研究[J].北京林业大学学报,2005,27(4):35-38.
[9]蔡斌.蝴蝶兰快繁技术研究[D].扬州:扬州大学,2003.
[10]杨美纯,周歧伟,许鸿源,等.外部因子对蝴蝶兰叶片原球茎状体发生的影响[J].广西植物,2000,20(1):42 -46.

