PET-CT检测首发单相重度抑郁症患者神经环路的葡萄糖代谢水平
周群,李月峰,朱彦
(江苏大学附属医院影像科,江苏镇江212001)
PET-CT检测首发单相重度抑郁症患者神经环路的葡萄糖代谢水平
周群,李月峰,朱彦
(江苏大学附属医院影像科,江苏镇江212001)
目的:研究首发单相重度抑郁症患者神经环路中神经细胞的葡萄糖代谢水平。方法:选取30例健康受试者及30例首发单相重度抑郁症患者,每位受试者按0.2 mCi/kg静脉注射18F-FDG,PET-CT检测神经环路各脑区(包括海马、丘脑、额叶及扣带回)的最高标准摄取值(SUVmax)值。结果:与对照组相比,首发单相重度抑郁症患者双侧海马、丘脑、额叶及扣带回的SUV max均明显减低(P<0.001或P<0.05),其中双侧丘脑SUVmax在神经环路脑区中减低最明显。结论:首发单相重度抑郁症患者神经环路中的神经细胞受损,主要体现在神经细胞对能量的摄取利用上,丘脑尤为明显。
抑郁症;神经环路;PET-CT
抑郁症是一种以显著而持久的心境低落为主要临床特征,严重危害人类健康的疾病,神经环路的功能异常是其发病的基础。利用影像学手段对抑郁症患者神经环路功能进行探索已进行多年,并取得一定的成果。PET-CT的出现是医学影像学科发展历史的又一次革命性进步,可提供详尽的功能与代谢等分子信息。迄今,利用PET-CT对抑郁症患者神经环路进行研究的报道较少。本研究通过PET-CT检测首发单相重度抑郁症患者神经环路的葡萄糖代谢水平,旨在探讨其神经环路的功能改变规律,为抑郁症发病机制研究提供临床数据。
1 对象与方法
1.1 研究对象
抑郁组:选取江苏大学附属医院诊断为重度抑郁症的患者,并通过以下条件进行筛选:①未进行过任何药物治疗的首发单相抑郁症患者;②未接受过电休克等物理治疗;③未使用过影响神经递质及神经细胞代谢的药物;④ 排除其他精神疾病、脑器质性病变、药物依赖及肿瘤病变等;⑤近2周无感冒、发热及其他感染性病史。选取重度抑郁症患者30例,汉密尔顿抑郁量表评分(HAMD)均≥14分,男19例,女11例,年龄38~60岁,教育年限9~19年,身高158~180 cm,体质量45~85 kg,27例为右利手。
对照组:选取社区收集的健康志愿者30例,并符合以下条件:① 未服用过任何精神类药物及抗感染药物,近2周无感冒、发热及其他感染病史,HAMD<7分;②无MRI禁忌证、既往MRI或CT未检出脑器质性病变、直系3代未检出过任何精神类疾病及肿瘤病变。其中男21例,女9例,年龄40~62岁,教育年限9~19年,身高159~178 cm,体质量46~80 kg,28例为右利手。本研究经医院伦理委员会批准,全部受试者对本研究知情,自愿接受注射18F-FDG后进行PET-CT扫描,并签署知情同意书。两组一般资料具有可比性,见表1。
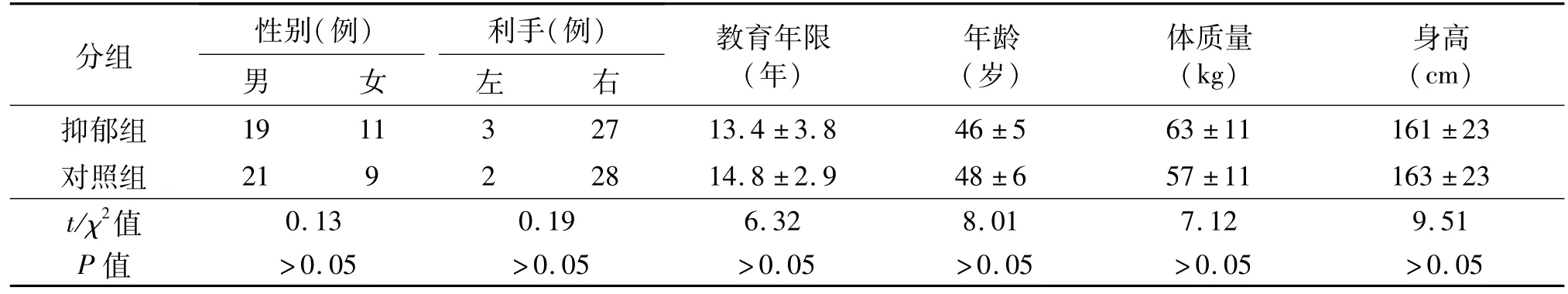
表1 抑郁组及对照组一般临床特征比较 n=30
1.2 图像采集
受试者检查前24 h禁烟酒,12 h内禁食,检查前夜保证充足睡眠,血糖值控制在5.0 mmol/L以下。显像方法:每位受检者按0.2 mCi/kg静脉注射18F-FDG。保持静息状态30 min,塞耳、闭眼以减少声光刺激。18F-FDG由加拿大EBCO TR19型医用回旋加速器生产,合成效率70%,放射化学纯度>95%。受检者保持平静呼吸,PET显像采用3D采集模式,1个窗位,计15 min。经衰减校正后行迭代法重建,获得横断、矢状、冠状面CT、PET及PET-CT融合图像,层厚5 mm。图像后处理使用最新的syngo TrueD VE12A工作站,所有图像均由2~3位有经验的影像医师共同阅片,对18F-FDG PET-CT显像结果进行分析,仔细观察解剖结构,在横断面上选取神经环路,包括海马、丘脑、额叶及扣带回,勾画感兴趣区(ROI),感兴趣区完全位于所测核团及皮层内,直径范围5~15 mm,得出最高的标准摄取值(SUV-max)。
1.3 统计学处理
2 结果
2.1 抑郁组及对照组PET-CT成像
两组受试者脑部结构均清晰成像,三维CT图像可清晰呈现脑回、脑沟池及兴趣区域的大体边界,PET图像亦清晰显示18F-FDG在脑内代谢情况,PET-CT融合图伪彩方式更直接地显示脑内结构及代谢分布。
2.2 两组多脑区及神经环路各部18F-FDG代谢比较
抑郁组多个脑区18F-FDG代谢低于对照组,见图1,以神经环路各部尤为明显,见图2。抑郁组双侧海马、丘脑、额叶及扣带回18F-FDG代谢显著低于对照组,其中双侧丘脑的变化最为明显;而两组间顶叶18F-FDG代谢无明显差异。见表2。
3 讨论
影像学方法是目前研究抑郁症神经环路结构及功能代谢的主要手段,诸如磁共振波谱成像分析(MRS)及功能性磁共振成像(fMRI)。Portella等[1]运用单体素氢质子磁共振波谱成像(1H-MRS)调查抑郁症患者在发病各阶段前额皮质腹正中的谷氨酸、胆碱和总天冬氨酸水平,发现缓解、复发和慢性发作患者的谷氨酸水平比首次发作及正常组低;而胆碱水平正好相反,且在慢性患者中胆碱值最高。fMRI研究显示[2-3],抑郁症患者大脑受到积极或有益刺激时,下丘脑、纹状体腹侧、海马旁回、前扣带回、额前叶周边部、岛叶、前额皮质背中线的活动度明显减低;相反,在接受消极刺激时,杏仁体、尾状核、前扣带回、额前叶周边部、额前回中上部的活动度显著增高。上述研究充分证实抑郁症患者存在神经环路结构及功能代谢的异常。PET-CT作为新型影像设备,与MRS及fMRI相比更具敏感性及定位准确性,如吴志国等[4]利用18F-FDG观察到难治性抑郁症患者存在边缘系统代谢增高和皮质代谢减低的交互性改变的异常代谢模式。

图1 抑郁组与对照组多脑区18 F-FDG代谢比较

图2 抑郁组与对照组各部18 F-FDG代谢比较

表2 抑郁组与对照组神经环路各部及顶叶SUVmax比较
本研究在发现抑郁症患者多个脑区18F-FDG代谢减低的同时,重点对神经环路各部18F-FDG代谢进行了分析。结果显示抑郁组双侧海马、丘脑、额叶及扣带回代谢均显著低于对照组,与此前研究报道基本一致。如Dome等[5]发现抑郁症患者发病期脑内存在神经元活动性减低,神经细胞凋亡、破碎,给予药物治疗后神经元代谢及凋亡现象明显好转;Wu等[6]利用fMRI成像证实抑郁症患者脑内特别是前额叶、海马及颞叶因血氧饱和度显著减低,神经元活动显著减低。本研究从另一层面提示抑郁症患者神经环路18F-FDG代谢(葡萄糖摄取)存在异常。
另外,本研究发现抑郁组与对照组各脑区中左右侧丘脑SUVmax差异最为明显,即抑郁组神经环路中代谢减低最显著脑区为双侧丘脑部。丘脑是间脑主要的也是最大的组成部分,对称性分布于第三脑室两侧,认知功能障碍及情绪变化与丘脑密切相关。牟君等[7]利用脑功能磁共振对抑郁症患者的丘脑进行了研究,发现抑郁组患者双侧丘脑乙酞天门冬氨酸盐(NAA)/肌酸-磷酸肌酸复合物(Cr)均低于正常对照组,提示抑郁症可能与丘脑神经元受损有关。Caroli等[8]通过磁共振波谱研究亦提示丘脑部的肌酸代谢与抑郁疾病程度呈正相关,而肌酸与葡萄糖代谢存在正对应关系。我们推测本研究中受试者双侧丘脑部18F-FDG代谢显著减低可能与患者病程、病情程度等相关。不同于波谱、弥散及功能成像等中枢成像方式,PET-CT以不同色度的伪彩较为完整地展示了各脑区的活性代谢及毗邻区域的代谢演变趋势,间接提示了邻近脑区之间的相互影响及变化。
[1] Portella MJ,de Diego-Adeliño J,Gómez-Ansón B,et al.Ventromedial prefrontal spectroscopic abnormalities over the course of depression:A comparison among first episode,remitted recurrent and chronic patients[J].J Psychiatr Res,2011,45(4):427-434.
[2] Yang JC,Park K,Eun SJ,et al.Assessment of cerebrocortical areas associated with sexual arousal in depressive women using functionalMR imaging[J].JSex Med,2008,5(3):602-609.
[3] Osuch EA,Bluhm RL,Williamson PC,et al.Brain activation to favorite music in healthy controls and depressed patients[J].Neuro Report,2009,20(13):1204-1208.
[4] 吴志国,方贻儒,谢斌.难治性抑郁症脑局部葡萄糖代谢的初步研究[J].中国神经精神疾病杂志,2009,35(5):261-264.
[5] Dome P,Halmai Z,Dobos J,etal.Investigation of circulating endothelial progenitor cells and angiogenic and inflammatory cytokines during recovery from an episode ofmajor depression[J].JAffect Disord,2012,136(3):1159-1163.
[6] Wu HH,Wang S.Strain differences in the chronicmild stress animal model of depression[J].Behav Brain Res,2010,213(1):94-102.
[7] 牟君,谢鹏,杨泽松,等.初发抑郁症患者丘脑质子磁共振波谱分析[J].中国神经精神疾病杂志,2007,33(4):229-232.
[8] Caroli A,Prestia A,Chen K,et al.Summary metrics to assess Alzheimer disease-related hypometabolic pattern with18F-FDG PET:head-to-head comparison[J].J Nucl Med,2012,53(4):592-600.
G lucosemetabolism level changes in neural circuits of the first-episode single-phasemajor depressive disorder patients using PET-CT
ZHOU Qun,LIYue-feng,ZHU Yan
(Department of Medical Imaging,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To study the changes of glucosemetabolism in neural circuits of the first-episode single-phasemajor depressive disorder patients changes of glucosemetabolism.M ethods:Using PET-CT to scan 30 first-episode single-phasemajor depressive disorder patients and 30 healthy persons,injecting 0.2 mCi of18F-FDG per kilogram of body weight,detecting the SUVmax value of the neural circuits respectively(including hippocampus,thalamus,frontal lobe and cingulate gyrus).ResultsCompared with the healthy group,the SUVmax of bilateral hippocampus,thalamus,frontal lobe and cingulate gyrus in the first-episode single-phasemajor depressive disorder patients were reduced significantly(P<0.001 or P<0.05);the thalamus changesmore obviously.Conclusion:The nerve cells in neural circuits of the first-episode singlephasemajor depressive disorder patients have been damaged,itwas reflected in the intake of energy utilization,and the thalamus displayed more obviously.
depression;neural circuits;PET-CT
R749.4
A
1671-7783(2015)04-0335-05
10.13312/j.issn.1671-7783.y150037
国家自然科学基金资助项目(81301194)
周群(1982—),女,主治医师,硕士研究生;李月峰(通讯作者),主治医师,硕士生导师,E-mail:jiangdalyf2009@126.com
2015-03-10 [编辑] 何承志

