抗TNF-α/抗ED-B双特异抗体在酵母中的分泌表达与活性分析
胡雪平,谢冕,李路军,蒋思婧,刘梦元
抗TNF-α/抗ED-B双特异抗体在酵母中的分泌表达与活性分析
胡雪平1,2,谢冕1,2,李路军1,2,蒋思婧1,2,刘梦元1,2
1湖北大学生命科学学院感染与免疫研究中心,湖北武汉 430062 2 湖北绿色生物资源转换协同创新中心,湖北武汉 430062
赋予抗TNF-α 单链抗体片段(TNF-scFv) 对炎症组织的特异性,用一段来自人清蛋白 (HSA) 的柔性连接肽在基因水平上连接TNF-scFv和抗B型纤维连接蛋白(B-FN) 的额外域B (ED-B) 的scFv L19,构建了抗TNF-α/抗ED-B单链双特异抗体BsDb,其中B-FN为炎症组织中特异表达的抗原。BsDb在毕赤酵母中获得了分泌表达,表达产物经鉴定和纯化制备后,进行了功能分析。结果表明,BsDb保留了其亲本抗体TNF-scFv和L19对抗原的免疫反应性,能够同时结合TNF-α和ED-B,并中和TNF-α的生理作用。而且,BsDb对抗原的亲和力及中和能力与大肠杆菌包涵体来源的亲本抗体相比显著增强。在小鼠佐剂型关节炎(AIA) 模型中,BsDb能选择性地积累和保留于小鼠的炎症关节,并快速从血浆中清除。说明BsDb兼备炎症组织的特异性和正常组织的低毒性,在类风湿关节炎及其他慢性炎症性疾病的治疗上具有较大潜力。
双特异抗体,肿瘤坏死因子α,纤维连接蛋白,额外域B,类风湿关节炎
目前,有4个TNF-α的单克隆抗体批准上市用于类风湿关节炎 (Rheumatoid arthritis,RA) 和其他自身免疫性疾病的治疗[1]。但是,这些单抗缺乏针对炎症组织的特异性,系统给药只有极少部分被炎症组织摄取[2-3]。而且,较长的血浆半衰期使其过于暴露于正常组织,带来较大的副作用[4-5]。因此,研究组织特异性强,提高抗TNF-α生物制剂的安全性,对RA及其他自身免疫病治疗显得尤为重要。组织特异性的药物运载体系是解决这个问题的理想途径,因为它可以使药物选择性地积累于靶组织,降低药物在正常组织中的暴露。小分子的抗体片段保留了完整抗体结合抗原的特异性,同时具备半衰期短、组织穿透力强、对正常组织毒副作用小等特点,是构建组织特异性药物运载体系的良好工具[6]。
纤维连接蛋白(Fibronectin,FN) 是胞外基质的重要组成成分,FN前体mRNA的选择性拼接,可产生不同类型的FN[7]。保留额外域B (Extra domain B,ED-B) 的FN (B-FN) 在正常成人组织中不表达,但在胎组织和肿瘤组织中丰富表达[8-10]。B-FN作为血管生成的标志物[11],其单抗BC1和scFv L19已广泛用于抗恶性肿瘤血管生成的靶向治疗[12-13]。研究表明,B-FN同样特异性高表达于RA的炎症滑膜和部分其他自身免疫病的炎症组织中[14-15]。L19融合的IL-10和TNFRⅡ能选择性积累于小鼠的炎症关节,对小鼠关节炎的疗效显著高于单独的IL-10或TNFRⅡ[16-17]。L19在临床上还用于RA的影像学诊断[18]。这些资料表明,B-FN是靶向治疗RA和其他自身免疫病的优良抗原。
我们构建了抗TNF-α的单链抗体 (TNF-scFv) 及其多价抗体[19-21],证实了TNF-scFv及其多价抗体对小鼠关节炎模型具有显著的治疗作用[20]。为了进一步提高其炎症组织的特异性,减少副作用,用一段选自人清蛋白 (HSA) 的连接肽在基因水平上连接抗TNF-α的单链抗体 (TNF-scFv) 和抗ED-B的单链抗体L19,构建了抗TNF-α/抗ED-B的双特异抗体BsDb。其目的是利用L19特异性结合B-FN的作用将TNF-scFv靶向导入RA或其他自身免疫病的炎症组织中,构建一种高效低毒的新型生物治疗剂。我们实现了BsDb在毕赤酵母中的分泌表达,并对其生物学活性进行了分析。
1 材料与方法
1.1 质粒、菌株和细胞株
质粒载体pMD18T/TNF-scFv及质粒载体pMD18T/L19 (EMBL Accession No. AJ006113) 由本实验构建并保存。大肠杆菌Top10购自天根生化科技 (北京) 有限公司 (Tiangen Biotech),用于分子克隆和质粒的保存;毕赤酵母宿主细胞GS115 (His4) 和整合型的酵母表达载体pHBM905B由湖北大学生命科学学院马立新教授惠赠;小鼠成纤维细胞L929购自美国ATCC,实验室保存,需要时培养于含有10%胎牛血清(FBS,Hyclone) RPMI-1640培养基,于37 ℃、5% CO2培养箱中。
1.2 试剂
人TNF-α购自Peprotech公司;人B-FN购自Speed Biosystem;FITC标记的抗组氨酸标签 (His tag) 单克隆抗体购自Santa Cruz;限制性内切酶、T4 DNA连接酶、pfu DNA多聚酶以及DNA回收试剂盒购自大连宝生物 (TaKaRa);Ni-NTA亲和层析凝胶购自Pharmacia;放线菌素D购自Fluka化学公司。单链抗体TNF-scFv、L19、CD3-scFv均由大肠杆菌表达的包涵体蛋白制备[19-21],并由本实验室保存,在羧基末端带有His tag。弗氏完全佐剂购自Sigma公司。昆明小鼠 (18±2) g,雄性,购自湖北省实验动物中心,并用标准的啮齿类动物饲料进行喂养,所有相关实验动物的操作严格按照国家科技部发布的《实验动物管理条例》(1988年11月14日2号令) 进行。
1.3 双特异抗体BsDb表达载体的构建及转化
以质粒pMD18T/TNF-scFv及质粒pMD18T/L19为模板,分别扩增TNF-scFv及L19的编码片段。扩增的引物如表1所示。构建的流程如图1所示。融合蛋白的表达载体pHBM905B/BsDb,转化大肠杆菌Top10,进行质粒的扩增,提取质粒进行序列测定,确保片段的正确连接和序列正确。重组质粒pHBM905B/BsDb用Ⅰ酶切线性化,电转化酵母细胞GS115 (His4),转化子首先在不含组氨酸的培养基上进行筛选,阳性克隆进一步提取细胞基因组DNA,并经PCR进行鉴定 (引物P1和P4)。上述各个基因片段的扩增条件为:95 ℃预变性5 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1min,循环30次;72 ℃延伸5 min。
1.4 BsDb的表达与鉴定
挑选鉴定的阳性重组子,接种25 mL BMGY培养基 (100 mmol/L磷酸二氢钾, pH 6.0,1% 酵母提取物,2% 蛋白胨,4×10–5% () 生物素,1% () 甘油),30 ℃摇动培养至600为6−8,3 000×离心10 min收集细胞,重悬于250 mL BMMY培养基 (BMGY培养基中用0.5%甲醇替代甘油),继续培养120 h,每隔12 h加入终浓度为0.5%甲醇保持连续的诱导表达,5 000×离心,收集细胞培养上清, SDS-PAGE (12%) 检测表达情况。将凝胶上的蛋白条带电转至0.45 μm硝酸纤维膜 (美国Pall Gelman),取出膜,于含5%的脱脂牛奶的1×PBS缓冲液 (pH 7.4) 中4 ℃封闭过夜,1×PBS洗膜3次,每次3 min;将膜浸泡于含HRP标记抗组氨酸标签的单抗 (1:1 000稀释) 的1×PBS缓冲液(pH 7.4) 中,37 ℃孵育2 h,1×PBS洗膜3次,每次3 min;加入DAB显色剂,待显色到理想的程度,自来水冲洗,终止反应。
1.5 BsDb纯化制备
向250 mL上述表达上清中缓慢加入等体积的100%饱和的硫酸铵 (pH 7.0),置于4 ℃过夜,缓慢摇动,以确保蛋白充分沉淀,于4 ℃、 10 000×离心30 min收集沉淀蛋白质并重悬于20 mL 1×PBS中,装入透析袋,置于1 000 mL缓冲液 (20 mmol/L Tris-HCl (pH 8.0), 150 mmol/L NaCl) 中,4 ℃搅拌透析24 h,每隔6 h更换一次透析缓冲液,充分去除蛋白中的硫酸铵和其他杂质。随后,蛋白质通过固定化的Ni2+亲和层析纯化 (IMAC)。上述透析后的蛋白溶液上样于经过10倍柱体积的透析缓冲液平衡的Ni2+亲和层析柱,流速0.5 mL/min;上样后,用缓冲液 (20 mmol/L Tris-HCl (pH 8.0), 500 mmol/L NaCl,20 mmol/L咪唑) 洗涤至基线,流速为1 mL/min,充分去除非结合的蛋白质;最后蛋白质用缓冲液 (20 mmol/L Tris-HCl (pH 8.0),150 mmol/L NaCl,500 mmol/L咪唑) 洗脱,流速为1 mL/min,收集蛋白质峰,进行SDS-PAGE检测,并用100倍体积的1×PBS缓冲液(pH 7.4) 进行透析12 h,每4 h更换一次缓冲液,充分去除蛋白中的咪唑及其他无机离子。透析后的蛋白质14 000×离心20 min,0.22 μm滤膜过滤,以去除少量的蛋白沉淀物和潜在的微生物,Bradford定量,冷冻干燥备用。
1.6 抗原结合ELISA
100 ng/孔TNF-α及100 ng/孔B-FN分别包被于96孔ELISA板,每孔于100 μL 0.1 mol/L的碳酸盐缓冲液 (pH 9.6) 中,4 ℃过夜。PBST洗板2次,用100 μL含5% (/)的脱脂牛奶的1×PBS缓冲液(pH 7.4) 37 ℃封闭2 h。PBST洗板3次,于每孔中加入100 μL不同浓度的BsDb或对照抗体 (包涵体来源的TNF-scFv、L19及CD3-scFv),每个抗体浓度做5复孔,置ELISA板于37 ℃温箱中孵育1.5 h。PBST洗板3次,于每孔中加入100 μL HRP标记的抗His tag单抗 (1∶1 000稀释),置ELISA板于37 ℃温箱中孵育1 h。PBST洗板3次,于每孔中加入100 μL显色液 (1 mmol/L OPD,0.016% () H2O2),37 ℃避光孵育10 min,酶标仪读取每孔490 nm处的吸收值。

表1 用于构建双特异抗体BsDb的引物
Note:Ⅰand aⅠrestriction sites (In italics) were introduced to the P1 and P4, respectively, for cloning purpose. The sequence encoding the HSA linker that comprises amino residues 490–513 of HSA was added to 5′ terminal of P3 (In shadow). Primers P2 and P3 have a complementary region of 20 base pairs (Underlined), insuring to perform the overlapping PCR and to covalently link the gene fragments encoding TNF-scFv, HSA linker and L19. A 6 × histidine (His tag) (In bold) coding sequence and a stop codon (In shadow) were introduced into primer P4, giving a translation stop and insuring identification and affinitive purification of BsDb. P1 and P2 is for the amplification of gene encoding TNF-scFv, and P3 and P4 for the amplification of HSA linker-L19 fusion gene.
1.7 抑制TNF-α的细胞毒作用
EDTA消化收集培养的L929细胞,用RPMI-1640 (10% FBS) 培养基调整浓度为2.5×105个/mL,100 µL/孔加入96孔细胞培养板中,37 ℃、5% CO2培养过夜。另取一块96孔培养板,于第3孔到第12孔加入100 μL RPMI-1640 (2% FBS) 培养基倍比稀释的双特异抗体BsDb。同样的方法处理TNF-scFv及CD3-scFv,每种抗体浓度梯度做3复孔,剩余的孔1和孔2加入100 μL的培养基;于第2孔到12孔加入100 μL RPMI-1640 (2% FBS) 培养基稀释的TNF-α,至终浓度为1 ng/mL,剩余的孔1加入100 μL的培养基,置37 ℃温箱中孵育2 h。弃掉第1块培养板中的培养液,将第2块培养板的孵育物转移100 μL至第1块培养板的相应孔中,与每孔中补加放线菌素D至终浓度为1 μg/mL,37 ℃、5% CO2培养24 h。于每孔中加入10 μL浓度为5 mg/mL的MTT溶液,37 ℃、5% CO2培养3 h,弃掉培养基,PBS洗板3次,每次2 min,于每孔中加入50 μL DMSO,摇动培养板,使细胞内结晶全部溶解,酶标仪阅读每孔的570 nm的吸收值(570),如下公式计算每种抗体对TNF-α细胞毒的抑制率 (%):
抑制率 (%)=[[570,M–570,T]/[570,N–570, T]]× 100%。
其中570,M为加入TNF-α和抗体的3复孔平均吸收值;570,T为只加TNF-α的3复孔平均吸收值;570,N为既不加TNF-α又不加抗体的3复孔的平均吸收值。
为了证实BsDb在结合B-FN的情况下,仍然能够中和TNF-α生理效应,对上述实验进行了调整。即在96孔细胞培养板中首先包被1 μg/孔的B-FN,1×PBS洗板后于每孔中加入不同浓度的BsDb,25 ℃孵育2 h,用1×PBS洗板3次,充分去除未结合的BsDb,然后于每孔中加入100 μL细胞悬液,并加入终浓度为1 ng/mL的TNF-α和终浓度为1 μg/mL的放线菌素D,37 ℃、5% CO2培养24 h。后续抑制作用的分析与上述一致。
1.8 小鼠佐剂型关节炎(AIA)的建立
于昆明小鼠尾部皮下注射0.1 mL的弗氏完全佐剂 (结核杆菌浓度为5 mg/mL),再于小鼠两后足趾皮下各注射0.1 mL弗氏完全佐剂。AIA的发生一般出现在注射后4 d,发病初期主要出现指关节的红肿,从一个关节累及到多个关节,进一步发展到踝关节的肿胀和变形。小鼠关节炎的严重程度通过对每只小鼠的后爪评分的方式进行记录,打分标准为:0=正常;1=红;2=红+轻微的肿胀;3=明显的肿胀;4=关节发生僵直和变性。每只小鼠给出的最高分为8分。
1.9 双特异抗体BsDb的生物学分布
40只AIA小鼠随机分成8个实验组。于每只小鼠尾静脉注射100 μg FITC标记的BsDb (溶于50 μL 1×PBS),分别于时间点10 min、30 min、1 h、4 h、8 h、12 h、24 h、48 h对5只AIA小鼠进行眼眶采血并处死小鼠。取每只小鼠的炎症爪子和正常爪子,称重,快速放入液氮中,研磨成颗粒或碎片,将组织转入15 mL的试管,放置与冰上,按1 mL 1×PBS/200 mg 组织的比例重悬组织,充分混匀,用Biospec Tissue-Tearor (Biospec Inc,USA) 进行匀浆,于4 ℃、1 000×离心15 min,收集上清,将上清转入1.5 mL的Eppendorf管,15 000×离心15 min,荧光分光光度计 (岛津RF-5301PC) 测定各管的荧光值,并对照预先作好的标准曲线计算各管的BsDb的浓度,进一步计算每克组织中的百分注射剂量 (% ID/g)。
1.10 数据处理
2 结果
2.1 BsDb表达载体的构建、表达及鉴定
BsDb表达载体pHBM905B/BsDb的构建流程见图1。重组质粒经序列测定,结果表明BsDb序列正确并成功插入表达载体,表达载体进一步转化酵母细胞GS115 (His4),转化子通过阳性筛选,并提取基因组DNA进行PCR鉴定,确定pHBM905B/BsDb载体已成功整合到酵母细胞的基因组,表明稳定表达融合蛋白的重组酵母菌株构建成功。HSA连接肽是我们从HSA中遴选的一段具有高度柔性的24肽,连接HSA的Ⅲa结构域的螺旋6和Ⅲb结构域的螺旋1。我们已经证实它具备IgG铰链区的功能,能够使两个连接的scFv进行独立折叠和灵活伸展,以有效地结合各自的抗原。如图1所示,BsDb基因位于酵母甲醇氧化酶 (AOXⅠ) 启动子控制之下,并与分泌表达的α-因子信号肽融合而处于同一阅读框内,这使得融合蛋白在甲醇的诱导下能够分泌到细胞培养基中。BsDb用甲醇诱导不同时间在培养物上清中的表达情况见图2,可以看出BsDb表达量与诱导时间呈正相关,最大的表达量在120 h,大约占整个酵母培养上清蛋白的30%,其分子量大约为56 kDa,与理论大小一致。Western blotting进一步鉴定表明56 kDa蛋白条带为目的蛋白 (图2)。融合蛋白通过固定化的Ni2+亲和层析 (IMAC) 一步纯化可达到95%以上的纯度 (图2),从1L的培养上清中可以常规的获得18−20 mg的目的蛋白,浓度在2 mg/mL以上。
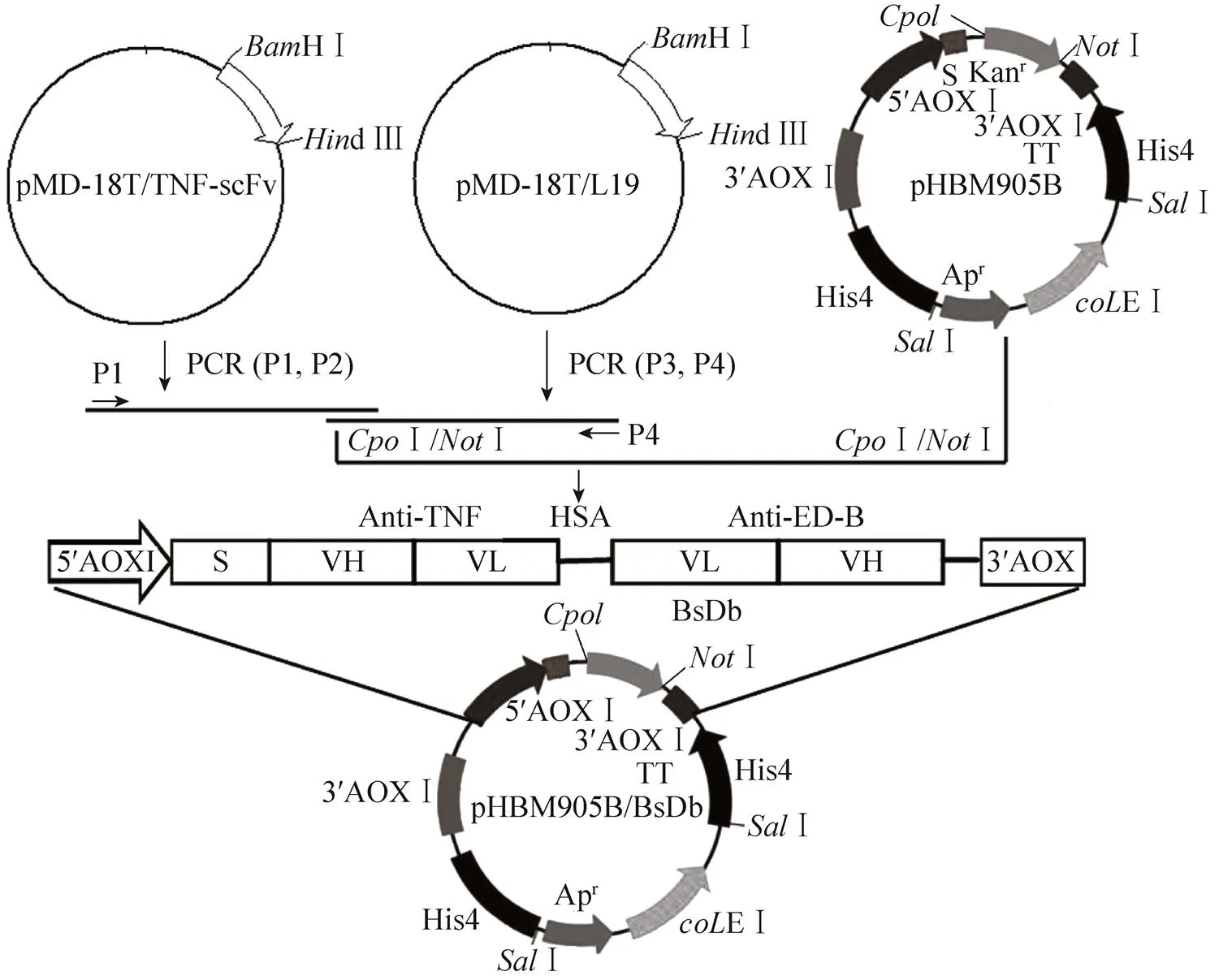
图1 双特异抗体BsDb表达载体的构建程序
2.2 BsDb与抗原免疫反应性
用间接ELISA分析了BsDb与其抗原的免疫反应性。如图3所示,BsDb与其亲本抗体TNF-scFv及L19一样,能够特异性结合人TNF-α和B-FN,而对照抗体CD-scFv对两种抗原都没有结合作用。表明BsDb保留了对两种抗原的免疫反应性,同时也说明HSA连接肽的共价连接并没有影响TNF-scFv和L19的生物学活性,进一步证实了HSA连接肽能够充分保证相连的scFv独立折叠并有效地结合各自抗原。我们发现在同样条件下,BsDb对TNF-α及B-FN的结合信号都要显著高于其大肠杆菌包涵体复性制备的亲本抗体TNF-scFv和L19。说明通过酵母的分泌表达,BsDb对抗原的亲和力有了进一步提高。
2.3 BsDb抑制TNF-α的生理作用
TNF-α对小鼠成纤维细胞具有细胞毒性,我们分析了BsDb对TNF-α细胞毒性的抑制作用。如图4所示,BsDb与TNF-scFv一样,能够有效抑制TNF-α诱导L929细胞的凋亡。抑制率与BsDb及TNF-scFv的剂量正相关。抑制1 ng/mL TNF-α的细胞毒作用,BsDb 50%抑制的浓度 (IC50) 大约为4 nmol/L,100%抑制的浓度为64 nmol/L。而包涵体来源的亲本抗体TNF-scFv 50%抑制浓度 (IC50) 大约为16 nmol/L,100%抑制浓度为256 nmol/L,说明BsDb与TNF-scFv相比对TNF-α的中和能力也有大幅提升。在生理条件下,BsDb必须特异性结合炎症组织中的B-FN,同时还要中和TNF-α,才能发挥其靶向治疗的作用。为了模拟体内的这种情形,我们先在96孔培养板上包被B-FN,然后与BsDb作用,洗去未结合的BsDb。在这种情况下,只有特异性B-FN的BsDb才能保留在培养板上并抑制TNF-α的细胞毒性。结果表明,即使BsDb与B-FN结合,仍能中和TNF-α的细胞毒性。相反,如果用大量游离的B-FN与BsDb一起孵育以抑制BsDb与板上包被的B-FN结合,则不能观察到对TNF-α的细胞毒性的抑制作用。说明BsDb具有可同时结合两种抗原并能中和TNF-α的生理活性。
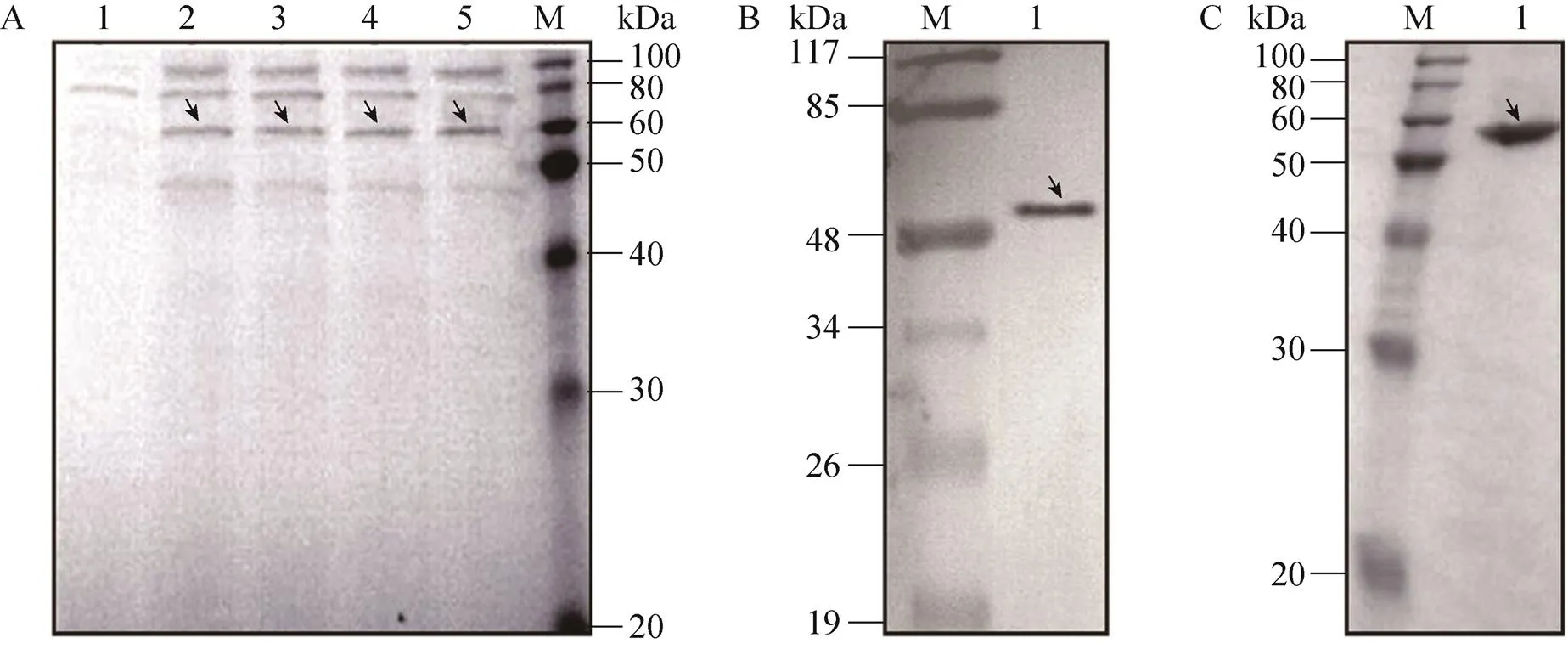
图2 双特异抗体BsDb的表达、鉴定与纯化
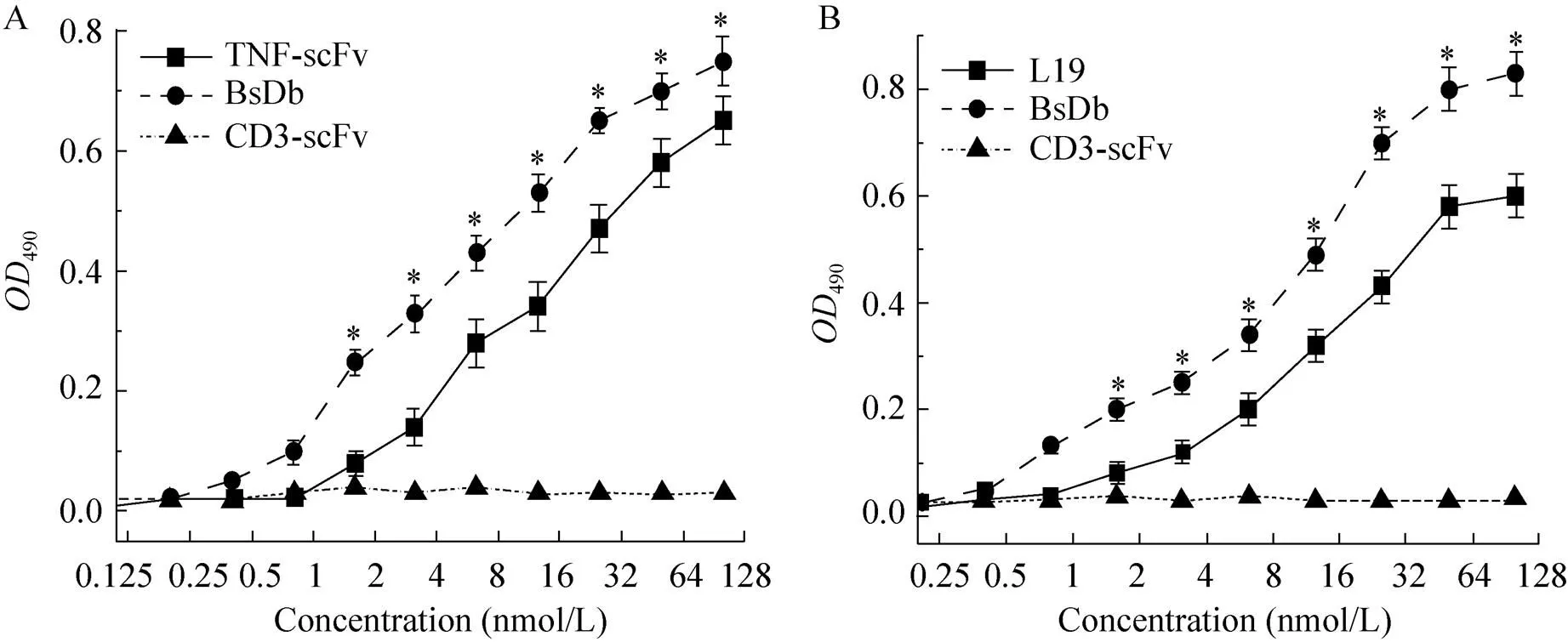
图3 BsDb抗原结合的ELISA分析
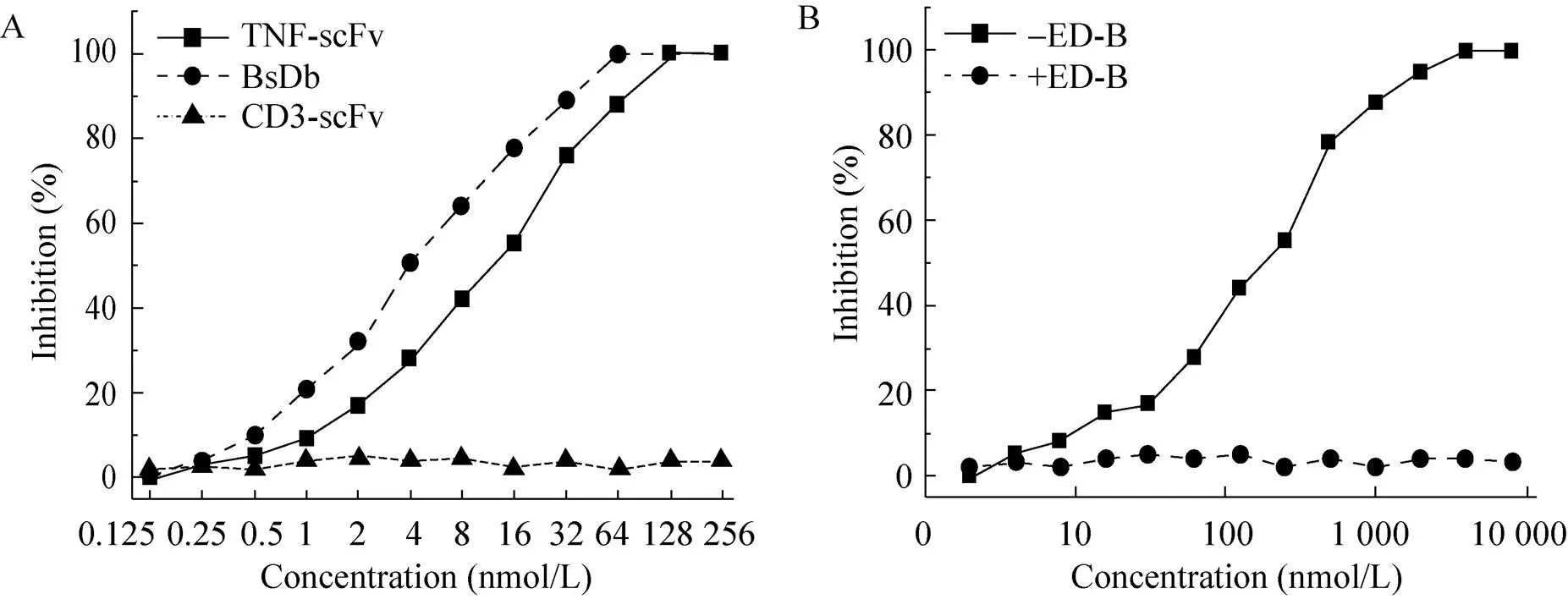
图4 BsDb抑制TNF-α的细胞毒作用
2.4 BsDb的生物分布
在注射弗氏完全佐剂后的第10天,小鼠关节指数评分平均达到6左右,我们对BsDb的血浆清除速率和炎症关节的靶向性进行了分析。BsDb在AIA小鼠血浆和爪子中的分布动力学如图5所示,注射后10 min,血浆中BsDb每克组织百分注射剂量 (%ID/g) 为 (21.2±1.0),并迅速降低,4 h为 (2.2±0.4),24 h几乎全部从血浆中清除。通过GraphPad Prism 4.0的单相指数消除进行曲线拟合,计算出BsDb的血浆半衰期 (t1/2β) 为 (0.53±0.05) h。评价药物组织特异性的一个重要指标是药物在靶组织中的积累和保留作用。BsDb在小鼠炎症爪子中的迅速积累,并在注射后4 h到达最高,单个炎症爪子最高摄取 (12.5±1.50)% ID/g 的 BsDb,48 h仍然有 (6.23±1.00)% ID/g 的BsDb保留于炎症爪子中。而BsDb在正常爪子中没有积累作用,最大摄取量 (2.98±0.31)% ID/g发生在注射后30 min,24 h几乎从正常爪子中完全清除。评价药物靶向性另外一个重要的指标是药物在靶组织与血浆中的分布比率 (靶血比)。靶血比高说明药物能选择性积累于靶组织并快速从血浆和正常组织中清除。我们计算了注射后不同时间点BsDb在炎症爪子中的% ID/g与血浆中% ID/g的比率,如图6所示,BsDb的靶血比随注射时间快速上升,12 h达到最大,为103∶1。随后,积累饱和的BsDb开始缓慢从炎症爪子清除,因而靶血比呈现缓慢下降的趋势,24 h为88∶1,48 h仍然为27∶1。这些数据表明,BsDb可选择性积累并较长时间停留于AIA小鼠的炎症关节,但能快速从血浆和正常组织中清除。
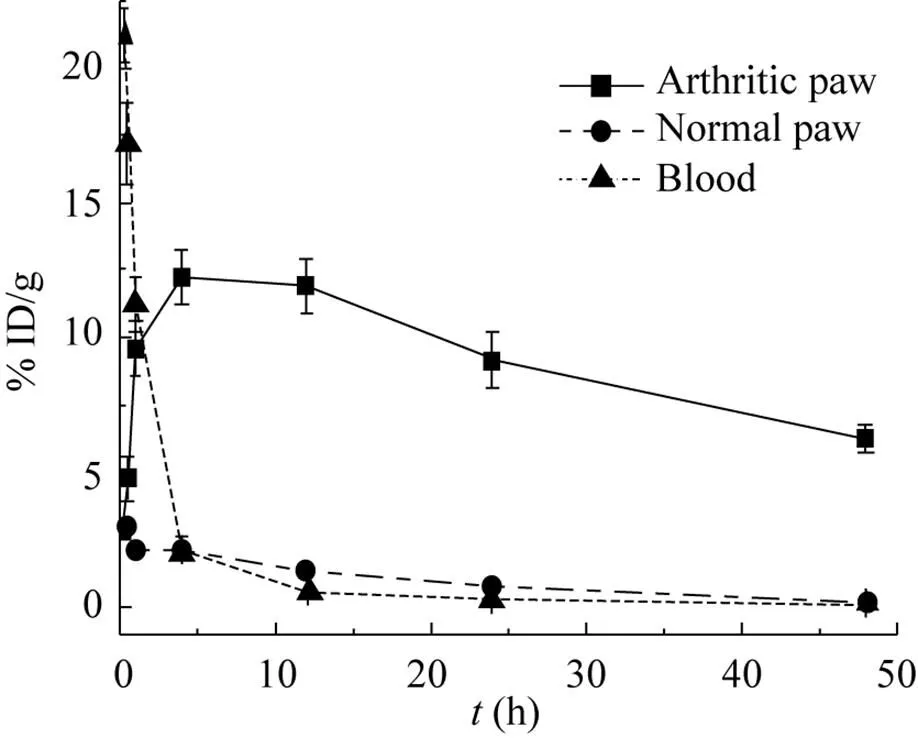
图5 BsDb在炎症爪子、正常爪子及血中的分布动力学

图6 BsDb在炎症爪子与血中的分布比(靶血比)
3 讨论
TNF-α单抗用于临床已接近20年,疗效确切。经历了鼠源单抗、人鼠嵌合单抗、人源单抗的发展历程,逐步解决了抗体免疫原性的问题,有效地提高了抗体的疗效。但其组织特异性是目前亟待解决的问题,因为它导致了不可忽视的副作用,表现为RA患者长期用药会出现严重感染和恶性肿瘤[4-5]。本世纪初,药物学家开始关注TNF-α小分子抗体片段,因其具有较短的血浆半衰期,快速从血浆和正常组织中清除,对正常组织毒性较小等特点,在一定程度上可克服完整单抗的不足之处,但较短的半衰期又使靶组织对其摄取量过低[6]。我们认为在TNF-α的小分子抗体片段上共价连接一个炎症组织中特异性表达抗原的配体分子可以解决上述问题。因为借助配体-抗原的相互作用,可使TNF-α的小分子抗体片段选择性地积累和保留于炎症组织,同时这种小分子抗体片段的融合蛋白缺乏抗体Fc区而具有较短的半衰期,可快速从血浆和正常组织中清除,从而可形成一种高特异性、低毒性的生物治疗剂。另外,FN作为炎症组织中的特异性靶分子,具有特异、稳定和丰富等特点。FN是胞外基质 (ECM) 的重要组成成分,在维持组织正常结构和功能中发挥重要作用,为细胞的分裂、分化和迁移提供一定微环境[10]。在病理条件下,为了满足疾病发展的需要,FN会发生重构,形成新的异性体。研究表明,在恶性肿瘤组织和慢性炎症性组织中表达一种新型的分子B-FN[7,12,14-15],它是通过FN前体mRNA在 ED-A、ED-B和IIICS三个位点进行选择性拼接的产物,其中ED-B可以完全保留或被删除,ED-B被完全保留的FN为B-FN,这种病理修饰的FN在正常组织是不存在的,但与恶性肿瘤及慢性炎症的血管形成相关,是一个血管形成的标志物[11],其中ED-B在人和哺乳动物之间具有100%的同源性,而且表达稳定而丰富,因而是一个有效靶向恶性肿瘤和慢性炎症性疾病的优良抗原。抗ED-B的单抗BC1和scFv L19广泛用于药物载体进行抗恶性肿瘤血管形成的靶向治疗,并取得了令人振奋的实验结果[8,12]。2007年Trachsel等[16]用抗ED-B的scFv L19融合IL-10对小鼠关节模型进行治疗,证实L19的融合可以明显提高IL-10组织特异性和疗效,开创了靶向治疗RA的先河。随后有利用L19融合TNFRII 进行RA靶向治疗的报道[17]。2011年Kamperidis等[22]通过噬菌体库筛选了一株能特异性结合RA患者炎症滑膜微血管上一个表位的scFv A7,证实该抗体片段有望成为靶向炎症关节的有效药物载体。这些资料说明,炎症组织特异性的生物制剂的研究及应用代表RA及其他自身免疫病治疗药物的一个重要发展方向。
以上研究资料促使我们构建了抗TNFα/抗ED-B的双特异抗体,目的是利用L19特异性结合B-FN的作用将TNF-scFv靶向导入炎症部位,提高其疗效,降低副作用。体外活性分析表明,该抗体可同时结合TNF-α及B-FN,并具有中和TNF-α的生理效应,说明双特异抗体构建成功。值得注意的是,本研究实现了BsDb在毕赤酵母中的分泌表达,这对我们来说是一次非常有意义的尝试。我们以前构建了多种单链抗体片段包括抗TNF-scFv及其多价抗体、scFv L19以及CD3-scFv等,但是这些抗体片段都无一例外地在大肠杆菌中形成包涵体[19-21],往往需要复杂的复性制备才能获得活性蛋白,这是一个非常费时费力的工作,不利于这些抗体的工业化生产。而本研究中活性的抗体分子可直接从酵母中分泌到培养基,大大简化了分离制备过程。而且,我们还发现酵母分泌的BsDb在抗原的亲和力和TNF-α中和能力方面与其来源于大肠杆菌包涵体的亲本抗体都有显著提高。BsDb非常稳定,通过超滤浓缩到2 mg/mL也不会出现聚集现象。我们以前对TNF-scFv及其多价抗体的包涵体蛋白进行复性时蛋白浓度超过 500 μg/mL就会出现聚集[19-21]。这说明酵母分泌表达的蛋白正确折叠率远远高于包涵体复性的蛋白。进一步证实了酵母在重组蛋白生产上的优越性,因为毕赤酵母不仅具有真核细胞多种翻译后的修饰功能,如折叠、二硫键形成、糖基化及分泌等[23-24],而且还能象原核细胞一样高密度的培养,与大肠杆菌或其他的真核表达系统相比,在重组蛋白的生产上具有无可替代的优势。因此,本研究同时也为我们找到了生产该双特异抗体的有力工具。体内生物学分布研究表明,BsDb可选择性积累于炎症关节,并在炎症关节中保留较长时间,但却具备较短的血浆半衰期。说明BsDb兼备炎症组织的特异性和正常组织的低毒性,在RA及其他慢性炎症性疾病的治疗上具有较大的潜力。因此,我们的研究达到了预期目标。
我们已证实了TNF-scFv及其多价抗体尤其是四价抗体对CIA小鼠具有较为显著的疗 效[19-21],相信通过L19的融合,提高其组织特异性,同时利用酵母的分泌表达,提高其生物活性,BsDb在疗效上将会具有更加出色的表现。对BsDb进行全面的药效学评价,将是我们后期工作的重点。因此,本研究为BsDb临床前期研究打下了坚实的基础。
REFERENCES
[1] Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation. Nat Rev Immunol, 2010, 10(5): 301–316.
[2] Choy EH, Connolly DJ, Rapson N, et al. Pharmacokinetic, pharmacodynamic and clinical effects of a humanized IgG1 anti-CD4 monoclonal antibody in the peripheral blood and synovial fluid of rheumatoid arthritis patients. Rheumatology (Oxford), 2000, 39(10): 1139–1146.
[3] Tabrizi M, Bornstein GG, Suria H. Biodistribution mechanisms of therapeutic monoclonal antibodies in health and disease. Aaps J, 2010, 12(1): 33–43.
[4] Alawneh KM, Ayesh MH, Khassawneh BY, et al. Anti-TNF therapy in Jordan: a focus on severe infections and tuberculosis. Biologics, 2014, 8: 193–198.
[5] Askling J, van Vollenhoven RF, Granath F, et al. Cancer risk in patients with rheumatoid arthritis treated with anti-tumor necrosis factor alpha therapies: does the risk change with the time since start of treatment? Arthritis Rheum, 2009, 60(11): 3180–3189.
[6] Cuesta AM, Sainz-Pastor N, Bonet J, et al. Multivalent antibodies: when design surpasses evolution. Trends Biotechnol, 2010, 28(7): 355–362.
[7] Carnemolla B, Balza E, Siri A, et al. A tumor-associated fibronectin isoform generated by alternative splicing of messenger RNA precursors. J Cell Biol, 1989, 108(3): 1139–1148.
[8] Borsi L, Balza E, Bestagno M, et al. Selective targeting of tumoral vasculature: comparison of different formats of an antibody (L19) to the ED-B domain of fibronectin. Int J Cancer, 2002, 102(1): 75–85.
[9] Borsi L, Castellani P, Risso AM, et al. Transforming growth factor-beta regulates the splicing pattern of fibronectin messenger RNA precursor. FEBS Lett, 1990, 261(1): 175–178.
[10] Ffrench-Constant C, Van de Water L, Dvorak HF, et al. Reappearance of an embryonic pattern of fibronectin splicing during wound healing in the adult rat. J Cell Biol, 1989, 109(2): 903–914.
[11] Castellani P, Viale G, Dorcaratto A, et al. The fibronectin isoform containing the ED-B oncofetal domain: a marker of angiogenesis. Int J Cancer, 1994, 59(5): 612–618.
[12] Sauer S, Erba PA, Petrini M, et al. Expression of the oncofetal ED-B-containing fibronectin isoform in hematologic tumors enables ED-B-targeted 131I-L19SIP radioimmunotherapy in Hodgkin lymphoma patients. Blood, 2009, 113(10): 2265–2274.
[13] Pini A, Viti F, Santucci A, et al. Design and use of a phage display library. Human antibodies with subnanomolar affinity against a marker of angiogenesis eluted from a two-dimensional gel. J Biol Chem, 1998, 273(34): 21769–21776.
[14] Kriegsmann J, Berndt A, Hansen T, et al. Expression of fibronectin splice variants and oncofetal glycosylated fibronectin in the synovial membranes of patients with rheumatoid arthritis and osteoarthritis. Rheumatol Int, 2004, 24(1): 25–33.
[15] Claudepierre P, Allanore Y, Belec L, et al. Increased Ed-B fibronectin plasma levels in spondyloarthropathies: comparison with rheumatoid arthritis patients and a healthy population. Rheumatology (Oxford), 1999, 38(11): 1099–1103.
[16] Trachsel E, Bootz F, Silacci M, et al. Antibody-mediated delivery of IL-10 inhibits the progression of established collagen-induced arthritis. Arthritis Res Ther, 2007, 9(1): R9.
[17] Ventura E, Balza E, Borsi L, et al. Selective targeted delivery of the TNF-alpha receptor p75 and uteroglobin to the vasculature of inflamed tissues: a preliminary report. BMC Biotechnol, 2011, 11: 104.
[18] Vollmer S, Vater A, Licha K, et al. Extra domain B fibronectin as a target for near-infrared fluorescence imaging of rheumatoid arthritis affected joints. Mol Imaging, 2009, 8(6): 330–340.
[19] Liu M, Wang X, Yin C, et al. One-step on-column purification and refolding of a single-chain variable fragment (scFv) antibody against tumour necrosis factor alpha. Biotechnol Appl Biochem, 2006, 43(3): 137–145.
[20] Liu M, Wang X, Yin C, et al. Targeting TNF-alpha with a tetravalent mini-antibody TNF-TeAb. Biochem J, 2007, 406(2): 237–246.
[21] Liu M, Wang X, Yin C, et al. A novel bivalent single-chain variable fragment (scFV) inhibits the action of tumour necrosis factor alpha. Biotechnol Appl Biochem, 2008, 50(4): 173–179.
[22] Kamperidis P, Kamalati T, Ferrari M, et al. Development of a novel recombinant biotherapeutic with applications in targeted therapy of human arthritis. Arthritis Rheum, 2011, 63(12): 3758–3767.
[23] Macauley-Patrick S, Fazenda ML, McNeil B, et al. Heterologous protein production using theexpression system. Yeast, 2005, 22(4): 249–270.
[24] Cregg JM, Cereghino JL, Shi J, et al. Recombinant protein expression in. Mol Biotechnol, 2000, 16(1): 23–52.
(本文责编 郝丽芳)
Expression and characterization of a bispecific antibody targeting TNF-α and ED-B containing fibronectin
Xueping Hu1,2, Mian Xie1,2, Lujun Li1,2, Sijing Jiang1,2, and Mengyuan Liu1,2
1,,,430062,,2,430062,,
To enhance the specificity of anti-TNF-α single chain Fv antibody (TNF-scFv) to inflamed site, we constructed a bispecific antibody BsDb that targets TNF-α and ED-B-containing fibronectin (B-FN) by covalently linking TNF-scFv and the anti-ED-B scFv L19 at the gene level via a flexible peptide linker deriving from human serum albumin.BsDb was successfully secreted fromas functional protein, identified by immunoblotting, and purified to homogeneity with affinity chromatography. BsDb retained the immunoreactivity of its original antibodies TNF-scFv and L19, and showed a marked gain in antigen-binding affinity and in TNF-α-neutralizing ability, when compared to TNF-scFv and L19 that were produced in. In the adjuvant-induced arthritis (AIA) mice model, BsDb showed selective accumulation and retention in the inflamed paws but rapid clearance from blood, resulting in high arthritic paw to blood ratios. These data indicate that BsDb is endowed with high specificity to inflamed site and low toxicity to normal tissues and holds great potential forapplication for the targeted therapy of RA and other chronic inflammatory diseases.
bispecific antibody, tumor necrosis factor α, fibronectin, extra domain B, rheumatoid arthritis
July 1, 2014; Accepted: October 29, 2014
Mengyuan Liu. Tel: +86-27-88661237; Fax: +86-27-88666106; E-mail: liumengy@tom.com
Supported by:National Natural Science Foundation of China (No.30973669/H3004).
国家自然科学基金(No. 30973669/H3004) 资助。
网络出版时间:2014-11-17
http://www.cnki.net/kcms/doi/10.13345/j.cjb.140350.html

