基于SOE-PCR的两种鱼类hepcidin基因串联及其在毕赤酵母中的表达
李文婧,陶妍,赵冬梅,徐冰冰
基于SOE-PCR的两种鱼类hepcidin基因串联及其在毕赤酵母中的表达
李文婧1,陶妍1,赵冬梅1,徐冰冰2
1 上海海洋大学食品学院上海水产品加工及贮藏工程技术研究中心,上海 201306 2 江苏八陆生物科技有限公司,江苏南通 226400

李文婧, 陶妍, 赵冬梅, 等. 基于SOE-PCR的两种鱼类hepcidin基因串联及其在毕赤酵母中的表达. 生物工程学报, 2015, 31(5): 682–691.Li WJ, Tao Y, Zhao DM, et al. Connection of hepcidin genes from two fish species and their expression in Pichiapastoris. Chin J Biotech, 2015, 31(5): 682–691.
Hepcidin抗菌肽是由生物肝脏细胞表达的一类具有抗菌作用和铁代谢调节功能的碱性小分子肽,它们在机体免疫系统中发挥了重要作用,被认为是抗生素的理想替代品。通过重组DNA表达技术制备抗菌肽无疑是一条良好的途径。为扩大hepcidin的抗菌谱和提高其表达量,通过SOE-PCR将斑点叉尾鮰hepcidin成熟肽的cDNA“”与尼罗罗非鱼hepcidin成熟肽的cDNA“”进行串联,并在两端分别添加RⅠ和Ⅰ酶切位点,以pPIC9K为真核表达载体,成功构建了“pPIC9K-”重组表达载体;电转化进毕赤酵母GS115中,经不同浓度G418和选择性培养基筛选以及对酵母基因组DNA的PCR鉴定,得到高拷贝酵母转化子;在30 ℃、以1%的甲醇诱导表达不同时间后,经Tricine-SDS-PAGE分析,表明发酵培养72 h时目的蛋白的表达量最高,达77 mg/L。发酵上清经SP-Sepharose阳离子交换层析纯化后获得高纯度的目的蛋白。抑菌实验显示含目的蛋白的发酵上清和经纯化后的重组目的蛋白对革兰氏阳性和革兰氏阴性细菌都有良好的抑菌效果。本研究结果为hepcidin抗菌肽的产业化生产奠定了良好的基础。
抗菌肽,Hepcidin成熟肽,毕赤酵母,SOE-PCR
抗菌肽 (Antimicrobial peptide,AMP) 是生物防御外来病菌时,在体内迅速合成的具有免疫抗菌活性的肽类物质[1]。抗菌肽具有结构和活性稳定、不易产生耐药性、对环境污染小等优点,进而受到越来越广泛的关注。Hepcidin又称LEAP-1 (Liver-expressed antimicrobial peptide 1),是一种主要由肝细胞产生和分泌的碱性小分子抗菌肽,具有广谱抗菌活性[2];Nicolas等[3]以老鼠为研究对象,证明hepcidin对于调节机体铁离子代谢平衡发挥着重要的作用,任何生理状态对体内hepcidin水平的改变都将导致机体铁水平的变化。Hepcidin由Kruasea等[4]首次从人血清中分离得到,之后Park等[5]从人尿液中也分离得到,随后在两栖动物和鱼类中亦发现了类似于hepcidin的同源基因[6-8]。Hepcidin在各物种间具有较高的结构保守性,尤其在成熟肽区域含有6或8个半胱氨酸残基,以致在空间上可形成3或4对二硫键,与其结构稳定和生物活性有关[9]。鱼类hepcidin最早由Shike等[10]从杂交斑纹鲈鱼的鳃中分离到。目前,已在黑鲷、斑点叉尾鮰、尼罗罗非鱼、大黄鱼等多种鱼类中分离克隆到基因[11-14]。虽然已有一些关于昆虫和两栖动物来源抗菌肽的原核或真核表达方面的研究报道[15-16],但迄今为止,对于鱼类抗菌肽的重组DNA表达研究还鲜有报道。
在过去的两年中,本研究室已分别对斑点叉尾鮰和尼罗罗非鱼的hepcidin成熟肽实现了在大肠杆菌中的成功表达,且表达的重组蛋白具有良好的抑制革兰氏阳性和阴性细菌的活性[17-18],但由于原核表达系统存在众所周知的局限性和不足,因而不适合实际生产中大规模的制备。据此,本研究拟通过建立酵母表达系统,实现对上述两种鱼类hepcidin成熟肽的重组DNA表达。此外,为了扩大目的蛋白的抗菌谱和提高表达量,通过重叠延伸PCR (Splicing by overlapping extension PCR,SOE- PCR)[19]对两种鱼类hepcidin成熟肽的cDNA进行了串联,并在它们之间添加信号肽酶切位点,便于分泌表达时两者的分离。本研究为鱼类抗菌肽的基因工程制备奠定了重要的基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌种
用于质粒复制和cDNA克隆的大肠杆菌DH5α购自北京天根生物科技公司;克隆质粒pMD19-T simple购自日本TaKaRa公司;真核表达载体pPIC9K及毕赤酵母GS115购自美国Invitrogen公司。用于抑菌活性鉴定的金黄色葡萄球菌、铜绿假单胞菌、枯草芽胞杆菌、大肠杆菌单增李斯特菌、沙门氏菌均为本实验室保藏菌种。
1.1.2 试剂
DNA聚合酶、T4 DNA连接酶、RⅠ和Ⅰ限制性内切酶购自日本TaKaRa公司;质粒提取试剂盒、DNA回收试剂盒、DNA分子量marker和蛋白质分子量marker购自北京天根生物科技有限公司;离子交换层析柱SP-Sepharose购自美国GE Healthcare公司;酵母粉 (Yeast extract)、胰蛋白胨 (Tryptone) 购自OXOID公司;其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 基于SOE-PCR的斑点叉尾鮰和尼罗罗非鱼hepcidin成熟肽的cDNA串联
编码斑点叉尾鮰hepcidin成熟肽的cDNA和编码尼罗罗非鱼hepcidin成熟肽的cDNA分别通过RT-PCR克隆而来[17-18]。SOE-PCR的策略如图1所示,设计的各引物序列见表1。以为模板的PCR反应体系和条件如下:2.5 μL、各4.0 μL 10 μmol/L的正向引物P1和反向引物P2、50 μL PrimeSTAR®HS (Premix) (TaKaRa,Otsu,Japan),用无菌水将反应液调至100 μL;94 ℃预变性3 min;94 ℃变性30 s;60 ℃退火30 s;72 ℃延伸1 min;30个循环;最终72 ℃延伸5 min。以为模板的PCR反应体系和条件同上,除了引物为P3和P4、退火温度改为62 ℃。扩增串联片段的PCR反应体系和条件如下:0.5 μL、0.5 μL、各0.8 μL 10 μmol/L的正向引物P1和反向引物P4、10 μL PrimeSTAR®HS (Premix),用无菌水将反应液调至20 μL;94 ℃预变性3 min;94 ℃变性30 s;58 ℃退火30 s;72 ℃延伸1 min;10个循环;最终72 ℃延伸5 min。以该PCR产物为模板,设计一对分别含RⅠ和Ⅰ酶切位点的正向引物Fc和反向引物Rc,用以扩增含黏性末端的串联片段,PCR反应体系如下:2.5 μL、各4.0 μL 10 μmol/L的正向引物Fc和反向引物Rc、1.0 μLplus DNA 聚合酶 (5 U/μL) (TaKaRa,Otsu,Japan)、10 μLplus缓冲液、8.0 μL dNTPs,用无菌水将反应液调至100 μL;反应条件同上述串联片段的扩增,除了循环次数改为30。扩增的片段经DNA纯化试剂盒纯化后,与pMD19-T simple载体连接,转化感受态细胞.DH5α,由上海生工生物工程技术服务有限公司进行DNA测序。
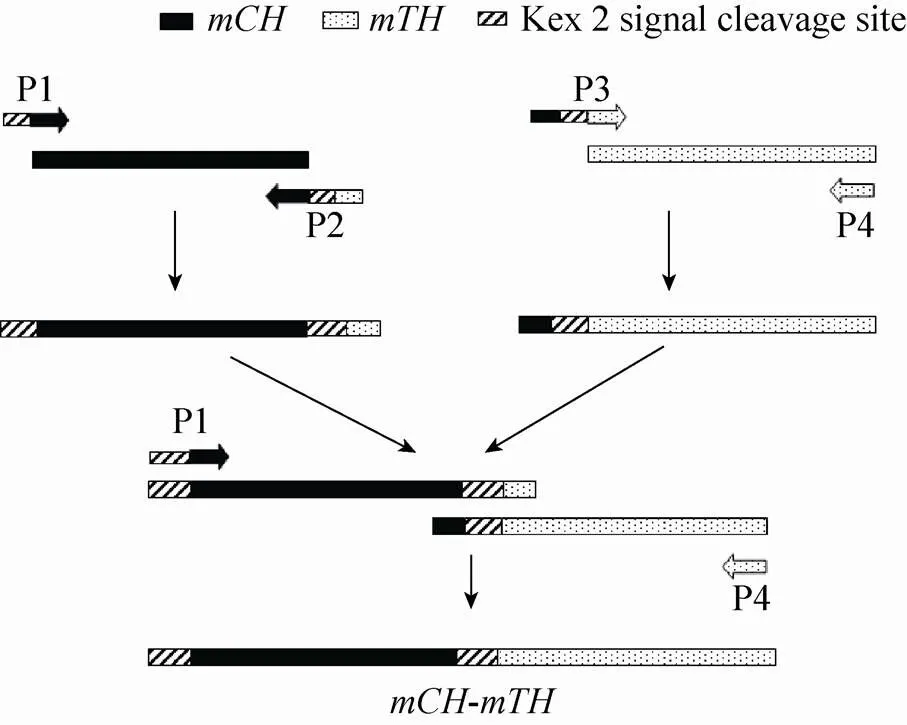
图1 SOE-PCR策略图
1.2.2 pPIC9K-重组表达载体的构建及其转化毕赤酵母GS115
采用限制性核酸内切酶RⅠ和Ⅰ对重组质粒“pMD19-T-进行酶切,经琼脂糖凝胶电泳割胶回收目的片段后,将其与用同样酶处理过的表达载体pPIC9K按15:1连接 (图2),在T4 DNA连接酶作用下,16 ℃保温20 h,转化感受态细胞.DH5α,通过菌落PCR、双酶切和DNA测序对重组表达载体pPIC9K进行筛选。
pPIC9K经Ⅰ酶切线性化后电转入毕赤酵母GS115,方法如下:将5–10 μL线性重组质粒加入80 μL酵母感受态细胞中,一并转入预冷的电转杯中,冰上放置5 min后进行电转,条件如下:1.5 kV、25 μF、200 Ω、5 ms;加入600 μL预冷的1 mol/L山梨醇,30 ℃静置1–2 h,取适量涂于His–的MD平板上,30 ℃培养至产生单克隆。理论上长出来的克隆都是发生同源重组的His+克隆。
1.2.3 酵母重组转化子的筛选及鉴定
将MD平板上的单菌落依次接种于G418浓度为1.0、2.0、3.0、4.0 g/L的YPD平板上,30 ℃培养2–5 d后筛选高拷贝酵母转化子;将筛选到的转化子在MD平板上培养以鉴定其Mut+或Mut–表型;提取His+Mut+高拷贝酵母转化子的基因组DNA,以此为模板,采用pPIC9K上的通用引物5′和3′,进行PCR扩增。

表1 引物序列
Underlines represent complementary regions, shaded areas represent sequences encoding Kex 2 protease recognition sites.
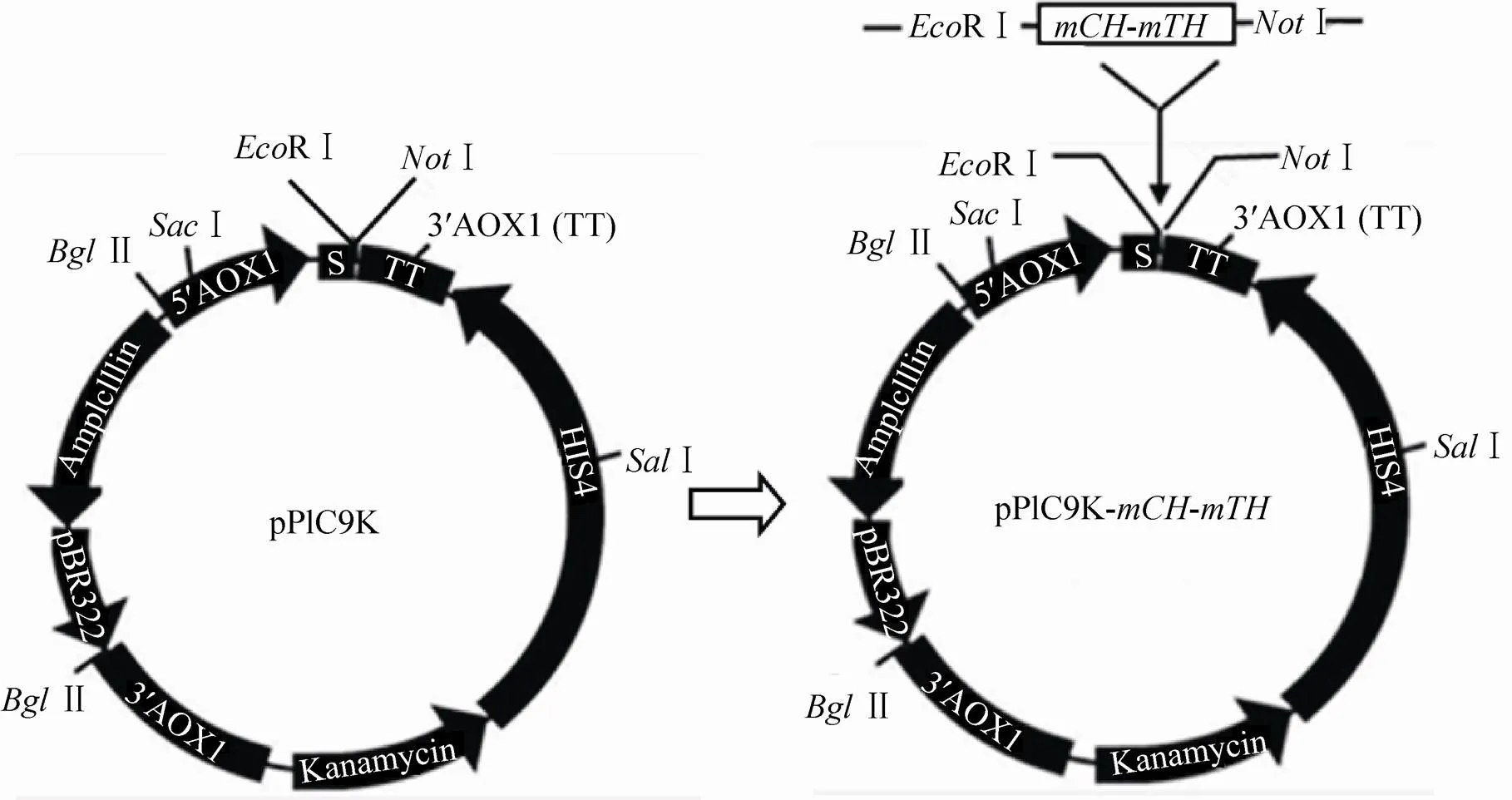
图2 重组表达载体“pPIC9K-mCH-mTH”的构建
1.2.4 mCH-mTH在毕赤酵母GS115中的表达及其纯化
挑取筛选到的酵母转化子,接种于BMGY液体培养基中,30 ℃、250–300 r/min培养至600=2–6,离心后用BMMY液体培养基重悬细胞至600约为1.0,进行甲醇诱导表达,每隔24 h取上清以备分析,并添加甲醇至终浓度为1%;取诱导表达72 h的发酵上清通过SP-Sepharose阳离子交换层析进行纯化,用20 mmol/L磷酸钠缓冲液 (pH 6.5) 预平衡,0.0–1.0 mol/L NaCl进行梯度洗脱。纯化后的mCH-mTH通过PBS (140 mmol/L NaCl、2.7 mmol/L KCl、10 mmol/L Na2HPO4、2 mmol/L KH2PO4,pH 7.4) 透析后,真空冷冻干燥成粉末,–80 ℃保存备用。通过Tricine-SDS-PAGE对纯化的蛋白进行鉴定,Tricine浓度为0.1 mol/L,浓缩胶、夹层胶和分离胶的浓度分别为4%、10%和16.5%。
1.2.5 发酵上清及纯化的重组体mCH-mTH的抑菌活性测定
发酵液通过离心后获得的上清再经浓缩10倍后的蛋白质浓度约为13.5 mg/mL,将其用于活性测定。将金黄色葡萄球菌和铜绿假单胞菌培养至对数生长期,各取50 μL菌液与20 mL营养琼脂混合,倒平板;用灭菌打孔器在平板上打6 mm的孔,各孔加入80 μL浓缩上清,空质粒经诱导表达的浓缩上清和磷酸钾缓冲液作为对照。
另一方面,用预冷的PBS溶解纯化的重组体mCH-mTH粉末,采用Folin酚法测其浓度为1.4 mg/mL。选择金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、枯草芽胞杆菌、单增李斯特菌、沙门氏菌为待测菌,分别接种于LB液体培养基中,培养至600为0.2 (5×107CFU/mL),1:10稀释至5×106CFU/mL,分别吸取50 μL至96孔培养板,每孔加入60 μL mCH-mTH,37 ℃培养20 h,阴性对照组各菌液中加入60 μL PBS;测定各处理组和对照组在600的吸光值,计算存活细胞率[20]。
2 结果与分析
2.1 通过SOE-PCR串联的cDNA片段
通过SOE-PCR,扩增到156 bp的含Kex 2蛋白酶识别位点编码序列的“”串联片段 (图3A);进一步以该片段为模板,通过设计添加RⅠ和Ⅰ限制性酶切位点的引物,扩增到170 bp的目的片段 (图3B),经DNA测序确证,该两个限制性酶切位点和另两个Kex 2蛋白酶识别位点“Lys-Arg”的编码序列均被成功添加 (图4)。除去所有酶切位点序列,该片段编码了由25个氨基酸残基组成的斑点叉尾鮰hepcidin成熟肽“mCH”和由22个氨基酸残基组成的尼罗罗非鱼hepcidin成熟肽“mTH”,两者均含有8个保守的半胱氨酸残基。“mCH”与“mTH”之间添加的Kex 2蛋白酶酶切位点有利于分泌表达时两者的分离。
2.2 对于酵母重组表达系统的鉴定
以重组表达载体“pPIC9K-”为模板,以5′和Rc为引物,通过菌落PCR,发现在约277 bp处有清晰谱带 (图5A),与理论相符;进一步采用RⅠ和Ⅰ对该载体进行双酶切处理,经1%琼脂糖凝胶电泳,发现存在大、小分子量的两条谱带,其中一条约170 bp的小分子量谱带属于目的片段 (图5B);最终通过DNA测序,证明目的片段“”已正确连接至pPIC9K表达载体,并且核苷酸序列未发生任何碱基突变。
线性化的“pPIC9K”电转入毕赤酵母GS115后,经含不同浓度G418的YPD培养基筛选,发现在含4.0 g/L G418的YPD平板上有13株长势良好的酵母转化子,将这些转化子分别点到MM和MD平板上,进一步鉴定其生长表型,结果显示均为正常型Mut+;选择1个高拷贝转化子提取其基因组DNA为模板,采用pPIC9K上的通用引物进行PCR,扩增出一条约644 bp的清晰谱带 (图6),与理论值相符,证明目的基因已成功整合进酵母染色体中。

图3 基于SOE-PCR扩增的串联片段“mCH-mTH”(A) 和对其添加酶切位点的PCR扩增(B)
2.3 在毕赤酵母GS115中表达的重组体mCH-mTH及其纯化
上述经鉴定的高拷贝转化子在BMMY液体培养基中,通过1%甲醇诱导表达120 h。每24 h取样用于Tricine-SDS-PAGE分析,由图7可见,诱导表达24 h时在理论分子量附近有很淡的谱带,48 h时已有明显的谱带,至72 h时表达量达到最高,但因蛋白质分子量标准偏高,不能够显示确切的分子量。随后收集表达72 h的发酵上清,通过SP-Sepharose阳离子交换层析、采用0.0–1.0 mol/L的NaCl浓度梯度洗脱,对目的蛋白进行分离纯化,结果显示,经1.0 mol/L NaCl洗脱的收集液在1.7–4.6 kDa之间有较宽的单一谱带 (图8),表明被分离的目的蛋白纯度较高,经Folin-酚法测定,其浓度为3.2 mg/mL,根据纯化的mCH-mTH的量计算出表达量约为77 mg/L。
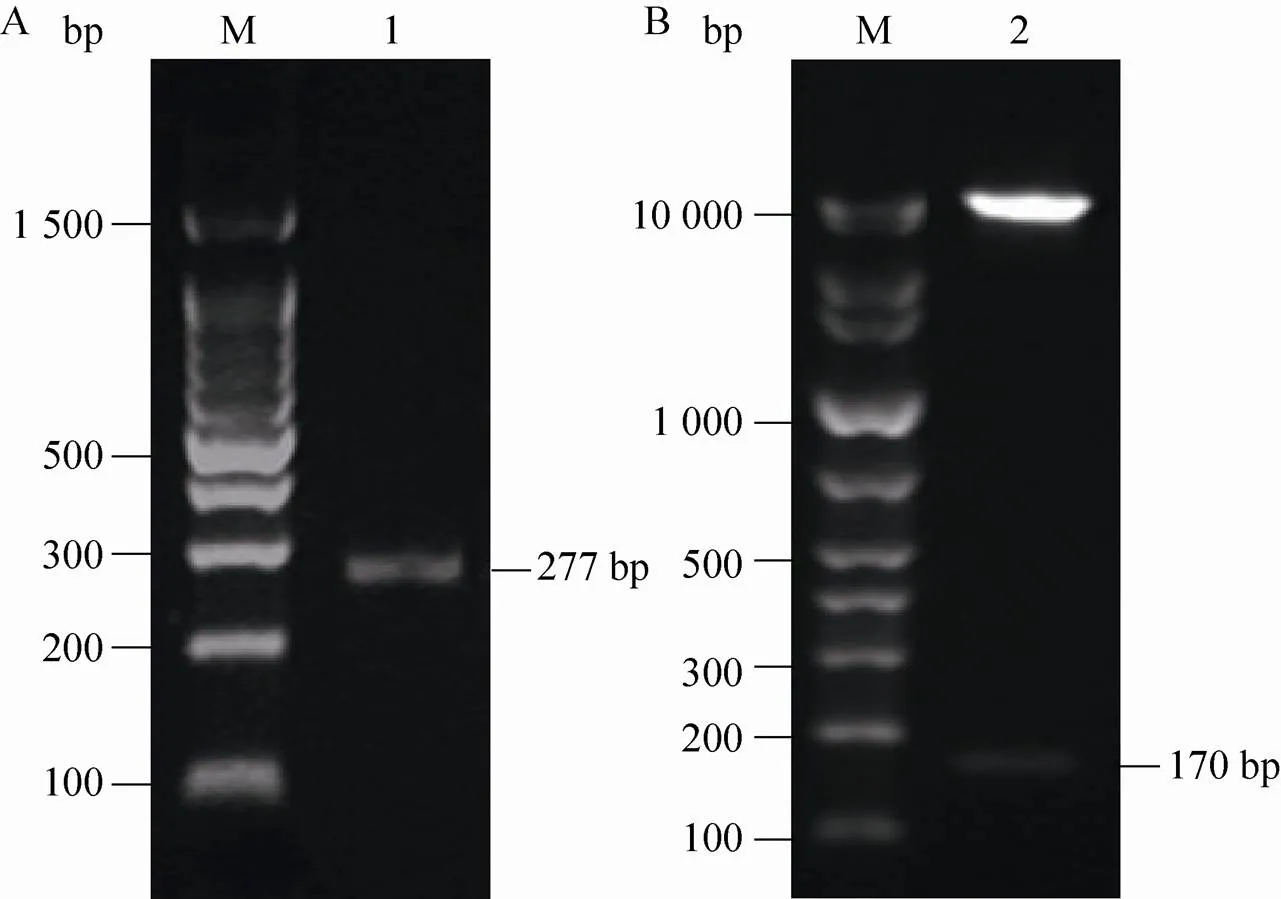
图5 重组表达载体“pPIC9K-mCH-mTH”的菌落PCR (A) 和双酶切鉴定 (B)
2.4 重组体mCH-mTH的抑菌活性
首先,通过琼脂糖弥散法检测了浓度为13.5 mg/mL的浓缩上清的抑菌活性,由图9可见,对金黄色葡萄球菌和铜绿假单胞菌都显示了较明显的抑菌圈。进一步通过微量肉汤稀释法对浓度为1.4 mg/mL的纯化的重组体mCH-mTH进行抑菌活性测定,结果显示,对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、枯草芽胞杆菌、单增李斯特菌、沙门氏菌均有很好的抑制效果,菌株存活率均低于15%,而且对沙门氏菌的抑菌效果最好,其菌株存活率仅为8.4% (图10)。

图6 酵母转化子基因组DNA的PCR鉴定
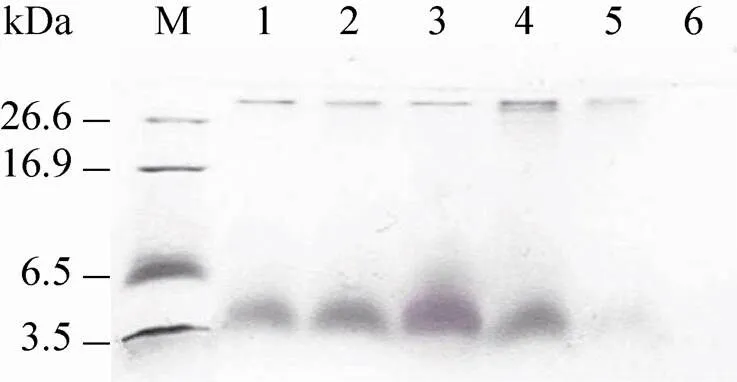
图7 诱导表达不同时间的目的蛋白的Tricine-SDS- PAGE分析

图8 纯化的重组体mCH-mTH的Tricine-SDS-PAGE分析
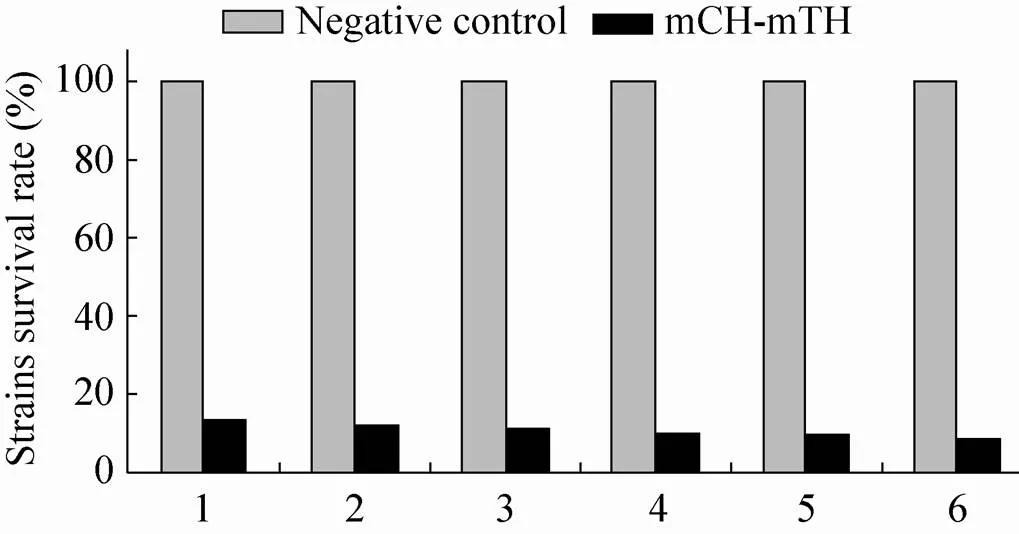
图10 纯化的重组体mCH-mTH的抑菌活性测定
3 讨论
抗菌肽在生物体内含量甚微,且分子量小,对其进行分离纯化困难。迄今为止,已有一些通过化学方法合成抗菌肽的研究报道[21-22],但费用高、活性低。就鱼类hepcidin而言,Huang等报道了化学合成的尼罗罗非鱼hepcidin TH2-2无抑菌活性[13],究其原因可能与化学合成的抗菌肽分子难以形成正确的空间构象有关,以致影响了它们的生物学活性。据此,本研究通过SOE-PCR对编码两种鱼类hepcidin成熟肽的cDNA进行串联,以期提高重组体抗菌肽的表达量和扩大抗菌谱,事实上,与之前未经串联、通过大肠杆菌表达系统获得的单个重组体mCH和mTH的表达量 (47 mg/L) 和抗菌谱 (抗2个革兰氏阳性菌和2个革兰氏阴性菌) 相比,本研究中获得的重组体mCH-mTH显示了更高的表达量 (77 mg/L) 和更广的抗菌谱 (抗3个革兰氏阳性菌和3个革兰氏阴性菌)。采用的毕赤酵母表达系统有助于目的蛋白翻译后的正确折叠,导致其具有良好的生物学活性[23-24];此外,分泌到胞外的目的蛋白便于分离纯化。在目的蛋白的N端以及在“mCH”与“mTH”之间添加Kex 2蛋白酶识别位点,以期使目的蛋白在分泌到胞外的过程中能将信号肽切除以及将两者分开,确保“mCH”和“mTH”的正确折叠。
发酵上清经阳离子交换层析纯化后,经Tricine-SDS-PAGE分析在1.7–4.6 kDa之间仅显示一条较深的宽谱带,但理论上应存在3.2 kDa (mCH) 和2.3 kDa (mTH) 的两个谱带,究其原因可能与两者的等电点很接近有关,采用SP-Sepharose阳离子交换层析无法将其分开,且它们的分子量很接近,Tricine-SDS-PAGE也难以分辨两个谱带。
抑菌实验显示纯化后的目的蛋白对多种革兰氏阳性和阴性菌显示良好的抑菌效果,证明通过本酵母表达系统表达的目的蛋白具有良好的生物学活性。此外,考虑到生产上大规模制备时难以对表达产物进行纯化处理,而是直接对发酵上清进行处理,因此,对发酵上清的抑菌活性进行了检测,结果显示对金黄色葡萄球菌和铜绿假单胞菌均有良好的抑制作用,该结果为hepcidin抗菌肽的产业化生产奠定了良好的基础。
REFERENCES
[1] Bulet P, Stocklin R, Menin L. Antimicrobial peptides: from invertebrates to vertebrates. Immunol Rev, 2004, 198: 169–184.
[2] Chanu KV, Kumar A, Kumar S. Structure–activity relationship of buffalo antibacterial hepcidin analogs. Indian J Biochem Biophys, 2011, 48(5): 325–330.
[3] Nicolas G, Viatte L, Bennoun M, et al. Hepcidin, a new iron regulatory peptide. Blood Cell Mol Dis, 2002, 29(3): 327–335.
[4] Krausea A, Neitz S, Magerth J. LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity. Febs Lett, 2000, 480(2): 147–150.
[5] Park CH, Valore EV, Waring AJ, et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem, 2001, 276(11): 7806–7810.
[6] Tian WJ, Liu JY, Jiang JP. Construction of eukaryotic expression vector of antimicrobial peptide Odorgrin A fromand its transformation into. Chin J Appl Environ Biol, 2010, 16(2): 222–227 (in Chinese).田汶佳, 刘炯宇, 江建平. 无指盘臭蛙皮肤抗菌肽Odorgrin A真核表达载体的构建与转化. 应用与环境生物学报, 2010, 16(2): 222–227.
[7] Dang XW, Li MY, Chang J, et al. Research progress on hepcidin. J Anhui Agri Sci, 2010, 38(7): 3351–3353(in Chinese).党晓伟, 李梦云, 常娟, 等. Hepcidin的研究进展. 安徽农业科学, 2010, 38(7): 3351–3353.
[8] Douglas SE, Gallant JW, Liebscher RS. Identification and expression analysis of hepcidin-like antimicrobial peptides in bony fish. Dev Comp Immunol, 2003, 27(6/7): 589–601.
[9] Hunter HN, Fulton DB, Ganz T, et a1. The solution structure of human hepcidin, a peptide hormone with antimicrobial activity that is involved in iron uptake and hereditary hemochromatosis. J Biol Chem, 2002, 277(40): 37597–37603.
[10] Shike H, Lauth X, Westerman ME, et al. Bass hepcidin is a novel antimicrobial peptide induced by bacterial challenge. Eur J Biochem, 2002, 269(8): 2232–2237.
[11] Yang M, Wang KJ, Chen JH, et al. Genomic organization and tissue-specific expression analysis of hepcidin-like genes from black porgy (B.). Fish Shellfish Immunol, 2007, 23(5): 1060–1071.
[12] Bao BL, Peatman E, Li P, et al. Catfish hepcidin gene is expressed in a wide range of tissues and exhibits tissue-specific upregulation after bacterial infection. Dev Comp Immunol, 2005, 29(11): 939–950.
[13] Huang PH, Chen JY, Kuo CM. Three different hepcidins from tilapia,: Analysis of their expressions and biological functions. Mol Immunol, 2007, 44(8): 1922–1934.
[14] Wang KJ, Cai JJ, Cai L, et al. Cloning and expression of a hepcidin gene from a marine fish () and the antimicrobial activity of its synthetic peptide. Peptides, 2009, 30(4): 638–646.
[15] Chen YH, Chen QH, Chen K, et al. Optimization of coding sequences and expression of antimicrobial peptide magaininⅡinand. Chin J Biotech, 2014, 30(4): 615–624 (in Chinese).陈玉海, 陈庆煌, 陈科, 等. 抗菌肽magaininⅡ的密码子优化及在大肠杆菌和毕赤酵母中的表达. 生物工程学报, 2014, 30(4): 615–624.
[16] Ravi C, Jeyashree A, Devi KR. Antimicrobial peptides from insects: an overview. Resin Biotech, 2011, 2(5): 1–7.
[17] Tao Y, Zhao DM, Wen Y. Expression, purification and antibacterial activity of the channel catfish hepcidin mature peptide. Protein Expres Purif, 2014, 94: 73–78.
[18] Wen Y, Tao Y. Hepcidin from Tilapia,: its fusion expression inand antimicrobial activity. J Shanghai Jiaotong Univ: Agri Sci Ed, 2012, 30(4): 68–75 (in Chinese).文雅, 陶妍. 尼罗罗非鱼Hepcidin抗菌肽在大肠杆菌中的融合表达及其抗菌活性. 上海交通大学学报: 农业科学版, 2012, 30(4): 68–75.
[19] Ho S, Horton R, Hunt H. Site-directed mutagenesis by overlap extension using the polymerase chain reaction. Gene, 1989, 77(1): 51–59.
[20] Cui LW, Yuan QP, Li WJ. Purification and characterization of recombinant human hepcidin expressed in. Biotechnol Bull, 2009, 8: 115–117 (in Chinese).崔力文, 袁其朋, 李文进. 毕赤酵母工程菌人hepcidin的纯化及部分铁代谢活性研究. 生物技术通报, 2009, 8: 115–117.
[21] Zanin LM, Alvares DS, Juliano MA, et al. Interaction of a synthetic antimicrobial peptide with model membrane by fluorescence spectroscopy. Eur Biophys J, 2013, 42(11): 819–831.
[22] Sivertsen A, Isaksson J, Leiros HK, et al. Synthetic cationic antimicrobial peptides bind with their hydrophobic parts to drug site II of human serum albumin. Bmc Struct Biol, 2014, 14(1): 1–14.
[23] Cregg JM, Vedvick TS, Raschke WC. Recent advances in the expression of foreign genes in. Biotechnology, 1993, 11(8): 905–910.
[24] Li Z, Moy A, Sohal K, et al. Expression and characterization of recombinant human secretory leukocyte protease inhibitor (SLPI) protein from. Protein Expres Purif, 2009, 67(2): 175–181.
(本文责编陈宏宇)
Connection of hepcidin genes from two fish species and their expression in
Wenjing Li1, Yan Tao1, Dongmei Zhao1, and Bingbing Xu2
1 Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China 2 Jiangsu Balu Biotechnology Co., LTD., Nantong 226400, Jiangsu, China
Hepcidin are small cationic peptides with antibacterial activity expressed mainly in the liver of living organisms, and they play important roles in the host’s immune response against microbial invasion and regulation of iron metabolism. Thus, they are considered to be good substitutes for traditional antibiotics. It is a good choice that the antimicrobial peptides are prepared by recombinant DNA expression. In the present study, two hepcidin mature peptide cDNAs from channel catfish () ()and tilapia () () were connected by SOE-PCR in order to obtain more recombinant hepcidin with broad antimicrobial spectrum, andR I andI sites were added to5′- and 3′- ends of the fragment, respectively. The recombinant eukaryotic expression vector “pPIC9K-” was successfully constructed, and transformed intoGS115. The transformants containing multicopy gene insertion were selected by using different concentrations of G418 and other specific mediums, and identified by PCR for yeast genomic DNA. Expression was induced by adding 1% methanol at 30oC for different times. Tricine-SDS-PAGE analysis demonstrated that the most appropriate expression time was 72 h, at which a high expression yield (77 mg/L) for the target protein was exhibited. The highly purified target protein was obtained from the fermentation supernatant by SP-Sepharose cation exchange chromatography. Bacteriostatic activity assay demonstrated that the fermentation supernatant containing the target protein and purified recombinant target protein had bacteriostatic activities against gram-positive and gram-negative bacterium. The present result provides the important initial value for industrial production of hepcidin antimicrobial peptide.
antimicrobial peptide, hepcidin mature peptide,,splicing by overlapping extension PCR
September 10, 2014; Accepted:November 15, 2014
Yan Tao. Tel: +86-21-61900384; E-mail: ytao@shou.edu.cn
Supported by:the Industry-University-Research Cooperation of Shanghai Municipal Education Commission(No. 15CXY30), Foundation of Key Laboratory of Urban Agriculture (South), Ministry of Agriculture, P. R. China (No. UA201307).
上海市教育委员会产学研合作项目(No. 15CXY30),农业部都市农业(南方) 重点实验室开放课题(No. UA201307) 资助。

