菊粉酶基因的异源表达、分离纯化及酶学性质
李益民,高教琪,袁文杰,相瑞娟,侯胜博
菊粉酶基因的异源表达、分离纯化及酶学性质
李益民,高教琪,袁文杰,相瑞娟,侯胜博
大连理工大学生命科学与技术学院,辽宁大连 116024

李益民, 高教琪, 袁文杰, 等. 菊粉酶基因的异源表达、分离纯化及酶学性质. 生物工程学报, 2015, 31(5): 670–681.Li YM, Gao JQ, Yuan WJ, et al. Heterologous expression,purification and characterization of exo-inulinase from Kluyveromyces marxianusYX01. Chin J Biotech, 2015, 31(5): 670–681.
为进一步提高菊粉酶在生物技术领域的应用,研究了来源于马克斯克鲁维酵母YX01的菊粉酶性质。通过在毕赤酵母GS115宿主细胞中异源表达该菊粉酶基因 (),获得了一种外切型菊粉酶,经聚丙烯酰胺凝胶电泳 (SDS-PAGE) 验证其分子量为86.0 kDa。进一步在该菊粉酶上增加6个His标签,采用聚乙二醇 (PEG) 20 000透析浓缩和Ni-NTA Agarose静态亲和吸附作用的方法,完成菊粉酶的分离纯化,纯化倍数和酶回收率分别为3.6和33.1%。比较发现粗酶液与纯酶的酶学性质相似,且菊粉酶的最适反应温度为60 ℃,最适pH值为4.62,并测得该酶的m和max值,以菊粉为底物时,m和max值分别为80.53 g/L和4.49 g/(L·min);以蔗糖底物时,m和max值分别为183.10 g/L和20.20 g/(L·min)。金属离子Mn2+、Ca2+、Cu2+、Zn2+和Fe2+对酶活力具有不同程度的抑制作用,其中Cu2+、Zn2+和Fe2+的抑制作用最为显著。这些研究为进一步提高菊粉酶在工业化的应用奠定了基础。
马克斯克鲁维,菊粉酶,重组表达,分离纯化,酶学性质
菊粉存在于许多植物的根和块茎中 (如菊芋、大丽花和菊苣),是一种具有代表性的非粮食作物[1]。菊粉酶(Inulinase) 是一类能够水解菊粉β-2,1-D-果聚糖果糖糖苷键的水解酶[2-4],根据对菊粉的作用方式,可分为内切型菊粉酶(Endoinulinase,EC 3.2.1.7) 和外切型菊粉酶(Exoinulinase,EC 3.2.1.80)[1,5-6]。内切型菊粉酶随机水解菊粉内部的β-2,1-果聚糖果糖糖苷键,形成低聚三糖、四糖和五糖,主要水解产物是低聚果糖;外切型菊粉酶与菊粉分子链非还原性末端的糖苷键发生作用,逐个分离果糖单元,主要水解产物是果糖[7-8]。内切型菊粉酶和外切型菊粉酶的区分常用值的大小来作为酶学性质的指标,其中是以菊粉为底物时的酶活,是以蔗糖为底物时的酶活。一般以=1作为区分界限,外切型菊粉酶的值低(小于1),内切型菊粉酶的值高(大于1)[9-10]。
天然菊粉酶的产生菌株主要包括丝状真菌、酵母和细菌,如克鲁维酵母属、曲霉属、葡萄球菌属、黄单胞菌属和假单胞菌属。在这些微生物中,由于丝状真菌和酵母属的菊粉酶生产水平优于细菌,因此报道和研究较多的有乳酸克鲁维酵母[11-12]、,乳酒假丝酵母、德巴利酵母菌、青霉菌属sp.和曲霉菌属sp.等[13-14];异源表达菊粉酶的过程中,目的基因可来自于丝状真菌 (例如:黑曲霉inu-8)[15]、酵母 (例如:)[16]和细菌 (例如:多粘芽胞杆菌ZJ-9)[1],从细菌克隆的菊粉酶基因也能像丝状真菌和酵母来源的一样,很好地在其他工业菌种中表达。此外,毕赤酵母是菊粉酶异源表达中最常见的宿主菌株之一,目前研究较多的表达宿主GS115、PMAD11、PMAD16、KM17、X-33、SMD1168等,均为野生型石油酵母Y11430突变产生,绝大多数是以甲醇作为唯一碳源的甲醇营养缺陷型酵母[17]。最后,将异源菊粉酶基因通过不同的表达载体,如常用的酵母表达载体:整合型载体 (YIp) 和附加型载体 (YEp),转入到宿主菌株中,实现菊粉酶的异源表达。
国内外菊粉酶的研究方向主要包括产酶菌株的筛选、产酶条件的优化、诱导育种、菊粉酶的分离纯化以及利用微生物源菊粉酶生产超高果糖浆和生物乙醇发酵。目前,对菊粉酶及产生菌株的固定化技术和菊粉的水解工艺方向的研究也日益深入[18]。菊粉酶以菊粉作为原料生产高果糖浆、低聚果糖、乙醇以及其他新型经济产品,在食品、医药、保健等领域具有广泛的应用价值和巨大的经济价值[19-20]。然而,正常发酵条件下菊粉酶分泌表达不足或酶稳定性较差阻碍了其工业化生产的进程。
在前期的研究中,本实验室筛选得到一株马克斯克鲁维酵母YX01,它是能发酵菊芋生产乙醇且具有耐热特性的优良菌株,可能存在性质不同的菊粉酶。因此,本文对该菊粉酶基因的克隆、异源表达、酶的分离纯化和酶学性质进行研究,为进一步提高其在生物技术中的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂
马克斯克鲁维酵母YX01 (ATCC8554,本实验室驯化保存);大肠杆菌DH5α (本实验室保存);毕赤酵母GS115 (本院杨青教授实验组赠予)。
YPD培养基(g/L):酵母提取物10.0,蛋白胨20.0,葡萄糖20.0;若需要固体培养基则再加入2.0% (/) 的琼脂,121 ℃灭菌20 min。
LB培养基(g/L):酵母提取物5.0,胰蛋白胨10.0,NaCl 10.0;若需要固体培养基则再加入2.0% (/) 的琼脂,121 ℃灭菌20 min。
RDB转化培养基:超纯水80 mL,山梨醇18.6 g (186 g/L),琼脂粉2.0 g (20 g/L);121 ℃灭菌20 min,待温度降至60 ℃后,在超净工作台内加入10×YNB 10.0 mL、10×D (20%葡萄糖) 10.0 mL、100×B (0.004%生物素) 1.0 mL、100×AA (0.5%各种氨基酸) 1.0 mL,混匀倒平板。
BMGY诱导表达培养基(g/L):酵母提取物10.0,蛋白胨20.0,K2HPO43.0,KH2PO411.8,超纯水885 mL;121 ℃灭菌20 min,待温度降至60 ℃后,在超净工作台内加入10×YNB 100.0 mL、100×B 5.0 mL、甘油10.0 mL。
BMMY诱导表达培养基(g/L):酵母提取物10.0,蛋白胨20.0,K2HPO43.0,KH2PO411.8,超纯水890 mL;121 ℃灭菌20 min,待温度降至60 ℃后,在超净工作台内加入10×YNB 100.0 mL、100×B 5.0 mL、甲醇5.0 mL。
PCR产物纯化试剂盒(Cycle-pure kit)、胶回收纯化试剂盒(Gel extraction kit) 和质粒提取试剂盒(Plasmid mini kit I),均购自Omega公司;Bradford蛋白浓度测定试剂盒,购自北京Solarbio公司;比利时进口菊粉聚合度为10–20;此外,Ⅱ、Ⅰ、Ⅰ、DNA聚合酶、10×PCR 缓冲液、dNTP Mixture、T4DNA连接酶、10×T4 DNA缓冲液、10×H缓冲液、0.1% BSA缓冲液、1 kb DNA ladder (Dye plus)、 DL2 000 DNA marker等分子试剂均购自 TaKaRa 公司;Ni-NTA Agarose,购自QIAGEN公司;其他试剂为国产分析纯以上。
1.1.2 仪器与设备
低温振荡培养箱(ZQZY-70B,上海知楚仪器);酶标仪(Thermo);台式高速冷冻离心机(Sigma公司);紫外投射反射仪(上海精科实业有限公司);PCR Thermal Cycler Dice (TaKaRa公司) 等。
1.2 方法
1.2.1 引物设计与DNA扩增
以YX01酵母基因组DNA作为模板,以IF (5′-CCGATGAAGTTCGCA TACTCC-3′) 和IR(5′-ATAAGAATTC AATGATGATGATGATGATGAACGTTAAATTGGGT-3′) 为引物进行PCR扩增,纯化回收PCR产物。其中引物IF和IR中,小写斜体为引物的Ⅰ和Ⅰ酶切位点,IR上粗体标记了6×His标签用于后续的分离纯化。
1.2.2 构建重组载体与阳性转化子的筛选
将纯化后PCR产物与载体质粒pPIC9均用Ⅰ和Ⅰ进行双酶切处理,切胶纯化后使用T4 DNA连接酶16 ℃下过夜连接。热击法将重组质粒 pPIC9-inu转化至大肠杆菌DH5α细胞中,测序验证。提取测序正确的重组质粒,根据质粒上限制酶Ⅱ的两个酶切位点,获得线性重组质粒pPIC9-inu,并通过电击转化法转入毕赤酵母GS115感受态细胞中,温育5 h后涂布于RDB平板,30 ℃倒置培养2 d。
同时,由于毕赤酵母GS115为组氨酸缺陷型,而载体上带有4基因,两者均不能单独在RDB转化平板(无His) 上生长,只有整合的转化子才可以生长的原理,进行转化子的第一次筛选。且由于外源基因的整合,阳性转化子利用甲醇的能力降低,利用阳性转化子在以甲醇为唯一碳源的培养基上生长缓慢或不能正常生长的原理,从RDB转化平板上挑取单菌落分别用无菌牙签接种到MD和MM选择培养基上,筛选能在MD选择培养基上正常生长,但是在MM选择培养基上不能生长或生长缓慢的阳性转化子,并进行PCR验证。
1.2.3 菊粉酶的异源表达与分离纯化
将PCR鉴定正确的阳性转化子接种到 50 mL的BMGY增殖培养基中(250 mL三角瓶盛装),30 ℃、150 r/min培养2 d后,离心收集细胞,按照20%的接种量接种到100 mL的BMMY诱导培养基中,30 ℃、150 r/min诱导培养,每间隔12 h取样,测发酵液的生物量、蛋白浓度,以及采用DNS法在540吸光值条件下测菊粉酶酶活,并毎间隔24 h补加1%的甲醇(已过膜除菌)。发酵192 h后终止发酵,使用低温冷冻离心机4 ℃、5 000 r/min离心10 min收集发酵上淸液。
将适当的上清液加入透析袋内,利用聚乙二醇(PEG 20 000) 的吸水作用,浓缩液体。然后,采用Ni-NTA Agarose静态亲和吸附法分离纯化菊粉酶:利用菊粉酶的His标签与Ni-NTA Agarose之间的亲和作用,使其吸附在Ni-NTA Agarose上,缓冲液洗脱杂蛋白后,再用高咪唑浓度的洗脱液少量多次洗脱得到菊粉酶的单一纯酶溶液。
1.2.4 SDS-PAGE与菊粉酶活性的测定
采用SDS-PAGE测定菊粉酶分子质量,使用10%的分离胶和5%的浓缩胶,浓缩胶电泳条件:80 V,50 min,分离胶电泳条件:120 V,60 min。考马斯亮蓝染色3 h,用脱色液过夜脱色。
研究该菊粉酶的酶切作用方式:取50 μL洗脱液(纯菊粉酶),加入450 μL 5%菊粉溶液 (0.1 mol/L HAc-NaAc,pH 4.6缓冲液) 60 ℃水浴反应10 min后,立即沸水浴5 min灭活,采用DNS法测定还原糖的含量(mg);取50 μL洗脱液(纯菊粉酶) 沸水浴5 min灭活,同上条件反应作对照组。用表示,以菊粉为底物时,每分钟产生1 μmol还原糖所需要的酶量。用5%蔗糖溶液代替5%菊粉溶液,在相同条件下,同上反应。用表示,以蔗糖为底物时,每分钟产生1 μmol还原糖所需要的酶量。
1.2.5 菊粉酶的最适温度及热稳定性
实验组:向50 μL 酶液中加入450 μL 5%菊粉溶液(0.1 mol/L HAc-NaAc,pH 4.6缓冲液) 分别置于不同温度(30–80 ℃) 的水浴锅中反应10 min后,立即沸水浴5 min灭活,测定不同温度下的酶活;对照组:取50 μL 酶液沸水浴5 min灭活,反应条件同上。此外,将酶液分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃的水浴锅中保温30 min后,立即冰浴冷却,60 ℃反应10 min测定不同温度下的残留酶活,以4 ℃保存的酶活力为100%,求出其他温度的相对残留酶活。
1.2.6 菊粉酶的最适pH及酸碱稳定性
实验组:分别用pH 2.81、3.68、3.92、4.72、5.72 (0.2 mol/L HAc-NaAc缓冲液) 和6.12、7.15、8.20 (0.2 mol/L Na2HPO4-NaH2PO4缓冲液) 配制5% (/) 菊粉溶液,60 ℃反应10 min测定不同pH值条件下的酶活;对照组:取50 μL 酶液沸水浴5 min灭活,反应条件同上。将酶分别在上述pH值的缓冲液中30 ℃放置30 min后,测定其残余酶活力,以未保温酶液的酶活力作为100%。
1.2.7 金属离子对酶活力的影响
向酶反应体系中加入不同的金属离子,使其终浓度达到10 mmol/L,并以未加金属离子(用相同体积的双蒸水代替) 处理酶的酶活力为100%,求出加入不同金属离子后的相对残留 酶活。
1.2.8 菊粉酶对菊粉和蔗糖底物的催化动力学
本实验采用Lineweaver-Burk双倒数作图法测定m和max值,根据米氏方程的双倒数表达式(1):
以1/[]为横坐标,以1/为纵坐标作图,得到一条直线。根据直线的纵截距可求出max值,再由斜率计算得到m值。以菊粉和蔗糖分别作为底物,在不同的底物浓度(2%、3%、4%、5%、6%、7%、10% 0.1 mol/L HAc-NaAc) 以及最适反应温度和最适pH值的条件下反应 10 min,测定反应产物中还原糖的增加量,并规定酶反应的初始速率为产物在单位时间内还原糖的增加量[21]。
2 结果与分析
2.1 菊粉酶基因表达载体的构建
首先以YX01酵母的基因组为模板,IF/IR为引物扩增出菊粉酶基因(),大小约为1.7 kb,与NCBI所公布的菊粉酶基因(GenBank Accession No. EU719651) 大小一致;然后,将Ⅰ和Ⅰ双酶切纯化后的目的基因() 与质粒pPIC9连接,并热击转化至大肠杆菌DH5α感受态细胞,提取重组质粒,进行菌液PCR、双酶切验证和测序,结果如图1所示,证明表达载体构建成功。
2.2 表达载体的转化与转化子验证
将切胶回收的限制酶Ⅱ单酶切重组质粒pPIC9-线性片段,电转至毕赤酵母GS115感受态细胞中,温育5 h后涂布于RDB转化平板,30 ℃倒置培养2 d。结果发现实验组的RDB转化平板上有若干单菌落生长,阴性对照组(只有GS115感受态细胞) 的RDB转化平板上无单菌落生长,证明重组质粒的线性片段已整合到酵母基因组上。
从RDB转化平板上挑取单菌落分别用无菌牙签接种到MD和MM选择培养基上,并挑取在MD选择培养基上正常生长,而在MM选择培养基上不生长或生长缓慢的转化子,接种到YPD液体培养基中,30 ℃、150 r/min培养20 h后,提取其基因组并进行PCR验证,结果如图2所示,阴性对照(PCR验证反应体系中不加基因组模板而加ddH2O) 无目的条带;实验组4–10号未验证出结果,说明筛选获得的转化子中存在一定的假阳性;阳性对照(PCR验证反应体系中以YX01基因组为模板) 和实验组3、11、12号PCR验证出目的条带,完成了阳性转化子的筛选和鉴定。
2.3 菊粉酶的诱导表达及分子量
将PCR验证正确的阳性转化子,在用BMGY培养基30 ℃增殖培养2 d后,离心收集菌体换BMMY诱导培养基培养(平行实验),每间隔12 h取样一次,每间隔24 h补加1%的甲醇,诱导培养8 d后,终止发酵收集上清液。用0.1 mol/L的柠檬酸钠10倍稀释发酵液,620测量生物量,用Bradford蛋白浓度测定试剂盒稀释后测发酵结束后的蛋白浓度,采用DNS法测发酵液酶活,每单位菊粉酶酶活力定义为:以菊粉为底物,在pH 4.6 (0.1 mol/L NaAc-HAc缓冲液)、60 ℃的反应条件下,每分钟内产生 1 μmol果糖所需要的酶量,即定义为一个酶活力单位(U)。粗酶发酵上清液液生物量和酶活力随时间的变化曲线,结果如图3所示,菌体的生物量在156 h后620达到峰值为4.84;菊粉酶酶活力在用1%甲醇连续诱导180 h后达到峰值为54.91 U/mL,计算求得粗酶液中菊粉酶的最高比活力为2 614.76 U/mg。根据组成菊粉酶的各种氨基酸分子量计算,菊粉酶的理论分子量为65.0 kDa。而SDS-PAGE结果显示纯菊粉酶的分子量大小约为86.0 kDa,结果如图4所示。分析认为,菊粉酶分子量的增加很可能是由于其序列中存在一些糖基化位点,因而在毕赤酵母表达系统中出现大量的糖基化修饰(包括N-糖基化和O-糖基化) 导致电泳图中目的条带较宽,菊粉酶分子量增加,使得在SDS-PAGE中迁移速率改变。

图1 重组质粒的双酶切验证及抗性菌株的PCR验证

图2 重组酵母的PCR验证
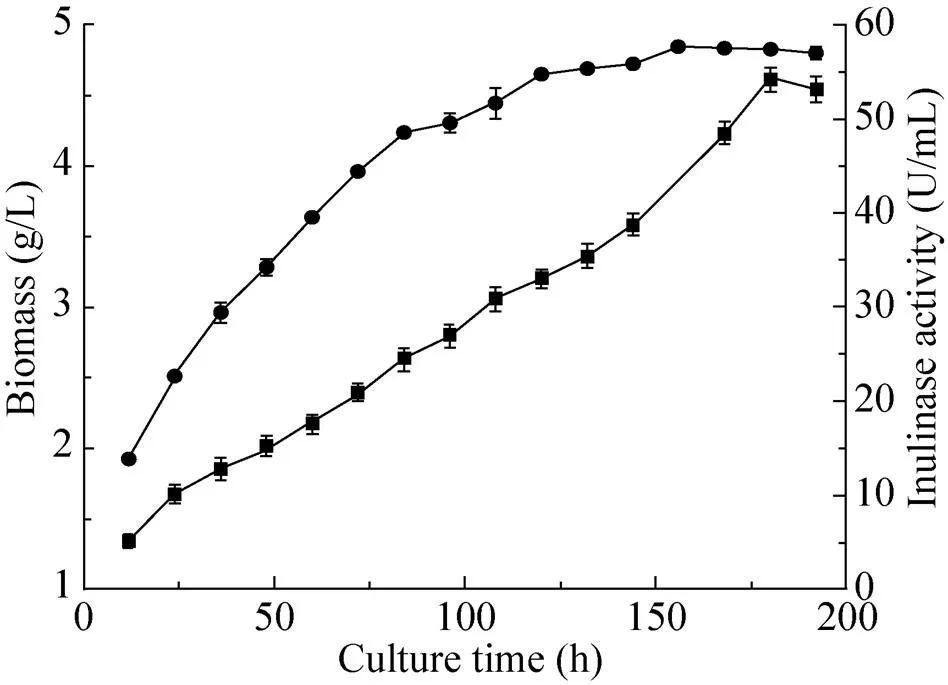
图3 生物量与酶活力随时间的变化曲线
2.4 菊粉酶的分离纯化及酶切性质
本实验中分离纯化粗酶液中菊粉酶的步骤简便快捷,采用两步法即可获得高比活力的菊粉酶。首先,通过聚乙二醇 (PEG 20 000) 透析浓缩粗酶液,将250 mL的粗酶液浓缩至40 mL,浓缩倍数为6.25,由于透析袋的孔径大小为 8 000,分子量小于8 000的杂蛋白可以透过,所以也能够起到去除杂蛋白的作用。然后,通过Ni-NTA Agarose静态亲和吸附的方式吸附菊粉酶蛋白[22],去除了所有的残余杂蛋白,洗脱后完成了对菊粉酶的纯化。在浓缩过程中,几乎没有目标蛋白的损失,浓缩前总酶活为 13 750.0 U,浓缩后总酶活为13 200.0 U,酶回收率为96.0%;纯化前菊粉酶的比活力为 2 632.1 U/mg,而纯化后菊粉酶的比活力为 9 448.1 U/mg,纯化倍数为3.6;取5 mL浓缩液加入5 mL缓冲液稀释后的总酶活为1 650.0 U,吸附纯化后测得总酶活为546.0 U,因此最终酶回收率为33.1%。
研究菊粉酶的作用方式通常是以值作为区分依据,本实验分别以菊粉和蔗糖为底物,测得菊粉酶的值为0.436 (<1),因此属于外切型菊粉酶。

图4 重组蛋白的SDS-PAGE分析
2.5 温度对菊粉酶活性的影响
本实验设立不同的温度梯度 (30–80 ℃),与5%菊粉溶液 (0.1 mol/L HAc-NaAc,pH 4.6缓冲液) 反应10 min。结果如图5所示,菊粉酶纯酶的最佳反应温度是60 ℃。将酶液分别置于30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃的水浴锅内保温30 min,再与5%菊粉溶液 (0.1 mol/L HAc-NaAc,pH 4.6缓冲液) 60 ℃反应10 min,测定温度对酶热稳定性的影响,结果如图5所示,菊粉酶纯酶在30–50 ℃之间热稳定性较好,30 ℃、40 ℃下保温30 min,分别能保留99.9%和87.7%的酶活力,在40 ℃下保温 100 min,仍能保留46.4%的酶活力;但是,一旦温度超过50 ℃,该菊粉酶的热稳定性迅速下降直至基本丧失活性,60 ℃下保温30 min后,残余酶活力不足10.0%。此外,将少量酶置于4 ℃保存25 d后,酶活不损失,因此该酶可以在较低温度下长时间保存。
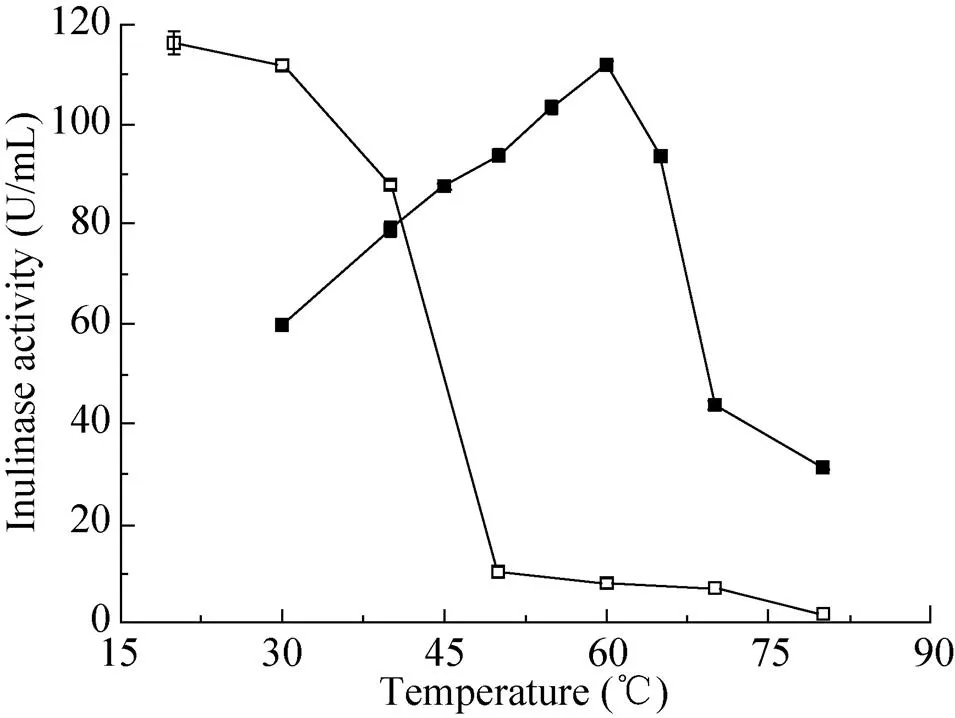
图5 温度对酶活性与酶稳定性的影响
2.6 pH对菊粉酶活性的影响
在最适反应温度为60 ℃的反应条件下,将酶液与菊粉分别在不同pH值 (2.81、3.68、3.92、4.62、5.72、6.12、7.15、8.20) 的0.2 mol/L缓冲液中反应10 min,测定该菊粉酶的最适pH值,结果如图6所示,最适pH值为4.62。当pH高于或低于4.62时,菊粉酶的活性迅速降低。同时,研究发现pH对酶稳定性的影响较小,在pH 4.60–5.20范围内,酶稳定性更佳。
2.7 金属离子对菊粉酶活性的影响
金属离子对该菊粉酶酶活力的影响如图7所示。从图中可知,K+和Mg2+对酶活力没有明显的影响;而金属离子Mn2+、Ca2+、Cu2+、Zn2+和Fe2+对菊粉酶酶活力具有不同程度的抑制作用,其中Cu2+、Zn2+和Fe2+的抑制作用最为 显著。
2.8 菊粉酶的m和max值
本实验分别以菊粉和蔗糖作为底物,在最适温度为60 ℃、最适pH值为4.62的反应条件下,与不同浓度的底物(2%、3%、4%、5%、6%、7%、10% 0.1 mol/L HAc-NaAc) 反应 10 min,测出了产物中还原糖的增加量,结果如图8所示,并根据Lineweaver-Burk双倒数作图法测定m和max值,其中m值分别为80.53 g/L和183.10 g/L,max值分别为4.49 g/(L·min) 和20.20 g/(L·min)。
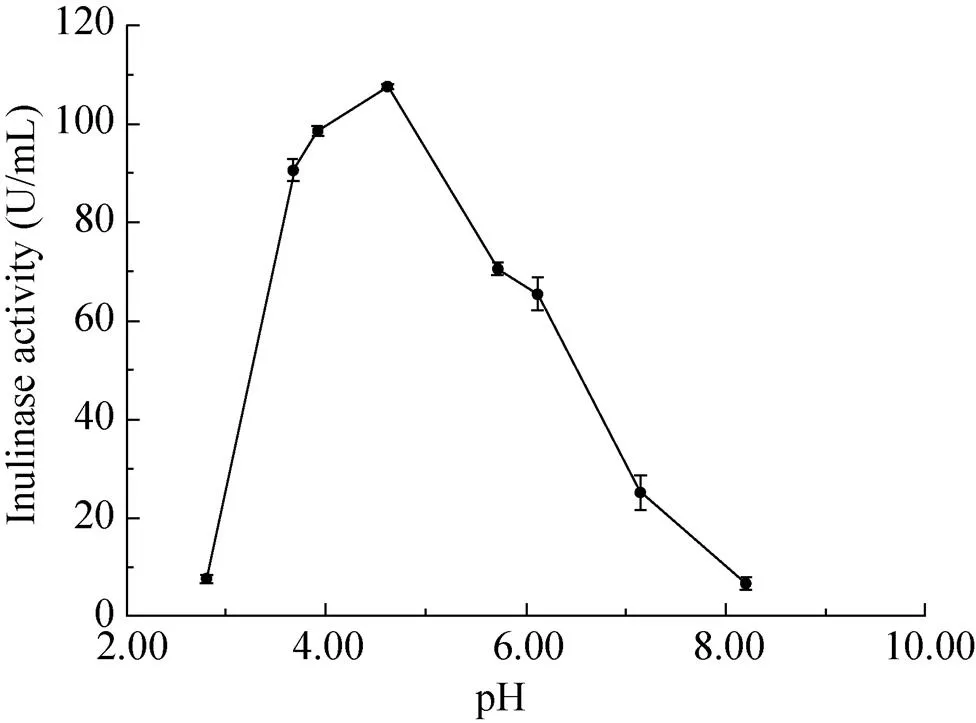
图6 pH对酶活性的影响
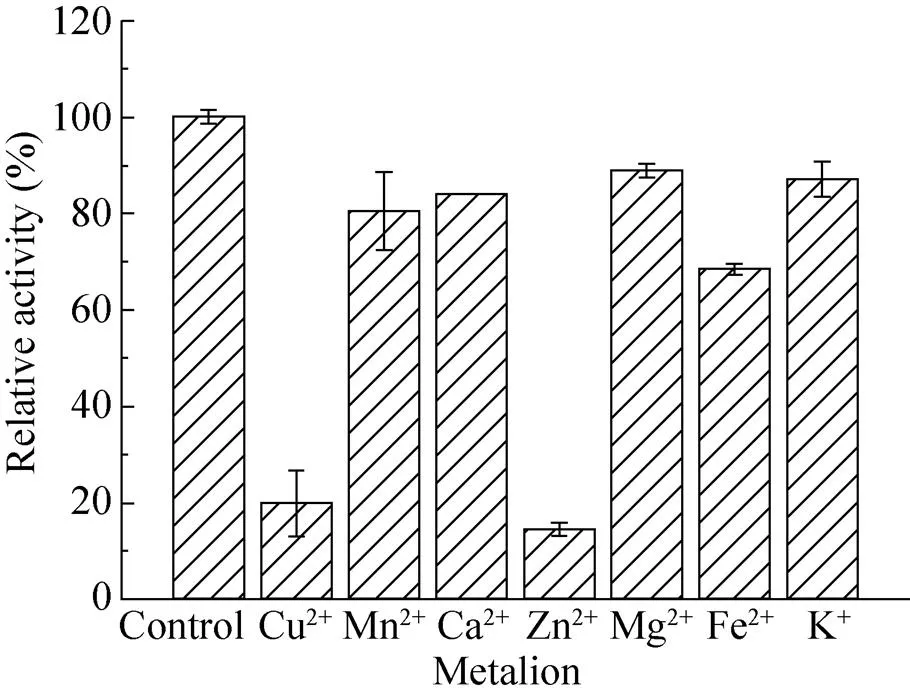
图7 金属离子对酶活力的影响
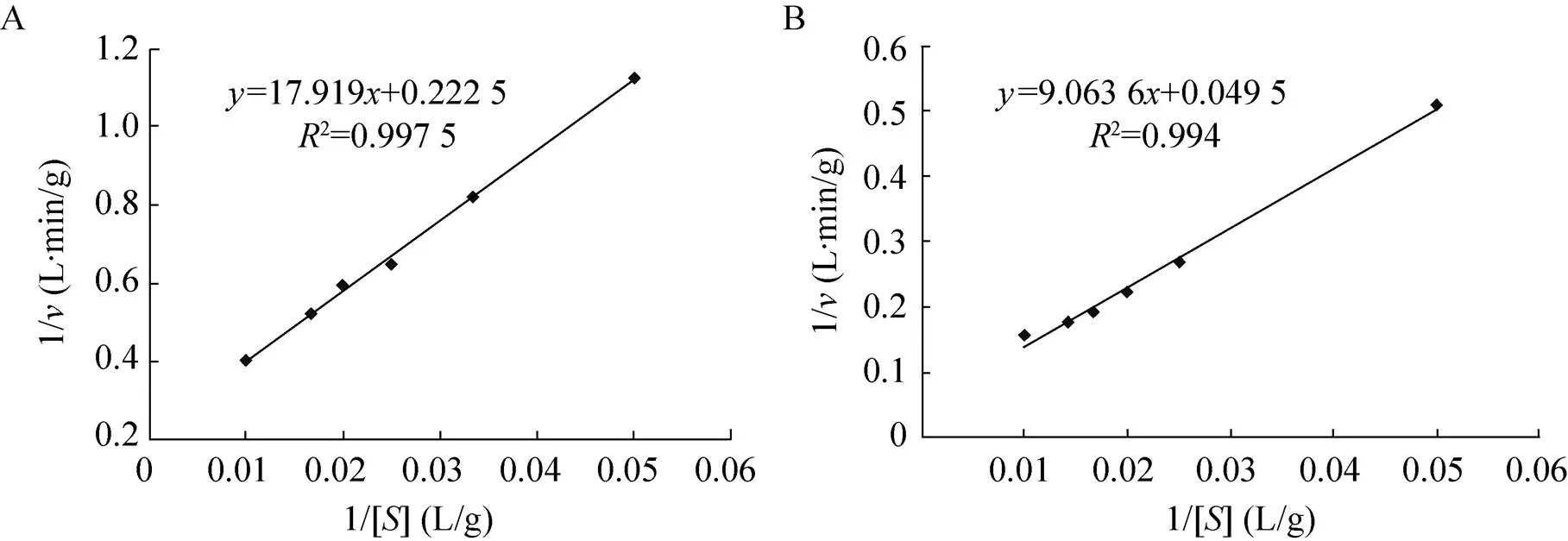
图8 菊粉酶的1/v和1/[S]关系图(A:菊粉作为底物;B:蔗糖作为底物)
3 讨论
通过分子生物学手段扩增了YX01菊粉酶基因(),并构建了重组基因表达载体,实现了菊粉酶基因的异源表达。本研究所得菊粉酶的氨基酸序列,用Clustal X软件与其他文献报道序列比对分析,发现该菊粉酶具有与它们相一致的菊粉酶保守序列(WMNXPNGL) 和(RDPKVF)[24]。本实验为了后续分离纯化实验,导入了6个His标签,发酵过程中检测到酶活力,说明His标签并不影响酶的活性;在诱导表达过程中,菊粉酶分泌表达量达到最高时的诱导时间天数为7 d,之后由于培养基内营养物质的缺乏,有毒物质的逐渐积累,菌体逐渐死亡,酶活力在从8 d开始降低。和其他菊粉酶异源表达研究文献相比较,本实验中菌体生物量和酶活力达到峰值所需的诱导时间较长,分析认为,可能与发酵过程中培养基配方、摇床转数、摇瓶大小和发酵液体积等因素有关,后续应优化培养条件,实现菊粉酶的快速分泌表达。
在酶的分离纯化过程中,通过两步法便捷的获得了菊粉酶的纯酶液,纯化倍数为3.6,最终酶回收率为33.1%。经SDS-PAGE验证,菊粉酶分子量增加,分析认为可能是由于多糖基化修饰作用的影响。对菊粉酶的酶学性质的结果表明该酶为外切型菊粉酶,最适温度为60 ℃,最适pH值为4.62,并测得该酶的m和max值,以菊粉为底物时,m和max值分别为80.53 g/L和4.49 g/(L·min);以蔗糖底物时,m和max值分别为183.10 g/L和20.20 g/(L·min)。孔令坚等[25]和熊伍平等[26]报道,金属离子Mn2+、Mg2+、Ca2+以及K+对菊粉酶的酶活力具有显著的促进作用,但本实验中这些金属离子对菊粉酶未发现明显的促进作用;而金属离子Cu2+、Zn2+和Fe2+对该菊粉酶酶活力具有显著的抑制作用,与报道结果相一致。同时,与已报道的马克斯克鲁维酵母DSM 5418菊粉酶 (编码基因GenBank Accession No. JQ411233) 相比,两者基因同源性达到99%,来源于YX01菊粉酶基因仅在第73、211和400位的氨基酸发生突变,但菊粉酶最适反应温度较高,最适pH值低,因而推测这3个突变的氨基酸影响了菊粉酶的酶学性质,使得该菊粉酶在高温、低pH的生产条件下具有更加良好的应用性。但研究发现,该酶的热稳定性较差,超过50 ℃以后酶活性迅速下降,这可能是导致其酶活力偏低,制约其工业化生产的关键因素。
REFERENCES
[1] Gao J, Xu YY, Yang HM, et al. Gene cloning, expression, and characterization of an exo-inulinase fromZJ-9. Appl Biochem Biotechnol, 2014, 173(6): 1419–1430.
[2] Gong F, Zhang T, Chi Z, et al. Purification and characterization of extracellular inulinase from a marine yeastand inulin hydrolysis by the purified inulinase. Biotechnol Bioprocess Eng, 2008, 13(5): 533–539.
[3] Wang L, Huang Y, Long X, et al. Cloning of exoinulinase gene fromstrain B01 and its high-level expression in. J Appl Microbiol, 2011, 111(6): 1371–1380.
[4] Seok-Hwan L, Hongweon L, Dai-Eun S, et al. Recombinant production of an inulinase in agal80 strain. J Microbiol Biotechnol, 2010, 20(11): 1529–1533.
[5] He M, Wu D, Wu J, et al. Enhanced expression of endoinulinase fromby codon optimization inand its application in inulooligosaccharide production. J Ind Microbiol Biotechnol, 2014, 41(1): 105–114.
[6] Coitinho JB, Guimarães VM, de Almeida MN, et al. Characterization of an exoinulinase produced byCCT 4083 grown on sugar cane bagasse. J Agric Food Chem, 2010, 58(14): 8386–8391.
[7] Yuan B, Hu N, Sun J, et al. Purification and characterization of a novel extracellular inulinase from a new yeast speciessp. nov. KRF1T. Appl Microbiol Biotechnol, 2012, 96(6): 1517–1526.
[8] Chen XM, Chen HQ, Chen TX, et al. Enzymatic properties and molecular biology of inulinase. J Food Sci Biotechnol, 2009, 28(5): 577–588 (in Chinese).陈晓明, 陈寒青, 陈天祥, 等. 菊粉酶的酶学特性与分子生物学. 食品与生物技术学报, 2009, 28(5): 577–588.
[9] Jiu M, Wang LJ. Purification and enzymatic properties of inulinase from. Food Sci, 2010, 31(3): 198–202 (in Chinese).纠敏, 汪伦记. 马克斯克鲁维酵母菊粉酶的分离纯化和酶学性质研究. 食品科学, 2010, 31(3): 198–202.
[10] Wang J, Jin ZY. The research development on production of inulinase from microorganism. Biotechnology, 2002, 12(2): 42–45 (in Chinese).王静, 金征宇. 微生物菊粉酶的研究进展. 生物技术, 2002, 12(2): 42–45.
[11] Liu GL, Chi Z, Chi ZM. Molecular characterization and expression of microbial inulinase genes. Crit Rev Microbiol, 2013, 39(2): 152–165.
[12] Yu J, Jiang JX, Fang Z, et al. Enhanced expression of heterologous inulinase inby disruption ofgene. Biotechnol Lett, 2010, 32(4): 507–512.
[13] Rocha J R, Catana R, Ferreira BS, et al. Design and characterisation of an enzyme system for inulin hydrolysis. Food Chem, 2006, 95(1): 77–82.
[14] Kalil S J, Maugeri-Filho F, Rodrigues MI. Ion exchange expanded bed chromatography for the purification of an extracelular inulinase from. Process Biochem, 2005, 40(2): 581–586.
[15] Wang JH, Wu YB, Li GL, et al. Enzymatic characteristics of inulinase frominu-8. Hubei Agric Sci, 2009, 48(10): 2414–2417 (in Chinese).王建华, 吴艳兵, 李广领, 等. 一株黑曲霉菌株所产菊粉酶的酶学性质. 湖北农业科学, 2009, 48(10): 2414–2417.
[16] Yu J. Expression and application of inulinase from[D]. Shanghai: Fudan University, 2010 (in Chinese).俞静. 鹰嘴豆孢克鲁维酵母菊粉酶的分泌表达与应用研究[D]. 上海: 复旦大学, 2010.
[17] Zhang LJ. Molecular cloning of inulinase gene and expression in[D]. Ji’nan: Shandong University, 2012 (in Chinese).张丽娟. 菊粉酶基因克隆及在毕赤酵母中表达[D]. 济南: 山东大学, 2012.
[18] Zheng ZH, Liu YY, Cai WZ, et al. Screening of yeast strains for inulinase production and fermentation conditions. J Xiamen Univ: Nat Sci Ed, 1993, 32(3): 360–364 (in Chinese).郑忠辉, 刘月英, 蔡文铮, 等. 菊粉酶高活力菌株的筛选和发酵条件的研究. 厦门大学学报:自然科学版, 1993, 32(3): 360–364.
[19] Chen XM, Xu XM, Jin ZY, et al. Expression of an exoinulinase gene frominand its characterization. Carbohydr Polym, 2013, 92(2): 1984–1990.
[20] Li Y, Liu GL, Chi ZM. Ethanol production from inulin and unsterilized meal of Jerusalem artichoke tubers bysp. W0 expressing the endo-inulinase gene fromsp. Bioresour Technol, 2013, 147: 254–259.
[21] Gao W. Screening of thermo-stable bacteria and characterization of inulinase[D]. Dalian: Dalian University of Technology, 2008 (in Chinese).高威. 产菊粉酶耐热细菌的筛选及酶学性质研究[D]. 大连: 大连理工大学, 2008.
[22] Wan W, Wang DM, Gao XL, et al. Expression of family 3 cellulose-binding module (CBM3) as an affinity tag for recombinant proteins in yeast. Appl Microbiol Biotechnol, 2011, 91(3): 789–798.
[23] Wang JH. Review on gene structure, enzymology, fermentation and application studies on microorganism inulinase. Nat Prod Res Dev, 2001, 13(1): 83–89 (in Chinese).王建华. 微生物菊粉酶基因结构、酶学性质与应用研究进展. 天然产物研究与开发, 2001, 13(1): 83–89.
[24] Zhang T, Gong F, Chi Z, et al. Cloning and characterization of the inulinase gene from a marine yeastand its expression in. Antonie Van Leeuwenhoek, 2009, 95(1): 13–22.
[25] Kong LJ, Shi Y, Chen X. Enzymatic properties of inulinase fromS120. Food Res Dev, 2012, 33(5): 165–167 (in Chinese).孔令坚, 石勇, 陈雄. 克鲁维酵母菊粉酶的酶学特性研究. 食品研究与开发, 2012, 33(5): 165–167.
[26] Xiong WP, Wang CH, Lu Y, et al. Cloning, expression and characterization of exo-inulinase fromDSM 5418. Chin J Bioprocess Eng, 2013, 11(3): 40–45 (in Chinese).熊伍平, 王成华, 陆雁, 等. 一个外切菊粉酶基因的克隆表达及酶学性质. 生物加工过程, 2013, 11(3): 40–45.
(本文责编 郝丽芳)
Heterologous expression,purification and characterization of exo-inulinase fromYX01
Yimin Li, Jiaoqi Gao, Wenjie Yuan, Ruijuan Xiang, and Shengbo Hou
,,116024,,
To improve the inulinase application in biotechnology, the characteristic of inulinase fromYX01 was investigated. Thegene ofYX01 was transformed intoGS115 host cells with molecular biology techniques. Then we achieved the heterologous expression of exo-inulinase whose molecular mass was about 86.0 kDa by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS–PAGE). Furthermore, six His-tag was added to the inulinase and a two-step method was applied in the purification of inulinase, including concentration via dialysis by polyethylene glycol 20 000 and metal Ni-NTA Agarose affinity adsorption. The purification factor of purified protein was 3.6 and the recovery rate of enzyme activity was 33.1%. We characterized the purified inulinase. The optimum temperature was 60 ℃ and pH was 4.62. When inulin and sucrose were used as substrates, themandmaxvalues were 80.53 g/L vs 4.49 g/(L·min)and 183.10 g/L vs 20.20 g/(L·min), respectively. In addition, metal ions including Mn2+, Ca2+, Cu2+, Zn2+and Fe2+exhibited different degrees of inhibition on the enzyme activity, and Cu2+, Zn2+and Fe2+exhibited the most significant inhibition. Our findings might lay a good foundation for industrial application of inulinase.
, inulinase, heterologous expression, purification, enzymatic properties
September 28, 2014; Accepted:November 26, 2014
Wenjie Yuan. Tel/Fax: +86-411-84706308; E-mail: ywj@dlut.edu.cn
Supported by:National Natural Science Foundation of China (No. 21106016), the Fundamental Research Funds for the Central Universities (No. DUT14LK33).
国家自然科学基金 (No. 21106016),中央高校基本业务费 (No. DUT14LK33) 资助。
网络出版时间:2015-01-15
http://www.cnki.net/kcms/detail/11.1998.Q.20150115.0927.003.html

