脂肪来源干细胞移植抑制脑缺血大鼠Neurocan的表达
陈爱珍,胡方进,林菲菲
(福建医科大学附属龙岩第一医院血液内科,福建龙岩364000)
脂肪来源干细胞移植抑制脑缺血大鼠Neurocan的表达
陈爱珍,胡方进,林菲菲
(福建医科大学附属龙岩第一医院血液内科,福建龙岩364000)
目的 探讨脂肪来源干细胞(ADSC)移植对脑缺血大鼠神经蛋白聚糖(Neurocan)表达的影响。方法 选取清洁级成年雄性SD大鼠54只,随机分为假手术组、模型组(大脑中动脉栓塞)和ADSC组(大脑中动脉栓塞后移植ADSC),每组18只。大脑中动脉栓塞模型采用改良Zea-Longa线栓制法,ADSC移植前用二脒基苯基吲哚标记,ADSC组于造模成功1 d后经侧脑室注入ADSC(1×106cells)。分别于术后7、14、28 d将大鼠断头取脑,采用免疫荧光、蛋白质印迹检测脑组织Neurocan蛋白表达情况。结果 术后第7、14天模型组大鼠脑组织Neurocan表达明显升高,呈片状不规则分布,至28 d下降,但仍高于假手术组,差异均有统计学意义(P<0.05)。术后7、14 d ADSC组大鼠脑组织Neurocan表达明显减少,并持续至28 d,与模型组比较,差异均有统计学意义(P<0.05)。结论 ADSC移植后可减少脑缺血组织Neurocan表达,减少瘢痕产生,为后期神经轴突的成熟及功能建立提供了有利环境,可促进神经功能的恢复。
干细胞; 疾病模型,动物; 颅内栓塞和血栓形成; 蛋白聚糖类; 神经轴突
以往认为成年动物脑受损后神经元不易再生,自我修复能力有限,因此,如何促进脑损伤突触再生是目前研究的焦点和难题。近年来,干细胞因具有多向分化潜能特性在中枢神经系统损伤治疗中取得一定进展。前期研究发现,脂肪来源干细胞(adipose-derived stemcell,ADSC)移植对脑缺血大鼠神经功能恢复具有一定促进作用[1-3],但具体机制仍不明确。目前认为,神经蛋白聚糖(Neurocan)是受损神经元再生的主要抑制因子,参与了胶质瘢痕的形成,抑制轴突生长。本研究主要通过研究ADSC移植对脑缺血组织Neurocan表达的影响,旨在为临床治疗提供新的干预靶点。
1 材料与方法
1.1 材料 选取实验动物清洁级成年SD雄性大鼠(体质量250~280 g)54只,由上海斯莱克实验动物有限责任公司提供。自来水喂养,自由进食普通颗粒型大鼠饲料,动物房温度控制在22~25℃。二脒基苯基吲哚(diamidino-phenyl-indole,DAPI)由 Sigma公司提供;兔抗大鼠CD44、CD34、CD106抗体由Santa Cruz公司提供;细胞培养瓶由Coming公司提供;Ⅰ型胶原酶、2.5 g/L胰酶、胎牛血清、杜氏改良Eagle培养基/LG复合培养基由Gibco公司提供;小鼠抗大鼠单克隆Neurocan抗体(一抗)由Chemicon公司提供;山羊封闭血清、四甲基若丹明异硫氰酸盐标记的山羊抗小鼠免疫球蛋白G-HRP(二抗)由北京中杉剑桥公司提供;小鼠抗大鼠β-actin抗体由武汉博士德公司提供;蛋白质印迹(Western blot)试剂由碧云天公司提供。
1.2 方法
1.2.1 实验方法
1.2.1.1 ADSC分离、培养、鉴定及标记 参照文献[3]进行ADSC分离、培养、鉴定及标记。
1.2.1.2 动物分组 将54只大鼠随机分为假手术组、模型组(大脑中动脉栓塞)和ADSC组(大脑中动脉栓塞后移植ADSC),每组18只。每组均按术后7、14、28 d不同时间点分为3个亚组,每个亚组6只。
1.2.1.3 脑缺血动物模型及ADSC侧脑室移植模型的建立 参考改良Zea-Longa线栓法制备大脑中动脉栓塞模型,假手术组术中只暴露大脑中动脉,不插线栓。ADSC组于造模成功后24 h通过脑立体定位仪经颅骨上钻孔将侧脑室套管在预定位置固定,用微量注射器注射DAPI标记的ADSC(1×106cells)细胞悬液,参照文献[3]的方法操作。
1.2.1.4 脑组织标本的采集 将大鼠腹腔麻醉(10%水合氯醛)后暴露心脏,经左心室进行主动脉插管作为灌注液入口,以剪开的右心耳为流出口,用生理盐水200 mL快速冲洗,取出全脑,在冰盘上迅速分离出右侧大脑半球视交叉后6~11 mm脑组织,部分保存于-80℃冰箱用于Western blot检测;部分在恒冷切片机中速冻,制作冠状切片(10 μm),固定晾干后放入-20℃冰箱保存用于免疫荧光检测。
1.2.2 检测方法
1.2.2.1 免疫荧光检测 脑组织标本采用冰冻切片,室温下复温45~60 min,5 g/L Triton放置30 min,血清封闭1 h,滴加一抗(1∶200),4℃孵育过夜。第2天室温放置1 h,滴加二抗(1∶200),避光1 h,每步骤均用0.01 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗,最后用甘油封片。重复上述方法,对照实验用PBS代替一抗。放置荧光显微镜检测。
1.2.2.2 Western blot检测 取100 mg脑组织提取总蛋白,采用SDS-聚丙烯酰胺凝胶电泳法,转膜结束后用TBS清洗,封闭1 h(5%脱脂奶粉溶液),加一抗(1∶400),4℃孵育过夜,TBS清洗后加二抗(1∶5 000),室温孵育1 h。将膜进行发光液处理,在暗室进行胶片曝光显影。采用ImageJ软件以目的条带灰度值与β-actin灰度值的比值进行分析。
1.3 统计学处理 应用SPSS13.0统计软件进行数据分析,计量资料以±s表表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 ADSC的形态及鉴定 第3代培养的细胞多呈均一长梭形,并高表达ADSC表面特异性标志物——CD44,而低表达CD106及CD34,见图1。
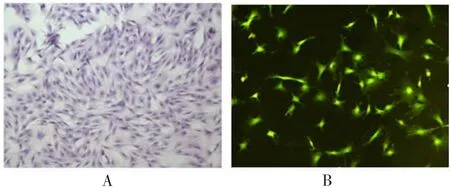
图1 ADSC的形态及鉴定
2.2 免疫荧光检测结果 假手术组大鼠脑组织Neurocan少量表达,模型组大鼠脑组织Neurocan呈片状不规则分布,见图2。
2.3 Western blot检测结果 术后7、14 d模型组大鼠脑组织Neurocan表达增多,于28 d下降,但仍高于假手术组,差异均有统计学意义(P<0.05);术后各时间点ADSC组大鼠脑组织Neurocan表达均明显下降,与模型组比较,差异均有统计学意义(P<0.05),见图3。

图2 术后14 d各组大鼠脑组织Neurocan表达情况比较(免疫荧光,200×)

图3 术后各时间点各组大鼠脑组织Neurocan表达情况比较(Western blot)
3 讨 论
有研究表明,中枢神经系统损伤后因神经营养因子缺乏、炎性细胞因子破坏、抑制因子分泌等各种不利因素环境下受损神经元自我修复能力有限,即使神经元轴突再生,大部分也难与突触后神经元建立新的功能性联系,其中胶质瘢痕是其主要障碍,当神经细胞在轴突延伸和迁移过程中遇到胶质瘢痕屏障时就会被阻止继续沿原方向运动,无法正常发育和导向,失去行使神经冲动和信号转导功能[4]。Neurocan是中枢神经系统一种重要的硫酸软骨素蛋白聚糖,主要参与早期脑组织发育过程中轴突生长、形成和成熟,到成年时几乎不表达,但在成年动物脑损伤中被发现表达上调。有研究在脑损伤区周围皮质中检测到Neurocan在胶质瘢痕表达明显增多,同时与增生的神经胶质纤维酸性蛋白阳性胶质细胞相互重叠,提示Neurocan是伴随星形胶质细胞(astrocyte,AS)增生产生的调节因子,可能是神经修复的重要抑制分子,参与了胶质屏障的形成,阻碍神经轴突延长[5]。
近年来,干细胞因具有多向分化潜能特性,被用于治疗中枢神经系统损伤的研究,目前,主要针对骨髓来源干细胞,已证实其在体外及脑缺血、脊髓损伤动物模型中均可减少抑制因子如Neurocan的表达,促进神经功能恢复[6-7]。Mahmood等[8]研究也显示,骨髓来源干细胞在创伤性脑损伤中通过抑制AS、Neurocan表达,促进神经轴突生长。ADSC由于来源丰富,具有取材方便、移植免疫排斥反应小、多向分化等显著优势[9]也开始被国内外很多研究尝试用于治疗脑缺血疾病,对ADSC在脑缺血大鼠神经修复过程中可能的分子机制进一步探索研究取得一定进展。本研究观察到术后第7、14天模型组大鼠脑组织Neurocan表达明显升高,呈片状不规则分布,至28 d下降,但仍高于假手术组。脑梗死后神经轴突生长主要经历3个关键阶段:第7天是轴突出芽的起始触发阶段;第14天是轴突的持续生长阶段;第28天是轴突再生的发育成熟阶段[10]。根据本研究结果作者推断,在亚急性期脑梗死周围区Neurocan表达时间与轴突出芽基本一致,说明胶质瘢痕对早期轴突出芽的触发、再生、延伸及重建可能产生重要影响。虽然神经元具有一定的自我修复力及可塑性,在后期可能逐渐建立侧支循环恢复部分血供或分泌了一些有利因子,在一定程度上减少了Neurocan的表达,使未受损神经元发生了一定轴突功能重建,但通过观察大鼠恢复情况,这种自我修复能力很有限。可能由于早期轴突出芽起始触发、维持阶段明显受限,至后期神经再生轴突成熟相对明显减少。因此,在此过程中提供有利因素促进早期轴突出芽对神经功能恢复相当重要。术后7、14 d ADSC组大鼠脑组织Neurocan表达明显减少,并持续至28 d,提示ADSC对Neurocan表达具有抑制作用,为早期轴突触发及再生创造了良好微环境,为后期神经轴突的成熟及功能建立提供了有利环境,可促进神经功能恢复。
总之,本研究进一步证实了在脑缺血大鼠中生长抑制因子对神经突触重塑的重要影响,同时也表明,ADSC能有效抑制不利因子的表达,改善微环境,提高神经修复能力,为临床治疗提供了理论基础。
[1]王杰华,刘楠,杜厚伟,等.脂肪来源的干细胞移植对大鼠脑缺血后微血管生成及bFGF和VEGF表达的影响[J].细胞与分子免疫学杂志,2008,24(10):958-961.
[2]杜厚伟,刘楠,王杰华,等.脂肪来源的干细胞移植对脑缺血大鼠脑组织IL-10及TNF-α表达的影响[J].细胞与分子免疫学杂志,2009,25(11):998-1001.
[3]陈爱珍,刘楠,黄欢,等.脂肪来源的干细胞移植对脑缺血大鼠神经轴突再生的影响[J].细胞与分子免疫学杂志,2011,27(8):868-871.
[4]Silver DJ,Silver J.Contributions of chondroitin sulfate proteoglycans to neurodevelopment,injury,and cancer[J].Curr Opin Neurobiol,2014,27:171-178.
[5]Asher RA,Morgenstern DA,Fidler PS,et al.Neurocan is upregulated in injured brain and in cytokine-treated astrocytes[J].J Neurosci,2000,20(7):2427-2438.
[6]Mahmood A,Wu H,Qu C,et al.Effects of treating traumatic brain injury with collagen scaffolds and human bone marrow stromal cells on sprouting of corticospinal tract axons into the denervated side of the spinal cord[J].J Neurosurg,2013,118(2):381-389.
[7]Shen LH,Li Y,Gao Q,et al.Down-regulation of neurocan expression in reactive astrocytes promotes axonal regeneration and facilitates the neurorestorative effects of bone marrow stromal cells in the ischemic rat brain[J]. Glia,2008,56(16):1747-1754.
[8]Mahmood A,Wu H,Qu C,et al.Suppression of neurocan and enhancement of axonal density in rats after treatment of traumatic brain injury with scaffolds impregnated with bone marrow stromal cells[J].J Neurosurg,2014,120(5):1147-1155.
[9]Desai VD,Hsia HC,Schwarzbauer JE.Reversible modulation of myofibroblast differentiation in adipose-derived mesenchymal stem cells[J]. PLoS One,2014,9(1):e86865.
[10]Hendel RC,Henry TD,Rocha-Singh K,et al.Effect of intracoronary recombinant human vascular endothelial growth factor on myocardial perfusion:evidence for a dose-dependent effect[J].Circulation,2000,101(2):118-121.
Adipose-derived stem cell transplantation for inhibiting Neurocan expression in rat with cerebral ischemia
Chen Aizhen,Hu Fangjin,Lin Feifei
(Department of Hematology,Affiliated Longyan First Hospital,Fujian Medical University,Longyan,Fujian 364000,China)
ObjectiveTo investigate the effects of adipose-derived stem cell(ADSC)on the Neurocan expression in rat with cerebral ischemia.Methods54 clean class adult male Sprague-Dawley rats were selected and randomly divided into the sham operation group,model group(middle cerebral arterial embolism)and ADSC group(ADSC transplantation after middle cerebral arterial embolism),18 cases in each group.The middle cerebral arterial embolism model adopted the modified Zea-Longa line embolism method.Before ADSC transplantation,diamidino-2-phenylindole(DAPI)labeling was performed.The ADSC group was injected with ADSC(1×106cells)by lateral ventricle on 1 d after successful model establishment.Rats were sacrificed for taking the brain on postoperative 7,14,28 d and the Neurocan protein expression was detected by using the immunofluorescence and Western blot.ResultsThe Neurocan expression of the brain tissues on postoperative 7,14 d in the model group was significantly increased and showed the sheet irregular distribution,which was decreased on 28 d,but still higher than that in the sham operation group,the differences were statistically significant(P<0.05).The Neurocan expression of the brain tissues on postoperative 7,14 d in the ADSC group was significantly decreased,moreover which continued to 28 d and showed the statistical difference compared withthe modelgroup(P<0.05).ConclusionThe ADSCtransplantation can decrease the Neurocan expression in the brain ischemic tissues and reduce the scar generation,which provides the enabling environment for late nerve axons maturity and function establishment,and can promote the restoration of neural function.
Stemcells; Diseasemodels,animal; Intracranialembolismandthrombosis; Proteoglycans; Neuronalaxon
10.3969/j.issn.1009-5519.2015.24.010
A
1009-5519(2015)24-3714-03
2015-09-24)
陈爱珍(1983-),女,福建漳平人,主要从事血液内科临床工作;E-mail:chenaizhen2003@163.com。

