人参皂苷Rb1对Aβ25-35诱导痴呆大鼠海马神经元凋亡的影响
曹梦园,赵月鸣,张晶,赵刚
(1.吉林省医学期刊社,吉林长春130061;2.吉林省肿瘤医院内三科,吉林长春130021;3.福建省厦门市第二医院检验科,福建厦门361024;4.吉林大学公共卫生学院放射生物教研室,吉林长春130021)
·论著·
人参皂苷Rb1对Aβ25-35诱导痴呆大鼠海马神经元凋亡的影响
曹梦园1,赵月鸣2,张晶3,赵刚4
(1.吉林省医学期刊社,吉林长春130061;2.吉林省肿瘤医院内三科,吉林长春130021;3.福建省厦门市第二医院检验科,福建厦门361024;4.吉林大学公共卫生学院放射生物教研室,吉林长春130021)
目的应用Aβ25-35诱导并建立痴呆大鼠模型,观察人参皂苷Rb1对海马神经元凋亡的保护作用。方法选取Sprague Dawley大鼠42只,采用随机数字表法分为模型组、治疗组及正常组,每组14只。模型组和治疗组建立Aβ25-35诱导痴呆大鼠模型,治疗组大鼠实验前、造模后7 d给予20 mg/(kg·d)人参皂苷Rb1,模型组和正常组给予等体积的生理盐水灌胃。建立模型喂养7 d后,Morris水迷宫实验检测大鼠学习记忆力进行后处死大鼠,末端标记法(TUNEL)检测大鼠海马神经元的凋亡,免疫组织化学法检测大鼠海马神经元细胞周期蛋白D1、Fas、FasL水平及凋亡相关基因Survivin、Bcl-2、Bax及p53蛋白表达水平。结果模型组大鼠学习记忆力较正常组大鼠明显降低,而Rb1治疗组大鼠的学习记忆力较模型组明显改善(P<0.05);治疗组大鼠细胞周期蛋白D1阳性率为(38.60±5.02)%,高于模型组[(19.81±5.74)%]均低于正常组,差异有统计学意义(P<0.05);治疗组大鼠凋亡细胞阳性率为(47.33±7.92)%,低于模型组[(72.68±9.80)%],均高于正常组,差异有统计学意义(P<0.05);治疗组Fas、FasL和Bax蛋白阳性率分别为(56.42±8.17)%、(44.27±6.35)%和(52.09±7.10)%,低于模型组,均高于正常组,差异有统计学意义(P<0.05);治疗组Bcl-2、Survivin和p53蛋白阳性率分别为(61.53±5.92)%、(53.19±8.24)%和(59.16±8.79)%,高于模型组,均低于正常组,差异有统计学意义(P<0.05)。结论人参皂苷Rb1对Aβ25-35诱导的痴呆大鼠记忆力及认知功能具有保护作用,降低海马神经元的损伤和凋亡,并通过下调Fas、FasL和Bax蛋白的表达水平,增加Bcl-2、Survivin和p53蛋白的阳性表达而发挥作用。
人参皂苷Rb1;Aβ25-35;痴呆大鼠;海马神经元;凋亡
人参皂苷Rb1是人参中的主要活性成分。有研究认为人参皂苷Rb1能够清除氧自由基、抗细胞凋亡,对缺氧、缺血状况下的神经元具有保护、修复作用,但人参皂苷Rb1是否也参与对海马神经元的保护,是否能改善记忆、增强中枢神经系统功能,报道尚不多见[1-2]。本研究旨在应用Aβ25-35诱导并建立痴呆大鼠模型,观察人参皂苷Rb1对海马神经元凋亡的保护作用。
1 材料与方法
1.1动物和分组
选取6周龄清洁级(Sprague Dawley,SD)大鼠(吉林大学动物实验中心)42只,雌雄各半,平均体重(198.72±13.41)g。采用随机数字表法分为3组:正常组、模型组及治疗组,每组14只。
1.2建模及方法
模型组和Rb1治疗组建立Aβ25-35诱导痴呆大鼠模型,将Aβ25-35溶解于无菌生理盐水中,配制成2 g/L,置于37℃水浴箱中3 d,10%氯胺酮腹腔注射麻醉,在脑立体定位仪下注射3μl Aβ25-35于大鼠侧脑室[3]。连续3 d腹腔注射青霉素10万u/d,其中治疗组大鼠实验前、造模后1周给予人参皂苷Rb1 20 mg/(kg·d)[(溶剂为生理盐水,相当于成人剂量为1 mg/(kg·d),1次/d,模型组和正常组均给予等体积的生理盐水灌胃,建立模型后连续喂养7 d。
1.3主要仪器及试剂
Olympus显微镜购于南京伊若达仪器设备有限公司,Aβ25-35购于上海士锋生物科技有限公司,人参皂苷Rb1(质量分数≥96.0%)购自南京替斯艾么中药研究所),脑立体定位仪购于北京拜安吉科技有限公司,Fas、FasL、Survivin、Bcl-2、Bax及p53蛋白免疫组织化学法试剂盒购自美国Sigma公司,Morris水迷宫购自北京智鼠多宝公司。
1.4观察指标及检测方法
1.4.1 Morris水迷宫实验建立模型喂养7 d后,首先完成水迷宫实验,实验内容包括定位航行实验和空间探索实验评估大鼠的学习记忆力,验证痴呆大鼠成模与否及严重程度。圆形水池直径160 cm,高50 cm,池中水深30 cm,池底黑色,水温保持在(23±2)℃;池壁标记4个等距离点N、E、S、W作为实验的起始点,分水池为4个象限,任选—象限在中央放置与池壁圆心距离相等黑色平台,直径12 cm,高29 cm,没于水下1 cm。应用自动摄像及Xmaze分析系统实时跟踪记录动物运动轨迹。实验训练阶段将大鼠置于迷宫内训练4次/d,并适应环境,连续3 d后进行学习和记忆功能检测[4]。定位航行实验记录大鼠的逃避潜伏期,空间探索实验记录大鼠第3象限停留时间。水迷宫实验结束后处死大鼠,迅速取出大脑海马部位,置于4%甲醛浸泡约24 h,常规脱水、透明、浸蜡、包埋成蜡块,连续切片,进行凋亡及相关蛋白表达检测。
1.4.2 大鼠海马神经元凋亡及相关蛋白表达检测采用末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)检测大鼠海马神经元的凋亡,应用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连接法(streptavidin-perosidase,SP)检测大鼠海马神经元细胞周期蛋白D1(CyclinD1)、Fas、FasL水平及凋亡相关基因Survivin、Bcl-2、Bax及p53蛋白表达水平[5]。其中Cyclin D1、Fas、FasL 3种指标用来评价大鼠神经元凋亡程度,抑制凋亡基因Survivin、Bcl-2、p53及促进凋亡基因Bax的表达水平,用来评价并判断大鼠海马神经元凋亡水平及Rb1抗凋亡的可能机制,严格按照试剂盒说明书进行操作,在高倍镜下(×400),每张切片随机选择5个清晰的视野,每个视野选择100个细胞并计数阳性细胞,阳性率=阳性细胞数/细胞总数(500)×100%。2位资深的病理医生同时进行免疫组织化学结果判定,意见统一后确诊。
1.5统计学方法
采用SPSS 11.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,3组间比较用方差分析,组间两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠学习和记忆力比较
模型组大鼠学习和记忆力较正常组大鼠明显下降,给予Rb1治疗后,大鼠的学习和记忆力提高,但仍较正常组大鼠降低(P<0.05)。见表1。
2.2各组大鼠脑组织凋亡率比较
治疗组大鼠TUNEL阳性率低于模型组,但两组均高于正常组,差异有统计学意义(P<0.05)。见表1。
2.3各组Cyclin D1蛋白阳性率比较
治疗组大鼠Cyclin D1阳性率高于模型组,但均低于正常组,模型组Cyclin D1阳性率低于正常组,差异有统计学意义(P<0.05)。见表1。
2.4各组大鼠Fas、FasL、Survivin、Bcl-2、Bax和p53蛋白比较
治疗组Fas、FasL和Bax蛋白阳性率低于模型组,但均高于正常组,差异有统计学意义(P<0.05);治疗组Bcl-2、Survivin和p53蛋白阳性率高于模型组,但均低于正常组,差异有统计学意义(P<0.05)。见表2。
表1 各组大鼠学习和记忆力、Cyclin D1和TUNEL阳性率结果比较(n=14±s)
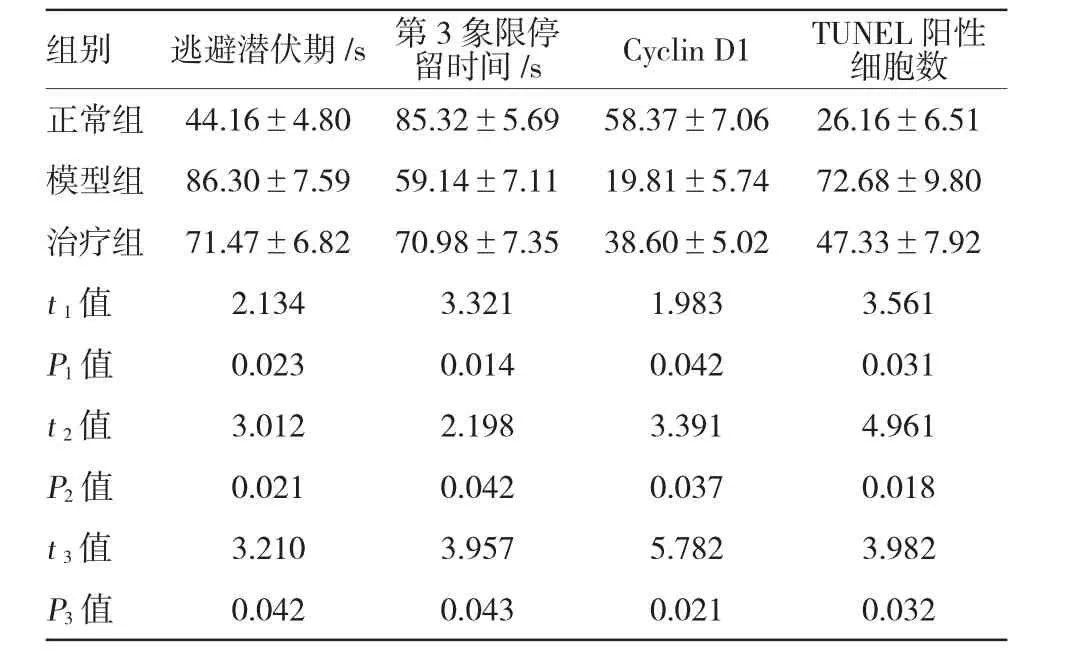
表1 各组大鼠学习和记忆力、Cyclin D1和TUNEL阳性率结果比较(n=14±s)
注:t1、P1:模型组与正常组比较;t2、P2:治疗组与正常组比较;t3、P3:治疗组与模型组比较
组别逃避潜伏期/s第3象限停留时间/sCyclin D1TUNEL阳性细胞数正常组44.16±4.8085.32±5.6958.37±7.0626.16±6.51模型组86.30±7.5959.14±7.1119.81±5.7472.68±9.80治疗组71.47±6.8270.98±7.3538.60±5.0247.33±7.92t1值2.1343.3211.9833.561P1值0.0230.0140.0420.031t2值3.0122.1983.3914.961P2值0.0210.0420.0370.018t3值3.2103.9575.7823.982P3值0.0420.0430.0210.032
表2 各组大鼠Fas、FasL、Survivin、Bcl-2、Bax和p53蛋白阳性率比较(n=14,%±s)
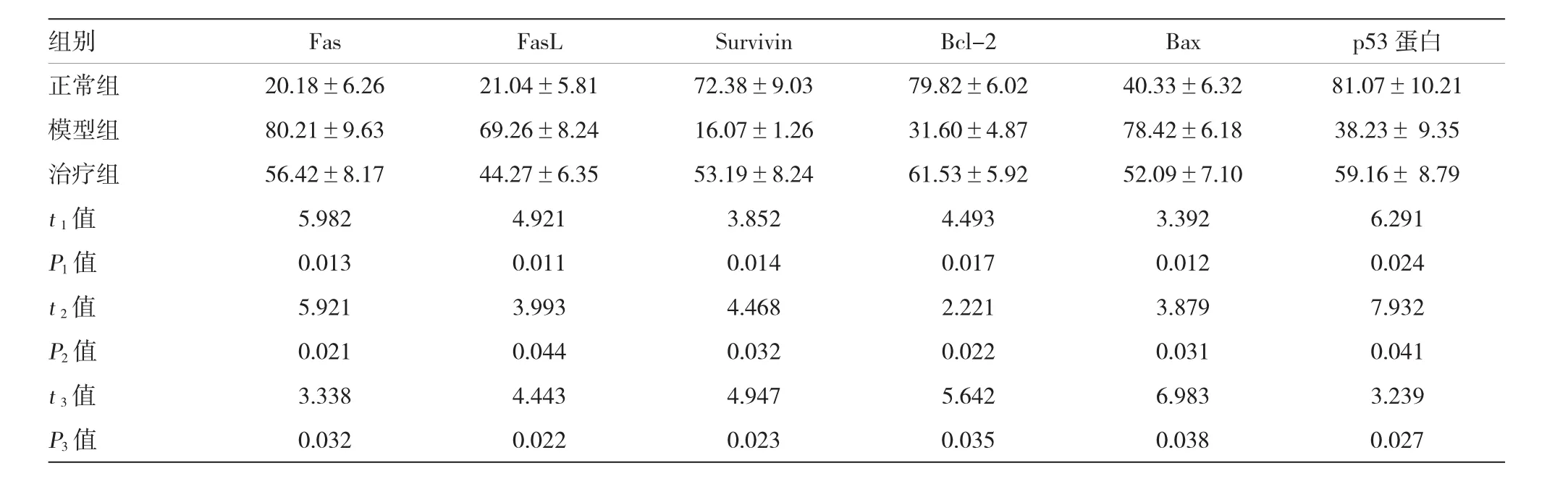
表2 各组大鼠Fas、FasL、Survivin、Bcl-2、Bax和p53蛋白阳性率比较(n=14,%±s)
注:t1、P1:模型组与正常组比较;t2、P2:治疗组与正常组比较;t3、P3:治疗组与模型组比较
组别FasFasLSurvivinBcl-2Baxp53蛋白正常组20.18±6.2621.04±5.8172.38±9.0379.82±6.0240.33±6.3281.07±10.21模型组80.21±9.6369.26±8.2416.07±1.2631.60±4.8778.42±6.1838.23±9.35治疗组56.42±8.1744.27±6.3553.19±8.2461.53±5.9252.09±7.1059.16±8.79t1值5.9824.9213.8524.4933.3926.291P1值0.0130.0110.0140.0170.0120.024t2值5.9213.9934.4682.2213.8797.932P2值0.0210.0440.0320.0220.0310.041t3值3.3384.4434.9475.6426.9833.239P3值0.0320.0220.0230.0350.0380.027
3 讨论
认知功能障碍大多由中枢神经系统退行性病变引起,甚至发展为阿尔茨海默病[6]。Aβ为β淀粉样蛋白前体蛋白的水解产物,Aβ淀粉样蛋白的沉积在中枢神经系统退行性病变的发生和发展中起关键作用[7]。海马作为中枢神经系统的重要组成部分在记忆和学习的多个环节中发挥重要作用,也是神经系统退行性疾病最早受累的部位[8]。Aβ25-35能够加速神经元的凋亡程序,改变海马超微结构,减少海马神经元数量,以建立痴呆大鼠模型,影响大鼠的学习、记忆及其他神经系统活动[9-10]。
本研究结果提示,Aβ25-35诱导的痴呆大鼠记忆力及认知功能明显减退。其原因为Aβ25-35引起神经元损害、认知损害和记忆功能下降,人参皂苷Rb1对Aβ25-35诱导的痴呆大鼠记忆力及认知功能有保护作用。人参皂苷Rb1是人参主要的有效成分之一,具有抗氧化损伤、保护神经细胞及改善记忆的功能[11]。本研究结果显示,治疗组大鼠TUNEL阳性率低于模型组,治疗组大鼠Cyclin D1阳性率高于模型组,提示人参皂苷Rb1能减轻大鼠海马神经元的损伤,促进Cyclin D1的合成,可有效保护神经元免受Aβ25-35诱导的损伤。
Fas是一种Ⅰ型跨膜蛋白,属于肿瘤坏死因子(tumor necrosis factor,TNF)和神经生长因子受体蛋白超家族。FasL是一种Ⅱ型膜蛋白,亦属于TNF家族,是Fas在体内的天然配体。Survivin是凋亡抑制蛋白家族的新成员,Fas、FasL的升高可促进细胞凋亡。Bcl-2是细胞凋亡研究中最受重视的癌基因之一,可以抑制由多种细胞毒引起的细胞死亡。Bax基因是Bcl-2基因家族的一员,其产物是一种与Bcl-2同源的相关蛋白,能加速细胞凋亡,拮抗Bcl-2的生物学活性。P53基因编码一种分子量为53 kD的蛋白质,p53基因的失活促使细胞凋亡,降低对细胞的修复功能[12-13]。本研究结果显示,治疗组Fas、FasL和Bax蛋白阳性率低于模型组,治疗组Bcl-2、Survivin和p53蛋白阳性率高于模型组,提示人参皂苷Rb1能够通过下调Aβ25-35诱导的痴呆大鼠的Fas、FasL和Bcl-2蛋白的表达水平,提高Bax、Survivin和p53蛋白阳性表达而发挥作用。因此,人参皂苷Rb1能够避免神经细胞凋亡,维持其正常形态和功能,促进神经损伤的修复[14]。
综上所述,人参皂苷Rb1对Aβ25-35诱导的痴呆大鼠记忆力及认知功能具有保护作用,降低海马神经元的损伤和凋亡,并通过下调Fas、FasL和Bax蛋白表达水平,提高Bcl-2、Survivin和p53蛋白的阳性表达而发挥作用。
[1]张昌静,庄成乐,陈伟哲,等.人参皂苷Rb1对术后疲劳综合征老年大鼠海马神经营养因子的影响[J].中草药,2014,45(6)∶813-818.
[2]TAKASAKI K,UCHIDA K,FUJIKAWA R,et al.Neuroprotective effects of citidine-5-diphosphocholine on impaired spatial memory in a rat model of cerebrovascular dementia[J].J Pharmacol Sci,2011,116(2)∶232-237.
[3]李志红,张博爱.艾司西酞普兰对Aβ25-35诱导的大鼠海马神经元损伤的保护作用[J].沈阳药科大学学报,2015,32(4)∶209-213.
[4]王洪财,蒋玉萌,赵雪,等.人参皂苷Rb1对Aβ淀粉样蛋白诱导大鼠海马神经元损伤的保护作用[J].中国临床康复,2012,38(3)∶447-451.
[5]王玉珠,顾圣莹,张吉刚,等.根皮素对rBMECs摄取人参皂苷Rb1的影响[J].中国药学杂志,2015,50(3)∶226-232.
[6]李林,张兰.中药治疗阿尔茨海默病的作用特点[J].生物化学与生物物理进展,2012,39(8)∶816-828.
[7]董贤慧,柴锡庆.阿尔茨海默病转基因动物模型∶如何更接近病理特征[J].中国组织工程研究,2013,17(46)∶8075-8082.
[8]倪嘉缵,陈平,刘琼,等.阿尔茨海默病的防治策略研究进展[J].深圳大学学报(理工版),2013,30(4)∶331-348.
[9]AMTUL Z,NIKOLOVA S,GAO L,et al.Comorbid Aβ toxicity and stroke∶hippocampal atrophy,pathology,and cognitive deficit[J].Neurobiol Aging,2014,35(7)∶1605-1614.
[10]许志强,周华东,蒋晓江.淀粉样β蛋白沉淀及其神经毒性与阿尔茨海默病[J].中国临床康复,2006,10(4)∶138-155.
[11]贾立云,潘晓华,刘晶,等.人参皂苷Rb1、Re对Aβ25-35诱导SK-N-SH细胞损伤的保护作用[J].山东大学学报(医学版),2011,49(4)∶33-37.
[12]ZHAO YN,LI JM,TANG QQ,et al.Regulation of extracellular signal-regulatedkinase1/2influenceshippocampalneuronal survival in a rat model of diabetic cerebral ischemia[J].Neural Regen Res,2014,9(7)∶749-756.
[13]刘敏,王立娜,李勇枝,等.人参改善认知功能研究综述[J].辽宁中医药大学学报,2014,16(12)∶111-114.
[14]徐扬,闰中瑞.三七总皂甙对老年大鼠学习能力、记忆力及海马神经元凋亡的影响研究[J].实用心脑肺血管病杂志,2014,2(8)∶30-31.
(申海菊 编辑)
Effect of ginsenoside Rb1 on apoptosis of hippocampal neurons in dementia rats induced by Aβ25-35
Meng-yuan CAO1,Yue-ming ZHAO2,Jing ZHANG3,Gang ZHAO4
(1.Jilin Medical Journal Community,Changchun,Jilin 130061,P.R.China;2.The Third Department of Internal Medicine,Tumor Hospital of Jilin Province,Changchun,Jilin 130021,P.R.China;3.Clinical Laboratory,the Second Hospital of Xiamen City,Xiamen,Fujian 361024,P.R.China;4.Department of Radiobiology,Public Health College of Jilin University,Changchun,Jilin 130021,P.R.China)
【Objective】To induce and establish the dementia rat model by Aβ25-35,and to observe the protective effect of ginsenoside Rb1 on the apoptosis of hippocampal neurons.【Methods】Forty-two SD rats were randomly divided into three groups by the random number table method,with 14 rats in each group.The rats in the model and Rb1 treatment groups were treated with Aβ25-35 for induction of dementia model.The rats in the Rb1 treatment group were given Rb1 20 mg/(kg·d)before and one week after model estab-lishment and those in the normal and model groups were given equal volume of normal saline by gavage.They were raised for 7 days.Morris water maze was used to detect learning and memory ability of the rats.Then the rats were sacrificed.TUNEL method was used to detect hippocampal neuron apoptosis.Immunohistochemistry was used to detect the cyclin D1,Fas and FasL levels,and apoptosis-related survivin,Bcl-2,Bax and p53 protein expression levels of hippocampal neurons.【Results】Learning and memory ability of the rats in the model group decreased compared with that in the normal group.Learning and memory ability of the Rb1 treatment group was significantly improved compared that of the model group(P<0.05).Cyclin D1 positive rate of the Rb1 treatment group was(38.60±5.02)%,which was significantly higher than that of the model group[(19.81±5.74)%];and cyclin D1 positive rate of both groups was significantly lower than that of the normal group(P<0.05).TUNEL positive rate of the Rb1 treatment group was(47.33±7.92)%,which was significantly lower than that of the model group[(72.68±9.80)%];both were significantly higher than that of the normal group(P<0.05).Fas,FasL and Bax protein positive rates of the Rb1 treatment group were(56.42±8.17)%,(44.27±6.35)%and(52.09±7.10)%respectively,which were significantly lower than those of the model group,but significantly higher than those of the normal group(P<0.05).Bcl-2,survivin and p53 protein positive rates of the Rb1 treatment group were(61.53±5.92)%,(53.19±8.24)%and(59.16±8.79)%respectively,they were significantly higher than those of the model group,but significantly lower than those of the normal group(P<0.05).【Conclusions】Ginsenoside Rb1 has protective memory and cognitive effects on Aβ25-35-induced dementia of rat.This function might be related to alleviation of the injury and apoptosis of hippocampal neurons;down-regulation of Fas,FasL and Bax protein expressions and up-regulation of Bcl-2,survivin and p53 protein expressions.
ginsenoside Rb1;Aβ25-35;dementia rat;hippocampal neuron;apoptosis
R285.5
A
1005-8982(2015)35-0033-04
2015-08-26
赵刚,E-mail:551641812@qq.com

