大剂量大黄素致大鼠肝损伤及其机制的初步研究*
张斌,丁慎华,钱雪梅,朱薇珊
(复旦大学附属中山医院青浦分院肝病科,上海201700)
大剂量大黄素致大鼠肝损伤及其机制的初步研究*
张斌,丁慎华,钱雪梅,朱薇珊
(复旦大学附属中山医院青浦分院肝病科,上海201700)
目的初步研究大黄素致药物性肝损伤(DILI)大鼠模型氧化应激相关指标及肝脏病理的动态变化规律。方法Wistar雄性大鼠按每天大黄素摄入量不同,分为高剂量组、较高剂量组、中剂量组、低剂量组、溶剂对照组及正常组,于4、8和12周分别观察肝脾指数、肝组织苏木精-伊红染色法(HE)染色、肝组织丙二醛(MDA)及单胺氧化酶(MAO)的水平。结果各组生长状态无明显区别,无死亡和腹水形成。高剂量组和较高剂量组的肝脾指数、肝组织MAO及MDA含量有升高趋势,第8周后肝组织炎症活动明显,其中高剂量组变化更明显。结论大剂量大黄素可以造成大鼠肝损伤,其损伤可能与机体氧化应激有关,值得进一步深入研究。
药物性肝损伤;大黄素;病理;氧化应激
药物性肝损伤(drug-induced liver injury,DILI)是指患者在其他疾病治疗过程中由于药物或其产生的代谢产物所致的肝细胞毒性损害,或者肝脏对药物及其产生的代谢产物的过敏反应所导致的肝脏疾病,也称作药物性肝炎。据世界卫生组织统计,DILI已上升至全球死亡原因的第5位,尤其中药引起的肝损伤在临床上越来越常见,应引起人们的高度重视[1-3]。近年来,何首乌由于具有降血脂、抗衰老、调节免疫等药理作用受到许多人的青睐,但因此造成的药物性肝损伤也时有报道[4]。现代药理研究表明,大黄素是何首乌中主要的蒽醌化合物,具有抗菌消炎、抗肿瘤、免疫抑制等药理作用,是造成DILI的原因之一[5-6]。从大黄素入手探视其药物性肝损伤的机制显得非常必要,为此本研究选择大鼠作为研究对象,采用不同剂量大黄素进行灌胃,对其肝病理及氧化应激相关指标进行初步研究,现报道如下。
1 材料与方法
1.1实验试剂
大黄素购自南京中药研究所,与羧甲基纤维素钠配制成混悬液,按高、较高、中、低剂量组分别配制成1.6、0.8、0.4和0.2 mg/ml浓度的液体,4℃下保存备用。单胺氧化酶(monoamine oxidase,MAO)和丙二醛(malondialdehyde,MDA)测定试剂盒购自南京建成生物工程研究所。
1.2实验动物
Wistar雄性大鼠120只,清洁级,体重(100±10)g,购自上海西普尔-必凯实验动物有限公司,所有大鼠分笼饲养于上海中医药大学附属普陀医院实验动物房。
1.3方法
1.3.1 大鼠肝癌模型制备及标本留取将大鼠按随机数字表法分成6组,根据人临床用量,结合人和动物间药物剂量换算法,将剂量设置为高剂量组[16 mg/(kg·d)]、较高剂量组[8 mg/(kg·d)]、中剂量组[4 mg/(kg·d)]、低剂量组[2 mg/(kg·d)]、溶剂对照组(灌胃等体积的溶剂)及正常组(灌胃等体积蒸馏水),每组20只。第4和8周各组分别解剖5只大鼠,第12周解剖剩余大鼠(统计时各组随机选5只进行统计比较)。大体观察肝脏,记录肝脏的形态、颜色、质地,记录大鼠一般情况。测量体重、肝重和脾重,血清保存于-80℃冰箱冷冻备用。按照下列公式计算肝脾指数:肝指数=肝质量(g)/体质量(kg)×100%。脾指数=脾质量(g)/体质量(kg)×100%。
1.3.2肝脏苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色常规制备肝组织切片,取各组大鼠肝组织进行冷冻切片(8μm),以备染色。分别以HE滴染切片,梯度浓度乙醇脱水,二甲苯透明后以中性树胶封片。染色后的切片置于莱卡显微镜,分别以普通光和荧光进行摄影和记录。
1.3.3 肝组织MAO和MDA的测定肝组织匀浆制备,称取100 mg大鼠肝脏加入600 L匀浆缓冲液(0.25 mol/L蔗糖溶液、0.1%Tween-20,5 mmol/L 3-巯基乙醇,1 mmol/L苯甲基磺酰氟),在冰浴中匀浆。肝匀浆9 000×g离心10 min,取上清液进行蛋白定量。采用分光光度法测定MAO、MDA的活性。
1.4统计学方法
采用SPSS 10.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1大鼠一般情况及肝脾指数
各组大鼠生长状态无明显区别,其中较高剂量组和高剂量组活动少,精神略萎靡,各组无死亡和腹水形成。第4周各组肝指数比较差异无统计学意义;第8和12周时,较高剂量组和高剂量组肝指数有升高趋势(P8周=0.157和0.001,P12周=0.002和0.000),尤其是高剂量组明显升高,第12周时达最高(见表1)。第8和12周时,较高剂量组和高剂量组的脾指数有升高趋势(P8周=0.003和0.004,P12周=0.001和0.000),尤其是高剂量组脾指数明显升高,而溶剂组和正常组比较,差异无统计学意义(见表2)。
2.2病理组织学检查
肝组织HE染色发现,第4周各组比较无明显区别。第8和12周时,较高剂量组和高剂量组肝组织的肝细胞变性明显,偶见点状坏死,有再生肝细胞,汇管区有少数炎症细胞浸润,尤其是高剂量组更明显。其中12周较8周更加显著。见附图。
表1 各组肝指数比较(n=5,g/kg±s)
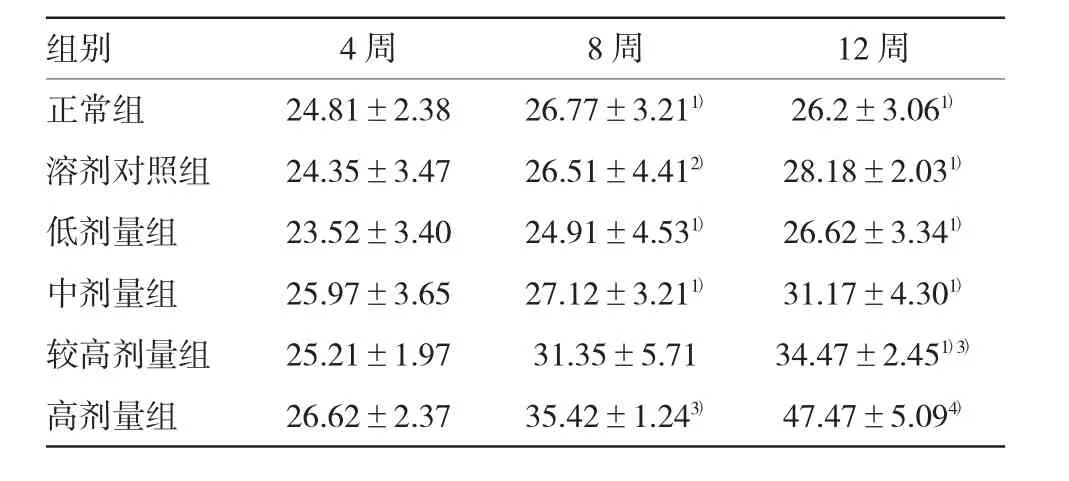
表1 各组肝指数比较(n=5,g/kg±s)
注:1)与高剂量组比较,P<0.01;2)与高剂量组比较,P<0.05;3)与正常组比较,P<0.05;4)与正常组比较,P<0.01
?
表2 各组脾指数比较(n=5,g/kgs)
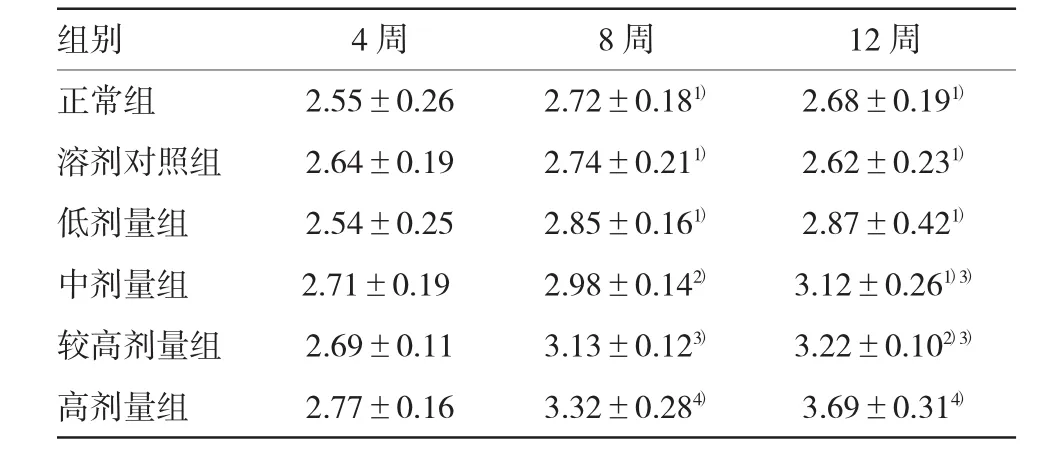
表2 各组脾指数比较(n=5,g/kgs)
注:1)与高剂量组比较,P<0.01;2)与高剂量组比较,P<0.05;3)与正常组比较,P<0.05;4)与正常组比较P<0.01
组别4周8周12周正常组2.55±0.262.72±0.181)2.68±0.191)溶剂对照组2.64±0.192.74±0.211)2.62±0.231)低剂量组2.54±0.252.85±0.161)2.87±0.421)中剂量组2.71±0.192.98±0.142)3.12±0.261)3)较高剂量组2.69±0.113.13±0.123)3.22±0.102)3)高剂量组2.77±0.163.32±0.284)3.69±0.314)
2.3肝组织氧化应激相关指标的比较
研究发现,较高剂量组和高剂量组肝组织MAO、MDA随服药时间延长有逐步升高的趋势(P8周MAO=0.001和0.000,P12周MAO=0.000和0.000;P8周MDA=0.003和0.003,P12周MDA=0.000和0.000),尤其是高剂量组更明显,第12周时达高峰。见表3、4。
表3 各组大鼠肝组织MAO比较(n=5,u/mg±s)
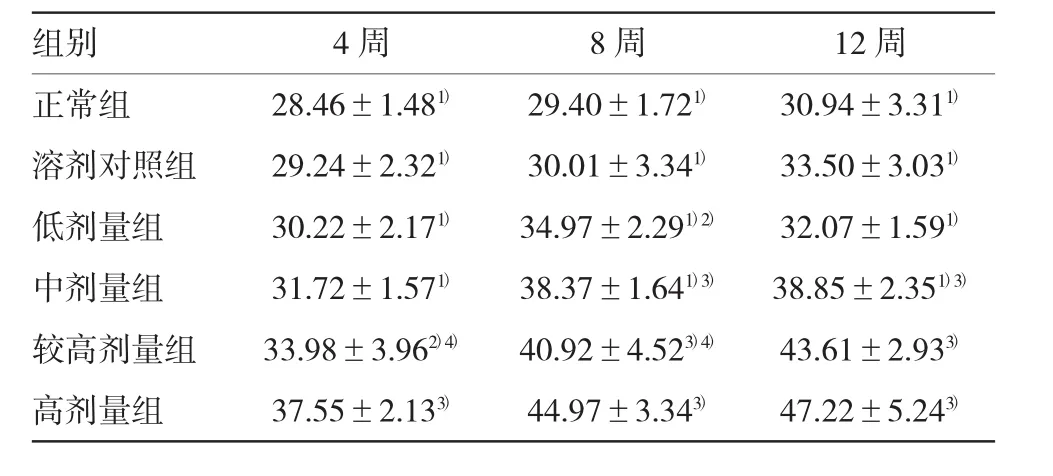
表3 各组大鼠肝组织MAO比较(n=5,u/mg±s)
注:1)与高剂量组比较,P<0.01;2)与正常组比较,P<0.05;3)与正常组比较,P<0.01;4)与高剂量组比较,P<0.05
组别4周8周12周正常组28.46±1.481)29.40±1.721)30.94±3.311)溶剂对照组29.24±2.321)30.01±3.341)33.50±3.031)低剂量组30.22±2.171)34.97±2.291)2)32.07±1.591)中剂量组31.72±1.571)38.37±1.641)3)38.85±2.351)3)较高剂量组33.98±3.962)4)40.92±4.523)4)43.61±2.933)高剂量组37.55±2.133)44.97±3.343)47.22±5.243)
表4 各组大鼠肝组织MDA比较(n=5,nmol/mg±s)
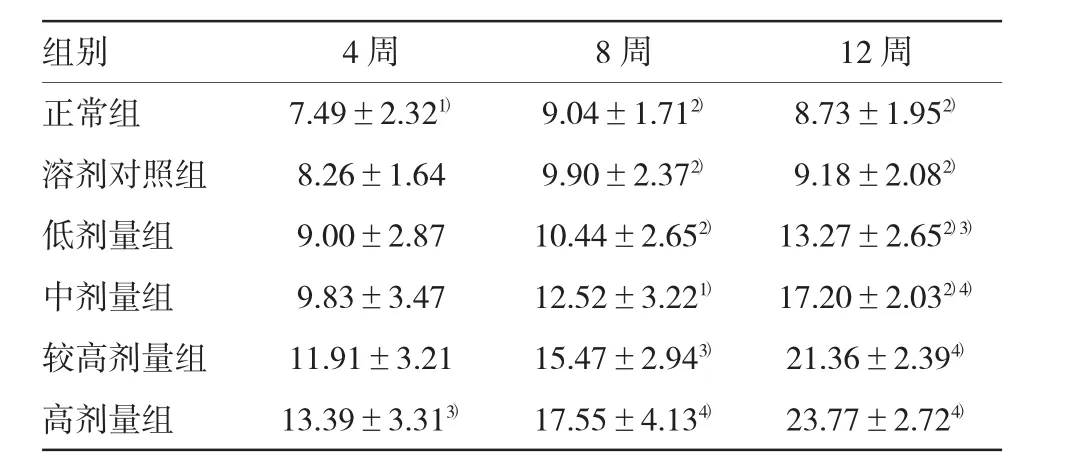
表4 各组大鼠肝组织MDA比较(n=5,nmol/mg±s)
注:1)与高剂量组比较,P<0.05;2)与高剂量组比较,P<0.01;3)与正常组比较,P<0.05;4)与正常组比较,P<0.01
组别4周8周12周正常组7.49±2.321)9.04±1.712)8.73±1.952)溶剂对照组8.26±1.649.90±2.372)9.18±2.082)低剂量组9.00±2.8710.44±2.652)13.27±2.652)3)中剂量组9.83±3.4712.52±3.221)17.20±2.032)4)较高剂量组11.91±3.2115.47±2.943)21.36±2.394)高剂量组13.39±3.313)17.55±4.134)23.77±2.724)
3 讨论
随着中医药和中西医结合研究的发展,中药制剂在我国的临床应用越来越广泛。何首乌具有解毒、消痈、润肠的功效,而制何首乌主要用于补肝肾、益精血、乌须发、强筋骨。自古以来何首乌是常用补药,更是治疗须发早白的良药,人们认为其是延年益寿之品,常年服用,但因此导致的药物性肝损伤常被忽视。人们通常认为西药会导致较大的副作用,而中药十分安全,不存在副作用。实际上,与西药比较,中草药较温和,用药时往往不太注意剂量和用法。但是,是药三分毒,中药和西药一样,也有毒副作用。何首乌的主要化学成分包括二苯乙烯类、蒽醌类和磷脂类等化学物质,可起调节血脂、抗癌、抗动脉粥样硬化和增加机体免疫力的作用。其中何首乌所含蒽醌类物质大黄素是引起肝损伤的主要成分之一[4-9]。本实验选择大鼠作为研究对象,采用大黄素进行灌胃,对其肝功能动态变化进行初步研究。各组肝脾指数的动态变化结果显示,较高剂量组和高剂量组的肝脾指数有升高趋势,尤其是高剂量组脾指数升高更明显。肝组织HE染色发现,第8和12周时,较高剂量组和高剂量组肝组织出现肝细胞变性明显,偶见点状坏死,有再生肝细胞,汇管区有少数炎症细胞浸润,尤其高剂量组明显。上述研究表明,大黄素随着服用剂量的增加和服用时间的延长可以造成肝损伤,应该引起重视。
目前,普遍认为中药引起肝损伤涉及很多损伤机制,主要为细胞色素P450、细胞凋亡、氧化应激及免疫功能异常等,目前机制尚不明确。因而加强其发病机制的研究显得非常重要。氧化应激是指因生成亢进或抗氧化机制受损而在机体内发生的自由基和活性氧同蛋白、脂质及核酸等体内高分子反应,致使后者的结构、功能出现损害的状态,造成机体内活性氧(reactive oxygenspecies,ROS)生成与清除平衡的严重破坏,活性氧蓄积,造成组织、细胞损伤的一种状态。近年来大量的临床与实验研究表明,诸多致肝损伤因素在其致病过程中不同程度伴随氧化水平的升高或抗氧化能力的下降,氧化应激贯穿各种肝病的全过程,是引起肝脏疾病的主要机制之一[10-11]。肝脏是机体氧化供能的主要场所,肝细胞线粒体含量丰富,极易产生大量ROS,直接或间接作用于肝细胞,使其受到氧化应激的损伤。MAO和MDA是细胞膜脂质过氧化反应链的终产物,该指标在肝细胞处于氧化应激时出现异常。持续的、不可逆的氧化应激状态,可导致肝细胞膜脂质过氧化、细胞功能异常,最终导致死亡。MAO和MDA通常联合应用评价细胞的氧化应激水平,可以反映机体受自由基攻击的严重程度[12]。本研究发现,较高剂量组和高剂量组肝脏组织MAO及MDA随服药时间延长有逐步升高的趋势,尤其是高剂量组更明显,第12周时达高峰,表明大黄素导致肝损伤的机制可能与机体的氧化应激有关。
本研究有十分重要的临床指导意义。临床医师在使用中药时,需要做到合理用药,需要针对主要病因,进行详细辨证论治、君臣佐使、合理配方。同时用药前详细询问病史和用药史,重视特殊人群的用药安全;熟悉药性,减少不合理用药;尽量避免使用或大剂量使用易致DILI的药物;需要密切注意患者中药使用过程中的临床表现变化,尤其是乏力、食欲缺乏、尿黄、皮肤黄染的症状,部分患者可伴恶心、厌油、腹胀等消化道症状。体检肝功能发现异常的患者,需要高度重视发生药物性肝损伤的可能性并及时处理。加强中药不良反应监测,加强中药生药及其制剂的质量控制等[13],使中医药更好地为人类的健康保驾护航。
[1]TESCHKE R,ZHANG L,LONG H,et al.Traditional Chinese medicine and herbal hepatotoxicity∶a tabular compilation of reported cases[J].Ann Hepatol,2015,14(1)∶7-19.
[2]SEEFF LB,BONKOVSKY HL,NAVARRO VJ,et al.Herbal products and the liver∶a review of adverse effects and mechanisms[J].Gastroenterology,2015,148(3)∶517-532.
[3]吴孟超,李梦东.实用肝病学[M].北京∶人民卫生出版社,2011∶302-311.
[4]孙震晓,张力.何首乌及其制剂相关肝损害国内文献回顾与分析[J].药物不良反应杂志,2010,12(1)∶26-30.
[5]方欢乐,陈衍斌.何首乌的研究进展[J].现代中医药,2006,26(6)∶60-62.
[6]方红玫,朱廷焱.何首乌有效成分、毒性作用和相关研究进展[J].国际药学研究杂志,2010,37(4)∶283-286.
[7]严俊,茹仁萍,孙国明,等.102例中药及中药制剂引起的药物性肝损害的回顾分析[J].中国中医药科技,2011,18∶537-538.
[8]何岳珍.何首乌与肝损伤关系的研究进展[J].医学综述,2013,19(12)∶2206-2208.
[9]韩晓,吴成爱,王伟,等.何首乌二苯乙烯苷降血脂作用机理研究[J].中华中医药学刊,2008,26(8)∶1687-1689.
[10]ZHANG HY,HAN DW,ZHAO ZF,et al.Multiple pathogenic factor-induced complications of cirrhosis in rats∶a new model ofhepatopulmonarysyndromewithintestinalendotoxemia[J].World J Gastroenterol,2007,13(25)∶3500-3507.
[11]MORMONE E,GEORGE J,NIETO N.Molecular pathogenesis of hepatic fibrosis and current therapeutic approaches[J].Chem Biol Interact,2011,193(3)∶225-231.
[12]谷川久一.氧化应激与肝病[J].日本医学介绍,2006,27(12)∶560-562.
[13]刘平,袁继丽,倪力强.重视中药的肝损伤问题[J].中国新药与临床杂志,2007,26(5)∶388-391.
(童颖丹 编辑)
Mechanism of liver injury induced by high-dose Emodin in rats*
Bin ZHANG,Shen-hua DING,Xue-mei QIAN,Wei-shan ZHU
(Department of Liver Disease,Qingpu Branch of Zhongshan Hospital Affiliated to Fudan University,Shanghai 201700,P.R.China)
drug-induced liver injury;Emodin;pathology;oxidative stress
R285.5;R575.3
A
1005-8982(2015)35-0018-04
2015-04-14
上海市青浦区科委基金(No:青科发201210)
Abstrace:【Objective】To study the oxidative stress mechanism and liver pathology of Emodin-induced liver injury in rats.【Methods】According to Emodin daily intake,male Wistar rats were randomly divided into six groups including high-dose group,larger-dose group,medium-dose group,low-dose group,solvent group and normal group.In each group 5 rats were sacrificed in the 4th and 8th week.The remaining rats were all sacrificed in the 12th week.The liver and spleen index changes were studied.With the help of HE staining and the detection kit,the pathology and the expressions of malonaldehyde(MDA)and monoamine oxidase(MAO)in the liver tissue were both studied.【Results】Rat growth had no significant difference among the groups.There was no death or ascites formation in any group.The liver and spleen indexes of the high-dose group and larger-dose group had significantly rising trends.The inflammation activity in the liver tissue was significant in the larger-dose group and high-dose group after the 8th week,which was especially obvious in the high-dose group.The MAO and MDA content of the liver tissue had a rising trend in the larger-dose group and high-dose group,which reached the top at 12th week and more obvious in the high-dose group.【Conclusions】The rat liver injury model could be induced by high dose of Emodin.The oxidative stress mechanism may be associated with live injury,which needs to be explored further.

