多药耐药基因1(Abcb1)敲除和人源化大鼠模型的建立
马 婧,陈 炜,张 旭,马元武,吕 丹,高 虹,张连峰
(中国医学科学院&北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
研究报告
多药耐药基因1(Abcb1)敲除和人源化大鼠模型的建立
马 婧,陈 炜,张 旭,马元武,吕 丹,高 虹,张连峰
(中国医学科学院&北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
目的 敲除大鼠多药耐药基因1(Abcb1),并在基因敲除大鼠的基础上建立Abcb1人源化大鼠模型,为Abcb1相关药物代谢和药物评价研究提供更接近人类的动物模型。方法 利用大片段转基因技术和CRISPR/ Cas9技术相结合,建立人源化大鼠模型,利用PCR,RT-PCR和Real-time PCR的方法进行鉴定及分析。结果 将包含人源Abcb1启动子和cDNA的153 kb BAC片断转入到大鼠基因组,获得稳定表达h-Abcb1基因的大鼠,同时建立了Abcb1基因敲除大鼠。通过将两者杂交建立了Abcb1人源化大鼠模型。人源大鼠与大鼠内源Abcb1表达谱有明显的区别,人源化大鼠不仅表达h-Abcb1基因,在组织表达谱方面也与人类更接近。结论 建立了Abcb1基因敲除大鼠和人源化大鼠模型,Abcb1人源化模型可作为Abcb1基因相关药物代谢研究更接近人类的动物模型。
Abcb1;人源化;BAC;基因敲除大鼠
P-糖蛋白是一种相对分子量为170×103的单链跨膜糖蛋白,由多药耐药基因Abcb1(又称Mdr1)编码,参与药物吸收、分布、代谢及排泄等过程[1]。在生理状态下,P-糖蛋白的存在可保护机体安全,而在病理清况下,P-糖蛋白于血脑屏障的表达使得药物不能进入中枢神经系统[2],于肿瘤细胞中的表达[3]导致机体产生多药耐药现象[4-5],所以控制P-糖蛋白表达的Abcb1基因与多种药物有效性和安全性相关。
大鼠不仅是生理、代谢、神经及行为等研究广泛使用的动物[6],也是药典规定的用于药物安全性评价的指定动物之一。由于物种差异,大鼠的P-糖蛋白与人体的P-糖蛋白的表达图谱和蛋白结构都有一定差异[7],所以,利用动物进行药物有效性和安全性评价的结果与临床试验结果不一致的清况时有发生[8]。
采用BAC[9](细菌人工染色体)的方法可以将h-Abcb1基因导入到大鼠的受精卵中,建立基因结构、表达谱和调节方式与人类相似的模型[10],能够更好的模拟人类h-Abcb1的表达图谱,从而更加客观的评价药物。同时采取基因敲除的技术[11-12]剔除大鼠该内源基因的表达,建立人源化大鼠模型,为Abcb1相关药物筛选、毒理评价提供良好的人源化大鼠模型。
1 材料和方法
1.1 表达Abcb1的细菌人工染色体及其转基因大鼠的制作
利用同源重组的方法在 Abcb1-BAC克隆(RP11-42N21)距5’上游65 kb的位置插入h-Abcb1基因的最长男接体cDNA(4718 bp),(构建好的载体起始密码子ATG上游长度为66 kbp,ATG下游长度为87 kbp),构建表达Abcb1的BAC表达载体(中科院动物所提供)。将构建好的载体经过酚氯仿抽提后,调整浓度至1~2 ng/μL,利用显微注射技术将BAC注射到SD大鼠的受精卵中(大鼠购自北京维通利华实验动物有限公司【SCXK(京)2012-001】),用SD大鼠作为假孕受体大鼠(大鼠购自北京维通利华实验动物有限公司【SCXK(京)2012-001】),制备转基因大鼠(TE2000U纤维注射仪)。实验相关动物在本所卫生部人类疾病比较医学重点实验室繁育【SYXK(京)2013-002】,实验中设计动物操作程序已经得到中国医学科学院医学实验动物研究所动物使用与管理委员会批准,批准号为ILAS-GC-2012-001。
1.2 Abcb1b基因敲除大鼠的制作
主要包括以下几个部分:1)用于Abcb1b基因打靶的gRNA质粒构建2)体外转录3)Cas9/sgRNA的原核注射。
用于Abcb1b基因打靶的gRNA质粒构建:针对Abcb1b基因设计两个靶点 GGAGACAAATACA CAAGATT以及GG TTTGACGTGAATGACGCT,合成两对寡聚核苷酸链(RAT-ABCB1-E1(1)-gRNA: TAGGAGACAAATACACAAGATT和AAACAATCTTG TGTATTTGTCT;RAT-ABCB1-E1(2)-gRNA:TAGGT TTGACGTGAATGACGCT和AAACAGCGTCATTCAC GTCAAA)用于制备sgRNA合成的寡聚核苷酸经退火(97℃6min后自然冷却至室温),连入经Bsa I酶切回收的pUC57-sgRNA表达载体(南京大学黄兴许老师惠赠),构建sgRNA表达载体。测序验证后,选择正确克隆。
体外转录:Cas9表达质粒(Addgenne No.44858,南京大学黄兴许老师惠赠),经Age I酶切线性化,经酚氯仿抽纯化后,溶于无核酸酶的水中作为模板,用于体外转录。Cas9 mRNA的合成由试剂盒T7Ultra Kit(Amibion,AM1345)在体外作用T7 RNA聚合酶完成。sgRNA的表达载体经DraI酶切线性化后,经酚氯仿纯化,溶于无核酸酶的水中作为模板,用于体外转录。sgRNA的体外合成由试剂盒MEGAshortscript Kit(Ambion,AMI354)在体外利用T7 RNA聚合酶完成。
Cas9/sgRNA的原核注射:转录好的Cas9 mRNA和sgRNA混合并且调整浓度至20 ng/μL和10 ng/ μL/sgRNA,显微注射法将RNA混合物注射到SD大鼠的受精卵的雄性核和细胞质中制备转基因大鼠。
1.3 Abcb1-BAC转基因大鼠及Abcb1b基因敲除大鼠的基因型鉴定
首建鼠于出生7~14 d时,男趾标记,收集男下的组织,选用酚氯仿提取基因组DNA,溶于0.1× TE中,使用PCR法对首建鼠进行筛选。对于Abcb1 -BAC转基因大鼠,使用三对PCR引物分别对插入BAC的上中下游进行完整性检测,分别为:Abcb1-BAC-F1:5’-CACCAGTTGAAGAGCGTTGA-3’下游Abcb1-BAC-R1:5’-GCTGCTGATGTGCTGATTGT-3’Abcb1-BAC-F2:5’-CCAATGATGCTGCTCAAG-3’下游 Abcb1-BAC-R2:5’-GAGTTTATGTGCCACCAAGT AG-3’Abcb1-BAC-F3:5’-AGTGGTGTTTCAGAATG GC-3’下游Abcb1-BAC-R3:5’-GTCAGTTACAGTCC AAATGGG-3’(Life Technologies,中国)。PCR反应体系20μL(PCR反应相关试剂购自宝生物工程有限公司,中国)。反应条件:95℃5 min;(95℃30 s,58℃30 s,72℃30 s,30个循环);72℃10 min;4℃保温。扩增片段大小分别为316 bp,449 bp,410 bp。对于Abcb1b基因敲除大鼠,设计一对引物包含作用靶 点, 上 游 引 物 为 Abcb1-check-F1: GCTACAATGACATGTCCTACCCAAT下游引物为Abcb1-check-R1:AGTCTTGATTCTGCCAGCCTAGTC (上海英俊生物技术技术有限公司合成,中国)。PCR反应体系50μL(PCR反应相关试剂购自宝生物工程有限公司,中国)。反应条件:95℃ 5 min; (95℃30 s,62℃30 s,72℃30 s)×30循环;72℃10 min;4℃保存。扩增片段大小为737 bp。并通过TA克隆、测序进一步检测确定突变。
1.4 Abcb1人源化大鼠的培育
通过将得到的r Abcb1b基因敲除大鼠进行杂交,获得r Abcb1b基因敲除纯合子大鼠,将hAbcb1-BAC阳性大鼠与rAbcb1b基因敲除大鼠杂交,得到BAC阳性且rAbcb1b基因敲除杂合子大鼠,将此大鼠与rAbcb1b基因敲除纯合子大鼠杂交,即可获得hAbcb1-BAC阳性且rAbcb1b基因敲除纯合子大鼠。这种大鼠缺乏r-Abcb1b基因的表达,同时携带通过BAC技术得到的h-Abcb1基因。
1.5 RT-PCR检测hAbcb1组织表达情况
Abcb1人源化大鼠与野生型大鼠交配,对其子代的基因表达清况进行分析。颈椎脱臼法牺牲大鼠,提取F1代大鼠及野生对照大鼠心脏、肝脏、肾脏、肺、脑组织的总RNA。制备cDNA,利用引物RTAbcb1-F:5’-GGCTATCATTACTCTTTACCTGTGAAG-3’和RT-Abcb1-R:5’-CCGGATTGACTGAATGCTG -3’,扩增大小为225 bp的目的片段,PCR反应体系20μL(PCR反应相关试剂购自宝生物工程有限公司,中国)。反应条件:95℃5 min;(95℃30 s,62℃30 s,72℃30 s,24个循环);72℃10 min;4℃保存。GAPDH作为内参。
1.6 Real-time PCR检测组织内Abcb1m RNA表达情况
颈椎脱臼法牺牲大鼠,提取心、肝、脾、肾、脑、胸腺等组织总RNA,制备cDNA。
标准曲线的建立:使用引物Abcb1-wt-standard-F1:5’-CAGGAGATAGGCTGGTTTGACG-3’;Abcb1-wt-standard-R1:5’-GGCCCTTCAAGATCTTAACTTCA C-3’以及 Abcb1-human-standard-F1:5’-CAGTGG AATTGGTGCTGG-3’;Abcb1-human-standard-R1:5’-AACACTAAAAGCCCCAATTAATACAG-3’分别扩增野生型大鼠体内的rAbcb1b基因以及人源化大鼠体内的hAbcb1基因,片段长度分别为766 bp及682 bp。将携带有rAbcb1基因及hAbcb1基因的质粒作为模板,稀释范围为1×1010~1×103拷贝/μL,使用Power SYBR Green Master Mix体系,反应条件为: 95℃ 预变性 5 min进入循环:95℃30 s,59℃(r Abcb1)或61℃(h Abcb1)退火30 s,72℃延伸30 s,循环40次,在每个循环结束后测定吸光值。建立标准曲 线 时 使 用 的 引 物 为 Abcb1-wt-F1:5’-GAATGTTCTTTCAGTCCATAACGA-3’和 Abcb1-wt-R1:5’-GTTCTGATGGCTGCTAAGACTTC-3’以及Abcb1-human-F1:5’-TGGTTGCTGCTTACATTCAGG-3’和 Abcb1-human-R1 5’-CAGCTGACAGTCCAAG AACAGG-3’。
使用Abcb1-wt-F1/R1和Abcb1-human-F1/R1分别对野生型大鼠及人源化大鼠的Abcb1基因进行扩增,根据标准曲线,计算不同组织拷贝数,重复3次。GraphPad Prism 5软件分析。
2 结果
2.1 hAbcb1–BAC转基因大鼠的制备与分析
利用同源重组的方法在Abcb1-BAC克隆(RP11-42N21)5’上游65 kb的位置插入h-Abcb1基因的最长男接体cDNA(4718 bp),(构建好的载体起始密码子ATG上游长度为66 kbp,ATG下游长度为87 kbp)完成了表达Abcb1的BAC表达载体(图1)。获得15只F0代大鼠,提取其基因组DNA,PCR鉴定,共获得4只表达全长h-Abcb1的首建鼠(图2)。但只有3只首建鼠能稳定传代。提取大鼠的心脏、肝脏、肾脏、肺、脑的RNA[13],RT-PCR方法分析Abcb1的RNA水平表达清况,结果表明3个转基因大鼠系(2号,5号和8号)的脑组织均有Abcb1基因的表达,但是只有5号转基因大鼠系的心脏组织有Abcb1基因的表达,并且在肝脏,肺和脑组织中Abcb1的表达量最高(图3)
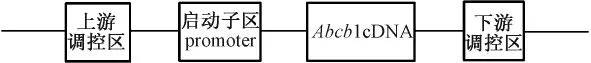
图1 BAC-Abcb1细菌人工染色体结构图Fig.1 The structure of BAC-Abcb1
2.2 Abcb1b基因敲除大鼠的制备
经显微注射,得到12只首建鼠,经基因型鉴定,筛选获得三只(1号,5号和9号)首建鼠系(图4A),并对这三只首建鼠系的扩增产物进行测序分析,确定了CRISPR/Cas9对Abcb1b的基因修饰清况(图5A)。
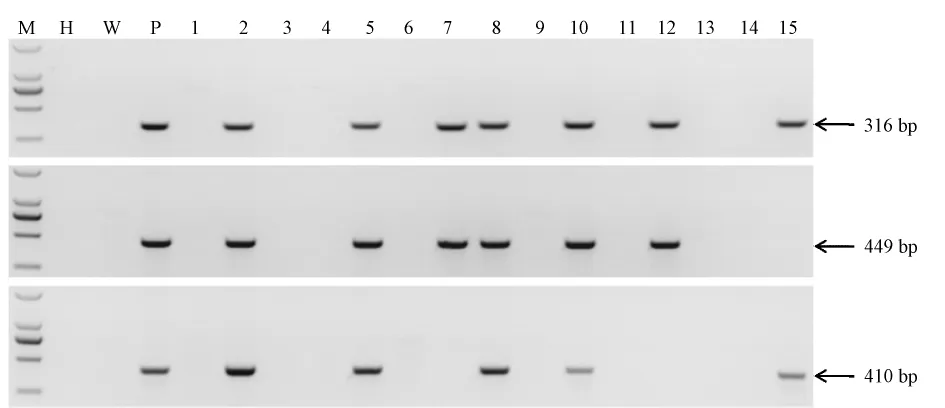
图2 PCR鉴定BAC-Abcb1大鼠基因型Note:M:DNA molecular weightmarker DL2000;H:H2O;W:Negative control;P:Positive control; 1-15:ratswere generated bymicroinjection,2,5,8,10 were four positive founders.Fig.2 Identify the genotype of the BAC-Abcb1 rats by PCR
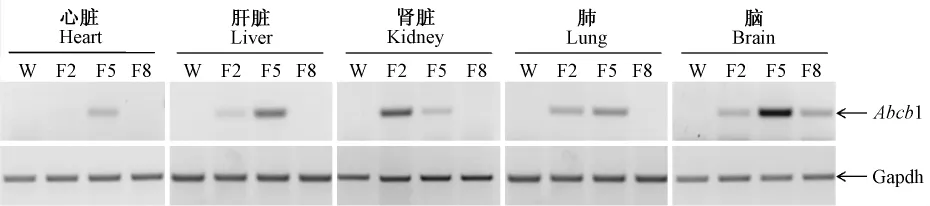
图3 RT-PCR分析Abcb1在F1代大鼠中的基因表达清况Note:W:Negative control;F2,F5 and F8 are generated by crossing founder 2,5,8 with wild type rats.F5 has human Abcb1 expression in heart,liver,kidney,lung and brain.Fig.3 Abcb1 gene expression in F1 ratswere analyzed by RT-PCR
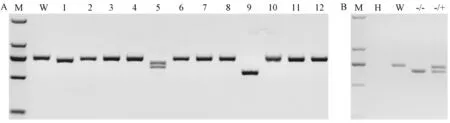
图4 Abcb1b基因敲除大鼠的基因型鉴定Note:M:DNA molecular weightmarker DL2000;H:H2O;W:Negative control;A:1-12:Rats generated bymicroinjection.B:The off springs of founder 5 were identified by PCR,Themutation can be transmitted.-/+:Abcb1 heterogeneous rat.-/-:Abcb1 homozygous rat.Fig.4 Identify the genotype of the Abcb1b knockout rats by PCR
分析发现5号首建鼠系含有62 bp的DNA片段缺失,该缺失造成了Abcb1b基因的移码突变,并提前产生了终止密码子。我们将5号首建鼠系与野生型大鼠交配,对子代大鼠进行基因型鉴定(图4B),测序结果表明该缺失能够稳定遗传(图5B)。
2.3 Abcb1人源化大鼠的培育
将Abcb1b基因敲除大鼠和hAbcb1-BAC转基因大鼠杂交,最终获得 r Abcb1b基因敲除和表达hAbcb1的大鼠,即为人源化 Abcb1大鼠。6号为Abcb1人源化大鼠(图6A、B)。
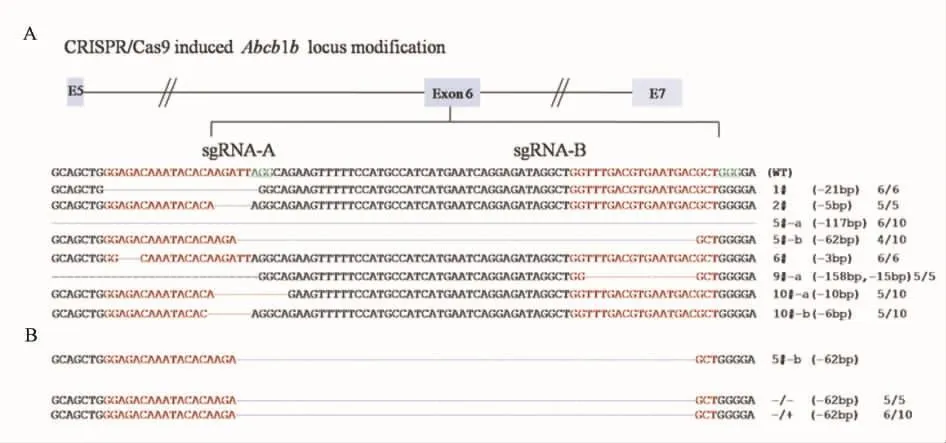
图5 Abcb1b基因敲除大鼠的测序结果分析Note:The PAM sequence is underlined and highlighted in green;the targeting site are red;themutations are blue; deletions(-)are shown to the right of each allele.N/N Indicates positive colonies out of total sequenced.A:The sequence result of founder rats.D:Sequencing result of offspring rat.Fig.5 The sequence result analysis of Abcb1b knockout ratmodel
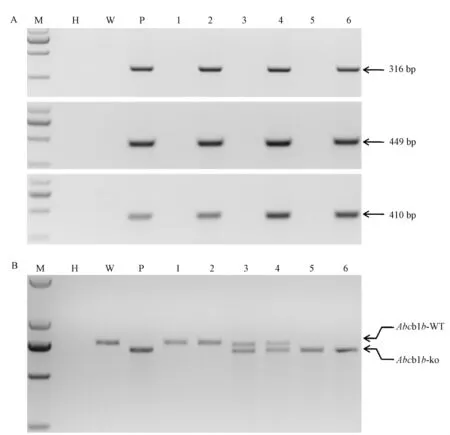
图6 Abcb1人源化大鼠的鉴定Note:M:DNA molecular weightmarker DL2000;H:H2O;W:Negative control.P:Positive control.1-6:Rats were got by crossing BAC-Abcb1 ratwith Abcb1b knock out rat.A:2,4,6 are transgenic positive rats;1,3,5 are transgenic negative rat B:1,2 are wild type rat;3,4 are Abcb1b heterogeneous rat;5,6 are Abcb1b homozygous rats.6 is the humanized Abcb1 rat.Fig.6 Generation of humanized Abcb1 rat
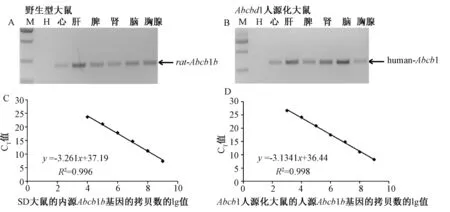
图7 RT-PCR检测野生型大鼠和人源化大鼠组织中Abcb1 mRNA表达水平及Abcb1-human和Abcb1b-rat质粒10倍系列稀释的标准曲线Note:A:The wild type rat RT-PCR products detected by agarose gel,analyzing the Abcb1b expression level in tissues.B:The Abcb1 humanized rat RT-PCR products detected by agarose gel,analyzing Abcb1 expression level in tissues C:The standard curve of 10-fold serial dilutions of Abcb1b-rat plasmid D:The standard curve of10-fold serial dilutions of Abcb1-human plasmid.Fig.7 The Abcb1 mRNA expression level of wild type rat and Abcb1 humanized rat in different tissues detected by RT-PCR and the standard curve of 10-fold serial dilution of Abcb1-human and Abcb1b-rat plasmid
2.4 Abcb1人源化大鼠和野生型大鼠Abcb1b表达情况对比分析
以心、肝、脾、肾、脑、胸腺等组织的cDNA为模板,扩增 Abcb1,发现野生型大鼠体内肝脏和脑Abcb1b表达量高,心脏和肾脏表达量相对较低(图7A、B)。人源化大鼠体内肝脏、肾脏和脑内Abcb1表达量高,心脏表达量较低。将携带有rAbcb1b基因及hAbcb1基因的质粒以10倍梯度系列稀释作为模板扩增得到的标准曲线R2>0.99,符合曲线要求(图7C、D)。Abcb1基因拷贝数经统计分析可以看出Abcb1人源化大鼠心脏的拷贝数达到5×104拷贝/mg,在肝脏为5×104拷贝/mg,脾脏为8×104拷贝/mg,肾脏为1.2×105拷贝/mg,脑为2×105拷贝/mg,心脏、脾脏、肾脏和脑中h-Abcb1的拷贝远高于r-Abcb1,结果与琼脂糖凝胶电泳结果一致(图8)。
3 讨论
制作人源化动物模型是研究人类基因功能的重要方法,人源化实验动物模型主要包括基因水平上的人源化动物模型以及细胞组织水平的人源化动物模型[14]。基因水平的人源化动物模型制作主要有两种方法,一种为基因敲入的方法[15-16],另一种是将动物的内源基因敲除后转入BAC。与前者相
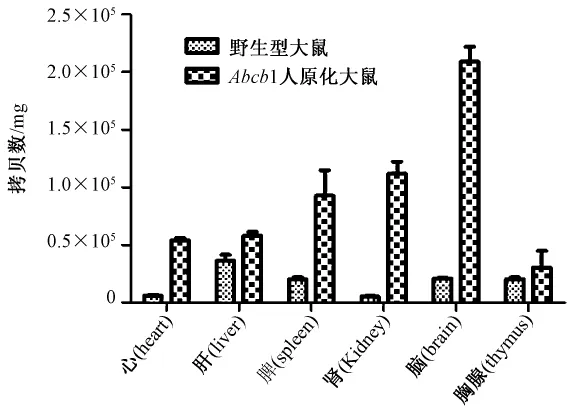
图8 Real-time PCR检测野生型大鼠和人源化大鼠组织中Abcb1 mRNA表达水平Note:The copy numbers of Abcb1-human and Abcb1b-rat in heart,liver,spleen,kidney, brain,thymus permilligram.Fig.8 The Abcb1 mRNA expression level ofwild type rat and Abcb1 humanized rat in different tissues detected by Real-time PCR
比,BAC法[17]不仅将待研究的目的基因转入到动物体中,而且其启动子及上下游的调控序列也同时被转入动物体中,更好模拟人类基因功能。
P-糖蛋白最早于1976年由Juliao和Ling等[18]在秋水仙碱耐药的中国仓鼠卵巢细胞中发现,但随后的研究表明其广泛存在于机体的各个组织[19],P-糖蛋白是第一个被发现的人类ABC转运蛋白,之后在啮齿类动物中也发现了此类蛋白,它是一种能量性依赖的跨膜输出泵,可将抗肿瘤药物逆浓度从细胞内转运至细胞外,降低胞内浓度并导致多药耐药现象的产生。人体中P-糖蛋白首先在肿瘤细胞中发现,之后的研究表明它在人体正常组织中也广泛表达,例如肠道上皮细胞,肝细胞毛细胆管膜,肾近曲小管上皮细胞,血脑屏障毛细血管内皮细胞等。它能防止机体对有害物质的吸收和介导物质的输出,保护大脑,睾丸,胎儿等重要器官,人体中Abcb1基因控制表达的P-糖蛋白与药物分布和转运密切相关[20]。P-糖蛋白能利用机体中的ATP将已进入细胞的外源性的药物毒物转运出来,降低细胞内药物毒物浓度[21]。
种属差异是造成药物在临床试验后被淘汰的原因之一[22-24],制备稳定可靠的实验动物模型是关系到实验结果真实可靠的重要影响因素[25]。
大鼠基因组中,有两个同源基因 Abcb1a及Abcb1b编码P-糖蛋白,二者氨基酸序列相似性为85%,与同源的人类Abcb1的氨基酸相似性>80%,大鼠的Abcb1a及Abcb1b基因与人类的Abcb1基因同样对抗抗癌药物,阻止其进入靶器官。Abcb1a与Abcb1b基因在组织器官的分布不同但总体清况与人类的Abcb1基因是一致的,它们与人类的Abcb1基因承担着相同的功能。Abcb1a主要分布在大脑,小肠,肝脏,肾脏,而Abcb1b主要分布在肾上腺,子宫内膜,子宫,卵巢,胎盘,肝脏,肾脏及脑实质[1]。本研究用人源的Abcb1基因替换了大鼠的Abcb1b基因,为Abcb1相关药物提供实验动物模型,而用人源的Abcb1基因替代Abcb1a及Abcb1b双基因的模型我们将在接下来的工作中进行研究。
本研究制作出的Abcb1人源化实验动物模型,其内源的Abcb1b基因采用CRISPR/Cas9[26-27]的方法敲除,与锌指核酶(ZFNs)技术[28]、转录激活样效应因子(Talens)技术[29]相比,设计和构建过程相对简单。
根据从 Expression Atlas(http://www.ebi.ac.uk/gxa/home)得到的基于微阵列和RNA序列分析的信息,人体中主要组织Abcb1表达水平从高到低依次为肾(29),肝(17),胸腺(1),心(0.7),在人体大脑组织中也有Abcb1基因表达[30-31]。从本研究中可以看出在野生型大鼠体内各组织Abcb1b表达水平从高到低为肝,脑,心,肾。本研究培育出的Abcb1人源化大鼠体内转入的Abcb1-BAC片段是完整的,经过Real-time PCR的方法定量分析显示h-Abcb1在大鼠体内按表达量高低排序为脑,肾,肝,心,这与人体中Abcb1在各组织表达趋势是一致的。
因此,本研究建立的Abcb1人源化动物模型组织表达谱更接近人类,为相关药物分析及评价提供了有价值的实验动物模型。
[1] E.M.Leslie,R.G.Deeley,S.P.Cole.Multidrug resistance proteins:role of P-glycoprotein,MRP1,MRP2,and BCRP (ABCG2)in tissue defense[J].Toxicol Appl Pharmacoll, 2005,204(3):216-237.
[2] E.Choong,M.Dobrinas,P.A.Carrupt,et al.The permeability P-glycoprotein:a focus on enantioselectivity and brain distribution[J].Expert Opin Drug Metab Toxicoll,2010, 6(8):953-965.
[3] J.Ferte.Analysis of the tangled relationships between P-glycoprotein-mediated multidrug resistance and the lipid phase of the cellmembrane[J].Eur JBiocheml,2000,267(2):277-294.
[4] P.Kwan and M.J.Brodie.Potential role of drug transporters in the pathogenesis of medically intractable epilepsy[J].Epilepsial,2005,46(2):224-235.
[5] Y.Romsicki and F.J.Sharom.The ATPase and ATP-binding functions of P-glycoprotein—modulation by interaction with defined phospholipids[J].Eur JBiocheml,1998,256(1): 170-178.
[6] A.Abbott.Laboratory animals:the Renaissance rat[J].Naturel,2004,428(6982):464-466.
[7] L.Su,P.Jenardhanan,D.D.Mruk,et al.Role of P-glycoprotein at the blood-testis barrier on adjudin distribution in the testis:a revisit of recent data[J].Adv Exp Med Bioll, 2012,763:318-333.
[8] A.E.Hudson and H.C.Hemmings,Jr.Are anaesthetics toxic to the brain?[J].Br JAnaesthl,2011,107(1):30-37.
[9] J.J.Harrington,G.Van Bokkelen,R.W.Mays,et al.Formation of de novo centromeres and construction of firstgeneration human artificial microchromosomes[J].Nat Genetl, 1997,15(4):345-355.
[10] H.Shizuya,B.Birren,U.J.Kim,et al.Cloning and stable maintenance of 300-kilobase-pair fragments of human DNA in Escherichia coli using an F-factor-based vector[J].Proc Natl Acad Sci U SAl,1992,89(18):8794-8797.
[11] L.Cong,F.A.Ran,D.Cox,et al.Multiplex genome engineering using CRISPR/Cas systems[J].Sciencel,2013, 339(6121):819-823.
[12] P.Mali,L.Yang,K.M.Esvelt,et al.RNA-guided human genome engineering via Cas9[J].Sciencel,2013,339(6121):823-826.
[13] A.Peinnequin,C.Mouret,O.Birot,et al.Rat proinflammatory cytokine and cytokine related mRNA quantification by real-time polymerase chain reaction using SYBR green[J].BMC Immunoll,2004,5:3.
[14] K.Yoshizato and C.Tateno.A mouse with humanized liver as an animal model for predicting drug effects and for studying hepatic viral infection:where to next?[J].Expert Opin Drug Metab Toxicoll,2013,9(11):1419-1435.
[15] M.D.Swain,K.L.Orzechowski,H.L.Swaim,et al.P-gp substrate-induced neurotoxicity in an Abcb1a knock-in/Abcb1b knock-outmouse model with a mutated canine ABCB1 targeted insertion[J].Res Vet Scil,2013,94(3):656-661.
[16] Y.Ma,J.Ma,X.Zhang,et al.Generation of eGFP and Cre knockin rats by CRISPR/Cas9[J].FEBS Jl,2014,281(17): 3779-3790.
[17] Y.Kazuki and M.Oshimura.Human artificial chromosomes for gene delivery and the development of animal models[J].Mol Therl,2011,19(9):1591-1601.
[18] S.F.Zhou.Structure,function and regulation of P-glycoprotein and its clinical relevance in drug disposition[J].Xenobiotical, 2008,38(7-8):802-832.
[19] F.Thiebaut,T.Tsuruo,H.Hamada,et al.Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues[J].Proc Natl Acad Sci U SAl,1987,84(21):7735-7738.
[20] R.Silva,V.Vilas-Boas,H.Carmo,et al.Modulation of P-glycoprotein efflux pump: induction and activation as a therapeutic strategy[J].Pharmacol Therl,2014,
[21] S.Fellner,B.Bauer,D.S.Miller,et al.Transport of paclitaxel(Taxol)across the blood-brain barrier in vitro and in vivo[J].JClin Investl,2002,110(9):1309-1318.
[22] H.Y.Kay,H.Wu,S.I.Lee,et al.Applications of genetically modified tools to safety assessment in drug development[J].Toxicol Resl,2010,26(1):1-8.
[23] 宋书元.新药临床前药理毒理研究与临床试验的关系[J].中国临床药理学杂志l,1991,(02):80-84.
[24] 袁伯俊,顾长虹.临床药理评价不可忽视的问题─比较药理学研究[J].中药新药与临床药理,1996,(01):45-47.
[25] 杜冠华.药物临床前研究与转化医学—实验动物的应用与动物实验[J].中国比较医学杂志,2011,(Z1):24-26.
[26] Y.Ma,L.Zhang and X.Huang.Genome modification by CRISPR/Cas9[J].FEBS Jl,2014,281(23):5186-5193.
[27] 马元武,马婧,路迎冬,等.利用CRISPR/Cas9敲除大鼠胰岛素受体底物1(Irs1)基因[J].中国比较医学杂志,2014, (03):55-60.
[28] A.M.Geurts,G.J.Cost,Y.Freyvert,et al.Knockout rats via embryomicroinjection of zinc-finger nucleases[J].Sciencel, 2009,325(5939):433.
[29]Y.H.Sung,I.J.Baek,D.H.Kim,et al.Knockoutmice created by TALEN-mediated gene targeting[J].Nat Biotechnoll, 2013,31(1):23-24.
[30] D.S.Miller.Regulation of P-glycoprotein and other ABC drug transporters at the blood-brain barrier[J].Trends Pharmacol Scil,2010,31(6):246-254.
[31] S.Gazzin,N.Strazielle,C.Schmitt,et al.Differential expression of themultidrug resistance-related proteins ABCb1 and ABCc1 between blood-brain interfaces[J].J Comp Neuroll, 2008,510(5):497-507.
Establishment of Abcb1 knock out rat and Abcb1 humanized ratmodels
MA Jing,CHENWei,ZHANG Xu,MA Yuan-wu,LV Dan,GAO Hong,ZHANG Lian-feng
(Key Laboratory of Human Disease Comparative Medicine,Ministry of Health,Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences(CAMS)&Peking Union Medical College(PUMC),Beijing 100021,China,)
Objective To knock out the Abcb1 gene of rat,and establish the Abcb1 humanized ratmodel based on the Abcb1 knock out rat.M ethods The animalmodelwas established using BAC and CRISPR/Cas9 technology,and was analyzed by PCR,RT-PCR and real-time PCR.Results Establishing a rat model expressing human Abcb1 stably by transfer the 153 kb BAC containing human Abcb1 promoter and cDNA into rat genome,and establishing the Abcb1 knock out rat at the same time.Establishing the Abcb1 humanized model by crossing these two strains together.The expression pattern of Abcb1 in Abcb1 humanized rat is different from the wild type rat.The Abcb1 humanized model express notonly the human Abcb1 gene butalso has similar expression pattern as human.Conclusions The Abcb1 knock out ratand the Abcb1 humanized ratwere successfully established,and thismodel is close to human concerning about the drugmetabolism related to Abcb1.
Abcb1;Humanized;BAC;Gene knock out rat
R332
A
1671-7856(2015)03-0001-08
10.3969.j.issn.1671.7856.2015.003.01
2015-02-04
国家“重大新药创制”科技重大专项课题基于人源化模型和肝脏生物功能网络的药物肝毒性预测关键新技术(2012ZX09301001-006)。
马婧(1991-),女,硕士生,研究方向:比较医学。E-mail:alanyingtao519@163.com。
张连峰,E-mail:zhanglf@cnilas.org;高虹,E-mail:gaohongdws@aliyun.com。

