年龄对脂质代谢的影响
邢晓然,余振球
年龄对脂质代谢的影响
邢晓然,余振球
目的了解不同年龄段血脂、载脂蛋白变化情况。方法选取2011年11月—2013年6月就诊于我院的652名18岁~60岁健康查体者,按年龄分为18岁~28岁组、29岁~40岁组、41岁~50岁组、51岁~60岁组。对比各组三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB)、载脂蛋白CⅢ(ApoCⅢ)水平变化。结果29岁~40岁组、41岁~50岁组、51岁~60岁组血浆总胆固醇、三酰甘油、载脂蛋白CⅢ水平与18岁~28岁组比较差异有统计学意义(P<0.05),而29岁以上各年龄段间差异无统计学意义(P>0.05);18岁~40岁组血浆总胆固醇和三酰甘油、载脂蛋白CⅢ水平明显低于41岁~60岁组,差异有统计学意义(P<0.05)。结论血脂异常存在年轻化趋势,40岁后脂质代谢能力出现明显衰退。
年龄;血脂代谢;载脂蛋白
随着人民生活方式和饮食结构的改变,心血管疾病发病年龄也有逐渐年轻化的趋势[1]。其中,早发冠心病(发病年龄男性<55岁,女性<65岁)的发病人数约占冠心病的1/4[2]。因此,心血管疾病已严重威胁到人们的健康,同时为社会和家庭也带来沉重的负担。血脂异常是心血管疾病的独立危险因素之一,尤其在早发冠心病患者中具有重要意义[3]。为了解血脂随年龄的变化情况,本研究选择2011年11月—2013年6月就诊于我院的652名18岁~60岁的健康体检人群,对其总胆固醇(TC)、三酰甘油(TG)及载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB)、载脂蛋白CⅢ(ApoCⅢ)水平进行分析,现报道如下。
1 资料与方法
1.1 研究对象 受试者为2011年11月—2013年6月就诊于我院的体检人群,分别来自北京、内蒙古、山西、新疆、辽宁、河南、山西、天津、河北7省市的18岁~ 60岁健康查体者,按年龄分为18岁~28岁组、29岁~ 40岁组、41岁~50岁组、51岁~60岁组。排除既往有冠心病、脑卒中、急慢性肾功不全、急慢性肝炎、慢性腹泻、肿瘤、甲状腺功能异常、妊娠、3个月内曾服用贝特、他汀、烟酸、多廿烷醇影响脂质代谢药物。最终选取652名,其中男346例,女306例,男女之比为1.13∶1。
1.2 方法 测量身高、体重,计算体重指数(BMI)。对受试者进行空腹12 h后抽取卧位静脉血检测总胆固醇、三酰甘油、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、ApoA1、载脂蛋白B、载脂蛋白CⅢ。
1.3 统计学处理 采用SPSS18.0统计软件进行统计分析。计量指标以均数±标准差(x±s)表示,采用Tamhane’s T2方差分析方法进行两两比较,以P< 0.05为差异有统计学意义。
2 结 果
29岁~40岁组、41岁~50岁组、51岁~60岁组血浆总胆固醇、三酰甘油、载脂蛋白CⅢ水平与18岁~28岁组比较差异有统计学意义(P<0.05),而29岁以上各年龄段间差异无统计学意义(P>0.05)。18岁~ 40岁组血浆总胆固醇和三酰甘油、载脂蛋白CⅢ水平明显低于41岁~60岁组,差异有统计学意义(P< 0.05)。详见表1、表2。
表1 不同年龄段血脂、载脂蛋白水平比较(±s)mmol/L
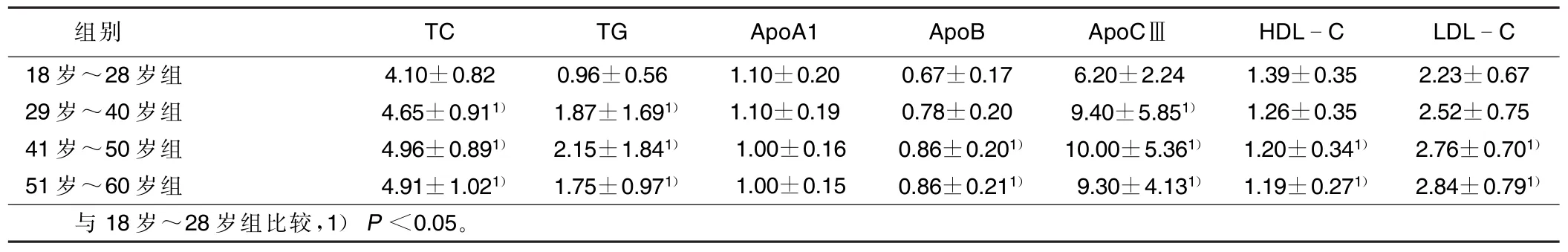
表1 不同年龄段血脂、载脂蛋白水平比较(±s)mmol/L
组别TCTGApoA1ApoBApoCⅢHDLCLDLC 18岁~28岁组4.10±0.820.96±0.561.10±0.200.67±0.176.20±2.241.39±0.352.23±0.67 29岁~40岁组4.65±0.911)1.87±1.691)1.10±0.190.78±0.209.40±5.851)1.26±0.352.52±0.75 41岁~50岁组4.96±0.891)2.15±1.841)1.00±0.160.86±0.201)10.00±5.361)1.20±0.341)2.76±0.701)51岁~60岁组4.91±1.021)1.75±0.971)1.00±0.150.86±0.211)9.30±4.131)1.19±0.271)2.84±0.791)与18岁~28岁组比较,1)P<0.05。
表2 40岁上、下年龄段血脂、载脂蛋白水平比较(±s)mmol/L
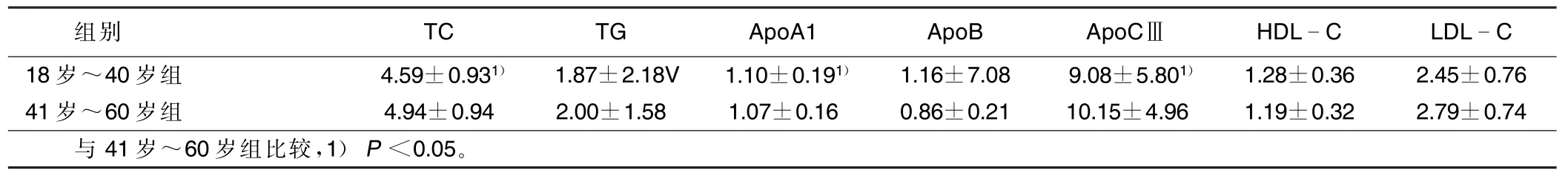
表2 40岁上、下年龄段血脂、载脂蛋白水平比较(±s)mmol/L
组别TCTGApoA1ApoBApoCⅢHDLCLDLC 18岁~40岁组4.59±0.931)1.87±2.18V1.10±0.191)1.16±7.089.08±5.801)1.28±0.362.45±0.76 41岁~60岁组4.94±0.942.00±1.581.07±0.160.86±0.2110.15±4.961.19±0.322.79±0.74与41岁~60岁组比较,1)P<0.05。
3 讨 论
3.1 载脂蛋白作用 随着对血脂代谢过程研究的深入,现已发现载脂蛋白对血脂水平有重要影响。载脂蛋白(Apo)是脂蛋白颗粒的结构蛋白,参与体内各种脂类的转运、代谢,维持血脂平衡。各类载脂蛋白表达或功能的异常都会引发不同的脂类相关心脑血管疾病,如各类高脂血症、动脉粥样硬化、冠心病等。目前已经发现很多种类,一般分为5类~7类,临床上主要应用ApoA1、ApoB、ApoC三种。
ApoA1主要由肝脏合成,是HDL-C的主要结构蛋白,占HDL-C总蛋白的60%~70%。ApoA1是高密度脂蛋白(HDL)的主要成分,ApoA1的测定可直接反映HDL-C水平,主要作用是激活卵磷脂胆固醇脂肪酰基转移酶(LCAT),并从肝外组织清除游离胆固醇,具有抗氧化[4]、抗血栓[5]以及抗炎[6]作用,继而具有抗动脉粥样硬化作用[7-10]。所以ApoA1是一个抗动脉粥样硬化形成的指标。
ApoB也由肝脏合成,是低密度脂蛋白(LDL)的主要成分,除LDL外,极低密度脂蛋白(VLDL)、中等密度脂蛋白(IDL)和脂蛋白(a)均含有1分子ApoB,所以ApoB浓度代表着致动脉粥样硬化性脂蛋白颗粒的总和。氧化的ApoB释放多种炎性物质,导致动脉硬化的进展[11],是动脉粥样硬化的危险因素。
ApoA1、ApoB及其比值在预测冠状动脉病变导致的危险事件中,预测性优于TG、TC、LDL-C、HDL-C等单一传统脂质指标,有更强的冠状动脉事件预测性[12]。ApoA1/ApoB比值降低,<1可视为心血管疾病的危险指标,比单独测定ApoA1或ApoB更有意义[13]。
载脂蛋白CⅢ是一种水溶性低分子量蛋白质,是载脂蛋白C族中含量最丰富的一类,ApoCⅢ是脂蛋白代谢的重要调节剂,主要生理功能是抑制脂蛋白脂酶(lipoprotein lipase,LPL)活性和肝脏脂蛋白受体摄取富三酰甘油脂蛋白(triglyceride-rich lipoprotein, TRL)及其残粒,因此与高三酰甘油血症和心血管疾病密切相关,是冠状动脉粥样硬化性心脏病强有力的预测因子[14]。
3.2 年龄对血脂和脂蛋白水平的影响 通过对比不同年龄段成年人血脂、载脂蛋白情况,本研究结果显示,血浆总胆固醇、三酰甘油水平在18岁~28岁与29岁~40岁、41岁~50岁、51岁~60岁之间差异有统计学意义(P<0.05)。再进一步对胆固醇亚组的分析后发现,HDL-C、LDL-C水平在40岁以上人群存在显著变化,前者明显降低,后者明显升高;载脂蛋白B无显著变化;载脂蛋白CⅢ水平40岁以后显著升高。这也进一步说明血脂异常存在年轻化趋势,而随着年龄的升高,血脂代谢中保护性成分无明显变化而有害性成分显著升高,在常规的血脂测量中即可显示出胆固醇和三酰甘油水平异常,然而隐藏在其背后正是质代谢过程中各种载脂蛋白水平的变化。
综上所述,随着年龄的增长,血脂代谢过程已出现显著变化。因此,应加强40岁以上健康体检人群血脂管理,及时调整饮食结构,纠正各种不健康生活方式,以达到降低心血管病风险、提高生活质量的目的。
[1] Moran A,Gu D,Zhao D,et al.Future cardio-vascular disease in china markov model and risk factor scenario projections from the coronary heart disease policy model-China[J].Circ Cardiovasc Qual Outcomes,2010,3(3):243-252.
[2] Sailam V,Karalis DG,Agarwal A,et al.Prevalence of emerging cardiovascular risk factors in younger individuals with a family history of premature coronary heart disease and low Framingham risk score[J].Clin Cardiol,2008,31(11):542-545.
[3] 史颖岚,樊火印,王咏梅.男性早发冠心病患者吸烟及血脂异常危险因素分析[J].心脑血管病防治,2014,14(1):77-79.
[4] Banka CL.High density lipoprotein and lipoprotein oxidation[J]. Curr Opin Lipidol,1996,7:139-142.
[5] Nofer IR,Walter M,Kehrel B,et al .HDL3-mediated inhibition ofthrombin-induced platelet aggregation and fibrinogen binding occurs via decreased production of phosphoinositide-derived second messengers 1,2-diacylglycerol and inositol 1,4,5-trisphosphate[J].Arterioscler Thromb Vasc Biol,1998,18:861-869.
[6] Haljar DP,Haberland ME.Lipoprotein trafficking in vascular cells. Molecular trojan horses and cellular saboteurs[J].J Biol Chen, 1997,272:22975-22978.
[7] Rubin EM,Krauss RM,Spangler EA,et al.Inhibition of early atherogenesis in transgenic mice by human apolipoprotein AI [J].Nature,1991,353:265-267.
[8] Lawn RM,Wade DP,Hammer RE,et al.Atherogenesis in transgenic mice expressing human apolipoprotein(a)[J].Nature, 1992,360:670-672.
[9] Paszty C,Maeda N,Verstuyft J,et al.Apolipoprotein AI transgene corrects apolipoprotein E deficiency-induced atherosclerosis in mice[J].J Clin Invest,1994,94:899-903.
[10] Plump AS,Scott CJ,Breslow JL.Human apolipoprotein A-I gene expression increases high density lipoprotein and suppresses atherosclerosis in the apolipoprotein E-deficient mouse[J].Proc Natl Acad Sci USA,1994,91:9607-9611.
[11] Elovson J,Chatterton JE,Bell GT,et al.Plasma very low density lipoproteins contain a single molecule of polipoprotein B[J].J Lipid Res,1988,29(11):1461-1473.
[12] 冯燕娴,石增刚,汤凤英,等.血清载脂蛋白B、载脂蛋白B/载脂蛋白A1值与冠状动脉病变的相关性分析[J].东南大学学报:医学版,2011,30(4):577-580.
[13] Scheffer PG,Teerlink T,Dekker JM,et al.Increased plasma apoli-poprotein C-concentration independently predicts card-i ovascular mortality:The Hoorn Study[J].Clin Chem,2008,54 (8):1325-1330.
[14] Walldius G,Jungner I.ThkeapoB/apoA-I ratio:A strong,new risk factor for cardiovascular disease and atarget for lipid-lowering therapy:A review ofthe eridence[J].J Intem Med,2006, 259(5):493-519.
R589.2R259
:B
10.3969/j.issn.1672-1349.2015.02.042
:1672-1349(2015)02-0245-02
2014-10-17)
(本文编辑郭怀印)
首都医科大学附属北京安贞医院(北京100029)通讯作者:余振球,E-mail:yuzhengiua2@yahoo.cn

