鼠曲草提取物及组分对α-淀粉酶的抑制作用
陆英,邓林燕,朱丽娜,李觅路*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
鼠曲草(Gnaphlium affine D.Don)为菊科鼠曲草属植物,又名佛耳草、清明菜等。鼠曲草提取物具有抗氧化及光防护[1]、抗炎抑菌[2]、抑制醛糖还原酶[3]、保肝[4]、昆虫拒食[5]等作用。鼠曲草能抑制血小板凝集和黏连,预防中风、糖尿病及动脉粥样硬化等疾病的发生[6]。
α–淀粉酶抑制剂是糖苷水解酶抑制剂中的一种,它能有效抑制肠道内唾液及胰淀粉酶的活性,降低食物中淀粉糖类物质的分解吸收,从而起到降低血糖、血脂的作用[7]。在农业上,α–淀粉酶抑制剂能抑制昆虫消化道内α–淀粉酶的活性,刺激昆虫过量分泌消化酶,产生厌食反应,导致昆虫发育不良或死亡。近年来,α–淀粉酶抑制剂在医学及农业上得到了广泛应用。
笔者制备鼠曲草提取物,分离鉴定了鼠曲草提取物中的几个多酚类化合物,并研究了鼠曲草提取物及几个组分对α–淀粉酶的抑制作用及其中的一个组分抑制类型,旨在为鼠曲草资源的进一步开发利用提供理论依据。
1 材料与方法
1.1 供试鼠曲草与试剂
鼠曲草于2012年4月中旬购于湖南吉首。
猪胰α–淀粉酶(SIGMA公司);阿卡波糖(北京拜耳医药保健有限公司);可溶性淀粉(汕头市西陇化工有限公司);葡萄糖(国药集团化学试剂有限公司);二水磷酸氢二钠、氯化钠、正磷酸、3,5–二硝基水杨酸、氢氧化钠、四水酒石酸钾钠等均为国产,分析纯。
1.2 仪器
LC–10AT 高效液相色谱(日本岛津公司),WondasilTMC18色谱柱(250 mm×4.6 mm, 5 μm);HH 数显恒温水浴锅(江苏省金坛市金城国胜实验仪器厂);UV–2600 型紫外可见分光光度计(尤尼柯(上海)仪器有限公司);SK–1 快速混匀器(江苏省金坛市荣华仪器制造有限公司)。
1.3 鼠曲草提取物的制备、分离和鉴定
鼠曲草提取物的制备:新鲜的鼠曲草于室内自然阴干,置60℃烘箱中干燥后粉碎。取鼠曲草粉碎原料200g,用70%乙醇,料液比为1∶30,在80℃回流提取1 h,提取2次,合并提取液,过滤减压浓缩至无醇味,用盐酸调节pH 至3.0,将提取液通过D101 树脂(3 cm×60 cm,450mL)上样,流速4 BV/h,吸附后静置0.5 h,用1 BV 水洗去水溶性杂质,再用4 BV 的60%乙醇以3 BV/h 的流速洗脱,减压浓缩后冷冻干燥,得鼠曲草提取物6.44g,于4℃冰箱中保存。
鼠曲草提取物的分离和鉴定:采用分析型高效液相色谱仪对提取物进行分离鉴定。色谱条件如下:流动相A 泵为0.5% 冰乙酸,B 泵为甲醇。梯度洗脱:0min(70%A 泵+30% B 泵)→15min(55%A泵+45% B 泵)→25min(55%A 泵+45% B 泵)→40min(30%A 泵+70% B 泵),流速为1mL/min,柱温为30℃,进样量为20 μL,检测输出波长328 nm。
1.4 鼠曲草提取物及组分对α–淀粉酶的抑制作用试验
1.4.1 最适酶浓度和最适反应时间的选择
取7支试管,分别加入质量浓度为0.02mg/mL的α–淀粉酶0.1mL,置于37℃水浴中预热10min,加入37℃预热的1%淀粉溶液0.1mL,酶反应开始后准确计时,每间隔1min加入0.2mL DNS终止反应,置沸水中水浴8min,迅速冷却后用5mL蒸馏水稀释,用分光光度计于540 nm处测定吸光值。改变酶浓度(0.04、0.06、0.08、0.1mg/mL),同法测定吸光值,作图确定最适酶浓度和最适反应时间。
1.4.2 鼠曲草提取物及组分对α–淀粉酶的抑制作用试验
取0.1mL质量浓度为0.06mg/mL猪胰α–淀粉酶溶液于试管中,分别加入0.1mL不同浓度(1.0、2.0、3.0、4.0、5.0mg/mL)的样品溶液(以阿卡波糖为阳性对照),混合均匀并置于37℃水浴中预热10min,加入0.1mL 37℃预热的1%淀粉溶液,混匀,反应3min后立即加0.2mL DNS显色剂,置沸水中水浴8min,迅速冷却后用5mL蒸馏水稀释,用分光光度计于540 nm处测定吸光值A1。以空白管为对照,不加抑制剂(以蒸馏水补足),其他与抑制剂管操作相同,测定吸光值A0。背景管为对应浓度的抑制剂溶液,不加酶液(以蒸馏水补足),其他与抑制剂管操作相同,测定吸光值A2,按下列公式计算抑制率。

1.5 2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖抑制类型的鉴别试验
2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖的质量浓度为3mg/mL,底物为1%淀粉溶液,以缓冲溶液替代样品溶液,在不同的酶浓度(0.02、0.04、0.06、0.08mg/mL)下按1.4.2反应测定吸光值。当体系中不存在抑制剂时,酶活性测定的速率直线通过原点;当体系中存在不可逆抑制剂时,酶反应速率直线不通过原点,相当于将原点平行向右移动,若有一定量的可逆性抑制剂时,可得到一条通过原点、斜率低于无抑制剂组的直线。如果2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖是可逆性抑制类型化合物,则进一步进行可逆性抑制类型(竞争型和非竞争型)的鉴别试验。试验操作如下:固定酶质量浓度为0.06mg/mL,2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖质量浓度为3mg/mL,以淀粉溶液为底物,在不同浓度(0.5%、1%、1.5%和2%)的淀粉溶液下,按1.4.2 反应测定吸光值,通过双倒数作图法判断是竞争型或非竞争型抑制类型。两条直线的交点在纵轴为竞争型抑制剂,在横轴上的为非竞争型抑制剂。
2 结果与分析
2.1 鼠曲草提取物的HPLC 分析
鼠曲草提取物的HPLC 色谱图见图1。由图1可见,提取物中含有多个组分,其中含量相对较高的有7个组分,在330 nm 和220 nm 左右有较大吸收,具有明显的酚酸类化合物的紫外吸收特征[9],推测为多酚类化合物。本课题组从鼠曲草提取物中制备分离得到了7个组分,并鉴定出编号为3、5、7 的组分分别为3,5–O–咖啡酰基奎宁酸、3,4–O–咖啡酰基奎宁酸、2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖。

图1 鼠曲草提取物的HPLC 图谱 Fig.1 HPLC chromatogram of the extract from Gnaphalium affine D. Don
2.2 鼠曲草提取物及组分对α–淀粉酶的抑制作用及抑制类型鉴别结果
2.2.1 最适酶浓度和最适反应时间的确定
不同质量浓度的α–淀粉酶在7min内的反应动力学进程曲线见图2。当酶质量浓度等于或低于0.08mg/mL时,在3min之内反应均为线性反应。同时,为利于建立科学的反应动力学方程,使测定的反应速率(以ΔA/min表示)在(0.03~0.25)/min较好[9],因此,选取最佳酶浓度0.06mg/mL,反应时间3min进行酶反应动力学的测定。
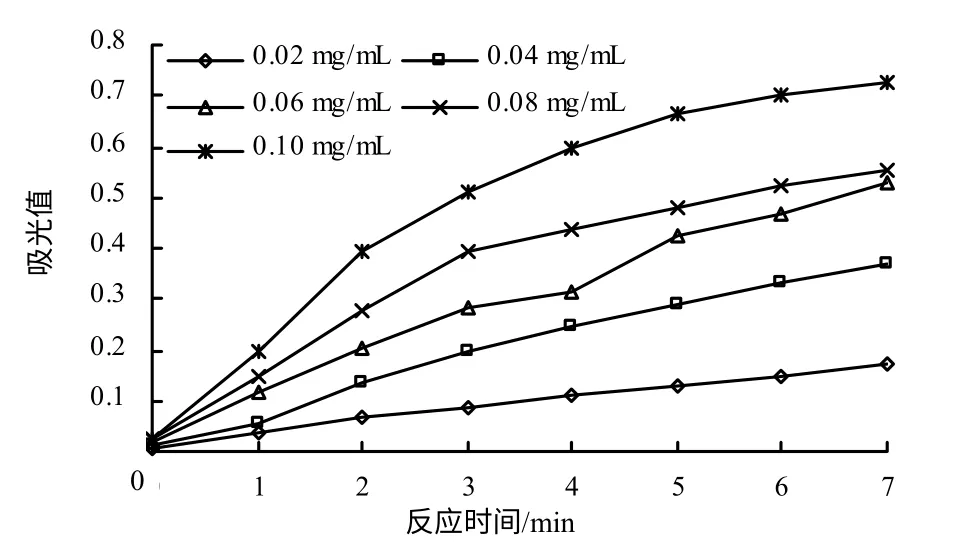
图2 不同质量浓度α–淀粉酶的反应进程曲线 Fig.2 The reaction curve under different concentrations of α- amylase
2.2.2 鼠曲草提取物及3个组分对α–淀粉酶活性的影响
不同浓度的鼠曲草提取物及化合物对α–淀粉酶的抑制活性见表1。在试验浓度范围内,样品对α–淀粉酶活性均有一定抑制作用,随着浓度的增加,抑制能力逐渐增强。当提取物、组分3、5、7及阳性对照阿卡波糖质量浓度为1.67mg/mL时,抑制率分别为32.37%、84.53%、63.07%、71.22%、94.12%。对样品浓度与抑制率进行线性拟合,得到线性方程为:y提=17.265x + 3.237(R2= 0.998 4);y3=45.429x + 9.247(R2= 0.997 6);y5= 34.041x + 6.555(R2= 0.999 4);y7=40.239x + 3.293(R2=0.993);y阿=28.92x + 47.194 (R2=0.988 9)。根据方程计算出提取物及化合物3、5、7对α–淀粉酶的半抑制浓度IC50分别为2.71、0.90、1.28、1.16mg/mL,均高于阿卡波糖的半抑制浓度(0.10mg/mL)。
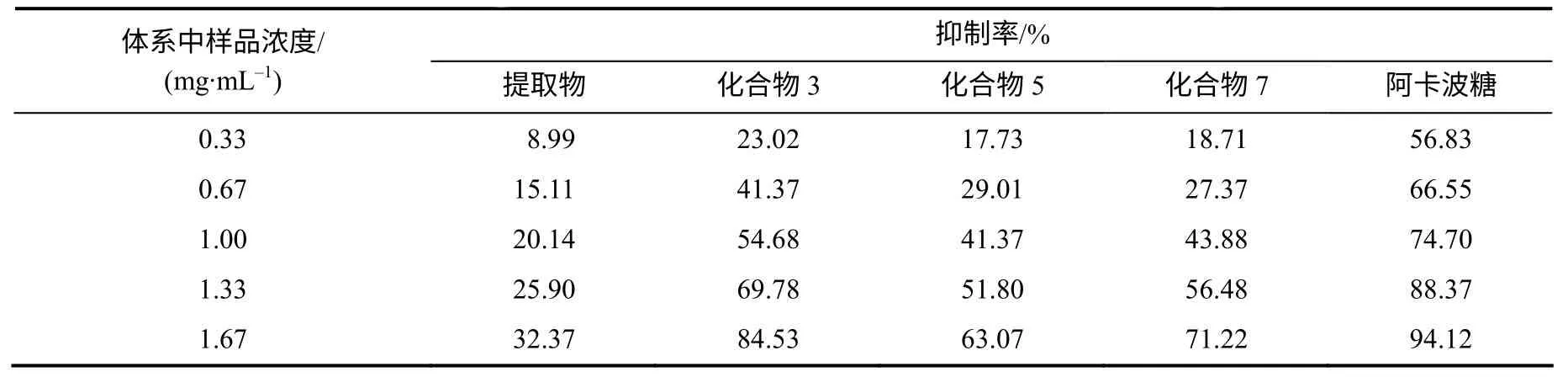
表1 样品对α–淀粉酶的抑制作用 Table 1 Inhibitory effect of coumpounds from Gnaphalium affine D. Don on α-amylase
2.2.3 2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖对α–淀粉酶的抑制类型
不同浓度的α–淀粉酶在有或无2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖存在的条件下的反应速率见图3。无抑制组的速率方程为y=0.488 5x(R2=0.986),抑制组的速率曲线方程为y=0.269 5x (R2=0.987 8),此直线通过原点,由此可知,化合物7对α–淀粉酶的抑制类型是可逆性抑制。由图4可知,抑制组双倒数曲线方程为y=288.91x+ 54.848(R2=0.978 4), 无抑制组双倒数曲线方程为y=145.81x+27.94 (R2=0.997 4),方程直线在横轴上相交,为非竞争性抑制。

图4 化合物7对胰α–淀粉酶的可逆抑制类型的双倒数曲线 Fig.4 Lineweaver-burk plot for inhibition of compound 7 on α–amylase
3 结论
植物多酚由于具有良好的抗氧化和自由基清除活性而受到广泛关注。近些年进一步研究[10–12]表明,一些植物的多酚如蓝莓提取物、茶多酚等具有 较强的α–淀粉酶抑制活性。本试验结果表明,鼠曲草提取物及其中的3个多酚类化合物对胰α–淀粉酶均具有较强的抑制作用,且呈明显的量效关系,但不同化合物的抑制活性存在一定差异,3,5–O–咖啡酰基奎宁酸、3,4–O–咖啡酰基奎宁酸为异绿原酸类化合物的同分异构物,但二者抑制α–淀粉酶的IC50分别为0.90、1.28mg/mL;2´,4,4´–三羟基–6´–甲氧基–查尔酮–4´–O–β–D–葡萄糖是一种查尔酮,它的IC50为1.16mg/mL,同时它为可逆的非竞争性抑制类型。
[1] Aquino R,Morelli S,Tomaino A,et al.Antioxidant and photo-protective activity of a crude extract of Culcitium reflexum H B K leaves and their major flavonoids[J].J Ethnopharmac,2002,79(2):183–191.
[2] 潘明.鼠曲草提取物抑菌作用初步研究[J].四川食品与发酵,2006,42(6):53–56.
[3] Aritomi M,Kawasaki T.Dehydro-para-asebotin,a new chalconeglucoside in the flowers of Gnaphalium affine D.Don[J].Chert Pharm Bull,1974,22(8):1800–1805.
[4] 姜丽君,朴锦花,刘宇,等.鼠曲草提取物对四氯化碳所致小鼠急性肝损伤保护作用[J].时珍国医国药,2008,19(8):1901–1902.
[5] Masanori Morimoto , Sumiko Kumeda , Koichiro Komai.Insect antifeedant flavonoids from Gnaphalium affine D.Don [J].J Agric Food Chem,2000(48):1888–1891.
[6] 王柯慧.寻找预肪糖尿病并发症的天然产物:对醛糖还原酶及血小板聚集的抑制效应[J].国外医学中医中药分册,1996,18(1):49–50.
[7] 吕凤霞,陆兆新.α–淀粉酶抑制剂的研究进展[J].食品科学,2002,23(3):152–154.
[8] 张东明.酚酸化学[M].北京:化学工业出版社,2009:196–197.
[9] 陈曾,刘兢,罗丹.生物化学试验[M].合肥:中国科技大学出版社,1994.
[10] 阮妙芸,张根义.茶多酚对淀粉酶抑制作用的研究[J].安徽农业科学,2008,36(11):4371–4373.
[11] 张冬英,余霜,黄业伟,等.普洱茶对α–淀粉酶抑制作用的影响研究[J].食品工业科技,2009,30(2):77–79.
[12] Mcdougall G J,Shpiro F,Dobson P S,et al.Different polyphenolic components of soft fruits inhibitα-amylase and α-glucosidase[J].J Agric Food Chem,2005,53:2760–2766.

