磁性氧化石墨烯/TiO2 复合材料的制备及光催化性能的研究
罗钰,李娜,黄蓉,王清领,邱斯思,孙洋洋
(长安大学 环境科学与工程学院,陕西 西安 710054)
TiO2颗粒是一类具有良好光学特性和化学稳定性的光催化剂,目前广泛应用于降解水环境中有毒有机物的污染。但随着研究的深入由于纯TiO2光催化存在光子量化效率低的问题[1]和回收困难等突出问题[2-3],因而探索制备易于回收,且在可见光下光催化活性良好的TiO2复合材料具有重大的研究意义。
目前研究者主要通过掺杂、负载、耦合等方法提高其光催化性能。碳材料是一种新型载体。氧化石墨烯也称为石墨氧化物,由碳、氢、氧构成,通过一定的方法可以形成类似于石墨烯的单层结构,是替代石墨烯的最佳材料。其独特的二维表面结构、良好的导电导热性质以及很高的比表面积,可将某些具有催化活性的材料负载在表面使其成为新一类石墨烯功能复合材料。
可作磁性材料的物质有很多,如Ni、Fe、Co、Fe2O3、Fe3O4、Co3O4、MnFe2O4、CoFe2O4等。其中Fe3O4是一种重要的铁氧化体,制备简单来源广泛,在实际中有着重要的用途。此外Fe3O4粒子具有饱和磁化强度高、显著的磁敏等特点[3-8],将其与TiO2复合将大大提高TiO2的回收率。
本课题以氧化石墨烯为载体,利用水热法制备磁性氧化石墨烯/TiO2光催化复合材料。同时以活性艳红染料废水催化降解体系为研究对象,考察不同光催化条件下磁性氧化石墨烯/TiO2对其降解率的影响,为本实验在废水处理等实际应用中提供可靠的理论依据。
1 实验部分
1.1 试剂与仪器
H2SO4、NaNO3、KMnO4、H2O2、H2COOH、HCl、FeC12·4H2O、FeCl3·6H2O、TiO2、NaOH 均为分析纯;天然鳞片石墨;试验用水为去离子水。
HH-4 数显恒温水浴锅;油浴锅;78-1 型加热磁力搅拌器;TDL-40B 离心机;KH-100E 型超声波清洗器;SRJX-4-13ASP 型马弗炉;BL-GHXV 光化学反应仪。
1.2 复合光催化材料的制备
1.2.1 氧化石墨烯/TiO2的制备 将1.0 g 天然鳞片石墨和1.0 g NaNO3加到一定体积的浓硫酸中并控制反应温度为0 ℃,待搅拌均匀缓慢加入8.0 g KMnO4,在35 ℃下反应4 h,加入去离子水,在98 ℃反应15 min,再加入去离子水,冷却至室温后加入H2O2。洗涤干燥得到氧化石墨[4]。氧化石墨在水∶无水乙醇为2∶1 的溶液中超声若干小时得到氧化石墨烯,再加入适量TiO2,强力搅拌20 h,离心分离并用蒸馏水洗涤数次,干燥备用。
1.2.2 Fe3O4的制备 称取4 g FeC12·4H2O 和1 g FeC13·6H2O,在250 mL 烧杯中加25 mL 水使其溶解;然后将此溶液置于55 ℃恒温水浴中加热搅拌,并缓慢滴加一定浓度的NaOH 溶液至体系变为黑色,继续在60 ℃恒温陈化30 min,离心洗涤至中性,60 ℃干燥保存备用。
1.2.3 磁性氧化石墨烯/TiO2复合材料的制备 取10 mL 无水乙醇与10 mL 0.1 mol/L 的Fe3O4磁性液体混合,充分搅拌;缓慢加入氧化石墨烯/TiO21.0 g,搅拌混合均匀;静置24 h,干燥备用。最后将干燥后的样品在氮气保护下500 ℃锻烧,控制升温时间并保温2 h。
1.3 光催化降解活性艳红X-3B
取50 mL 浓度为20 mg/L 的活性艳红X-3B 溶液置于石英管中,添加光催化剂0.02 g,依次放入光反应仪中,暗区磁力搅拌30 min 待反应达到吸附平衡后,用紫外灯照射。每隔15 min取样1 次,离心分离,取上清液用紫外可见分光光度计在λ =538 nm下测定吸光度,并根据活性艳红X-3B 溶液的标准曲线计算其浓度C(mg/L)及降解率D(%)。计算公式为:

其中,C0为活性艳红X-3B 溶液的初始浓度,Ct为活性艳红X-3B 溶液在t 时刻的浓度,用120 min的反应时间来评价其降解率。
2 结果与讨论
2.1 样品的SEM 分析
图(a)、(b)为不同放大倍数下的磁性氧化石墨烯/TiO2SEM 图。

图1 磁性氧化石墨烯/TiO2SEM 图Fig.1 The SEM image of magnetic GO/TiO2
由图1(a)可以清楚的看到氧化石墨烯的不规则片层结构,周围散布有少量的颗粒物,应是未负载到氧化石墨烯上的纳米TiO2和磁性粒子。图1(b)可以看到在氧化石墨烯上均匀分布着细小的纳米TiO2和磁性粒子,说明负载物成功沉积在载体上。
2.2 样品EDS 分析
磁性GO/TiO2的EDS 图,见图2。

图2 磁性GO/TiO2样品的EDSFig.2 EDS image of the magnetic GO/TiO2 composite
由图2 可知,C、O、Fe、Ti 元素的对应峰,图谱中Pt 元素是进行EDS 分析中基质所含的元素。可以看出Fe3O4、TiO2粒子成功的附着在氧化石墨烯上。
2.3 样品的XRD 分析
图3(a)、3(b)、3(c)为磁性氧化石墨烯/TiO2、氧化石墨烯/TiO2、TiO2的XRD 谱图。
氧化石墨在10 处会出现特征峰,由图可以看出各个比例下的复合材料均无此峰,说明氧化石墨已经被完全剥离开,形成了片层结构的氧化石墨烯。图3(c)较图3(a)、3(b)更平滑,无明显出峰;图3(a)较图3(b)的峰更高,面积更窄,说明磁性氧化石墨烯/TiO2比氧化石墨烯/TiO2含晶量低,但晶粒大。负载TiO2后,根据各特征衍射峰的位置,对照PDF 卡,可以判断出负载到了氧化石墨烯表面的TiO2是锐钛矿晶型。这是因为氧化石墨烯的片层结构上存在复合活性位点——带负电荷的含氧基团,使得锐钛矿型的TiO2能成功负载于GO 碳层上。
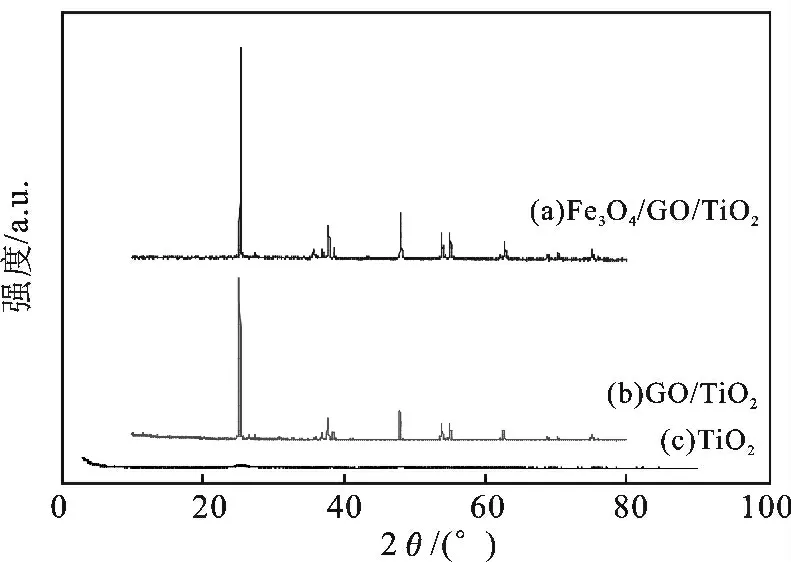
图3 磁性氧化石墨烯/TiO2、氧化石墨烯/TiO2、TiO2的XRD 图Fig.3 XRD patterns of the different products
2.4 样品的红外光谱分析
图4 为Fe3O4掺杂量为1%和3%的样品的红外光谱图。
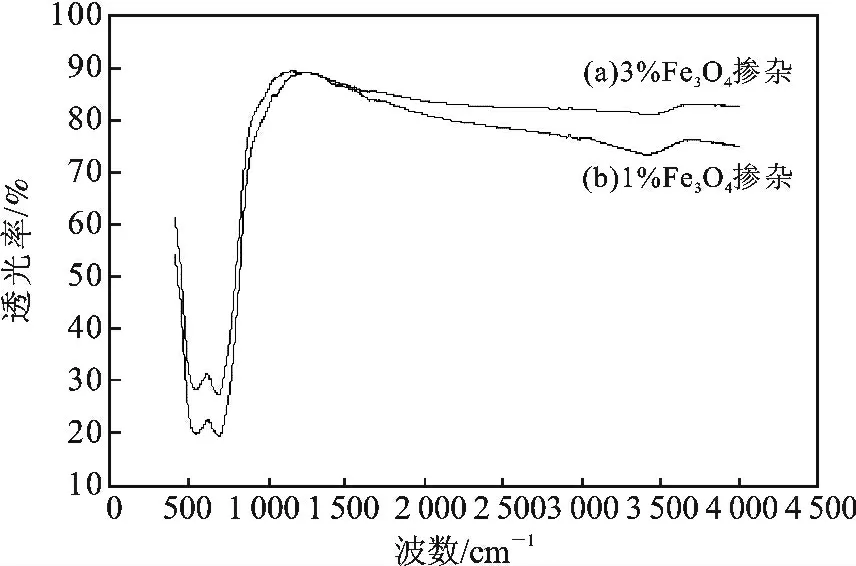
图4 不同Fe3O4掺杂GO/TiO2样品的红外样品分析Fig.4 FTIR analysis of the different products
由图4 可知,在3 000 ~1 500 cm-1为羟基和水的特征振动频率。样品在35 000 cm-1附近有较宽的吸收峰,对应于不饱和的C—H 键的伸缩振动峰。Ti—O—Ti 的振动频率在400 ~600 cm-1。相比于图谱可知,复合材料在掺杂量为3%的样品透光度总大于掺杂量为1%的样品,说明其在相同条件下更容易吸收可见光,从而提高光催化效率。
2.5 紫外-可见漫反射吸收光谱(UV-Vis)分析
图5 为Fe3O4掺杂比例分别为1%和3%时制得磁性样品的UV-Vis 图谱。
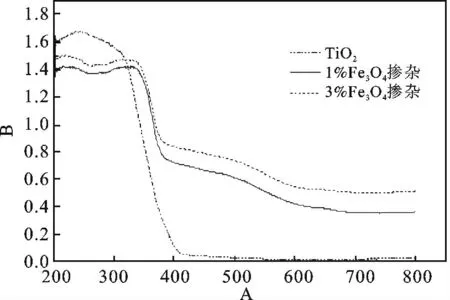
图5 不同Fe3O4掺杂GO/TiO2样品的紫外-可见漫反射吸收光谱分析Fig.5 UV-Vis analysis of the different products
从图可以看出,Fe 离子掺杂使TiO2的吸收光谱发生红移。纯TiO2样品在200 ~390 nm 的紫外光波段有较强的吸收,而在可见光波段几乎没有吸收。这是由于TiO2半导体的禁带宽度为3.2 eV,只能吸收波长<390 nm 的紫外光后激发价带的电子跃迁至导带。而Fe 离子掺杂TiO2后能在半导体价带与导带之间引入一个杂质能级,该能级位于价带以上。中间杂质能级的存在可以使价带的电子先跃迁至杂质能级,再经过二次跃迁至导带,从而价带电子可以被波长>390 nm 的光激发,光催化剂有了利用可见光的能力。
2.6 样品催化性能
2.6.1 光催化反应时间的影响 取20 mg/L 的活性艳红X-3B 模拟废水,和不同比例的磁性氧化石墨烯/TiO2复合材料0.02 g 混合,在紫外光下搅拌,每隔15 min 取上层液离心测吸光度,考察反应时间对光催化降解活性艳红的影响,见图6。
由图6 可知,随着反应时间的延长,在100 min时,反应基本达到平衡,相比于氧化石墨烯/TiO2降解率会高约10%,因为引入适量Fe3O4时,可有效地导走电子,提高电子空穴对的分离效率[6],另外,适量的GO 增加了复合材料的孔径和比表面积,从而提高复合材料的催化效率。但是过量的GO 或是Fe3O4颗粒都会降低其降解效率。因此,确定8%的Fe3O4为最佳掺杂量。
2.6.2 复合光催化剂的对比 取20 mg/L 的活性艳红X-3B 模拟废水,调节其pH 为4,6,8,10,取0.02 g 磁性氧化石墨烯/TiO2复合材料,在紫外光下搅拌,每隔15 min 取上层液离心测吸光度,考察反应时间对光催化降解活性艳红的影响,见图7。
由图7 可知,随着时间的延长活性艳红溶液的浓度都会降低,未添加光催化剂的活性艳红溶液几乎没有降解,说明该溶液稳定性较好,所以光对其的降解可以忽略不计。向活性艳红溶液中投加TiO2、GO/TiO2、磁性GO/TiO2随着时间的延长其降解率都会增大,至趋于平稳。根据光催化活性评价公式计算TiO2、GO/TiO2、磁性GO/TiO2对活性艳红光催化2 h 后的降解率分别为82%,90%,94%。其中,磁性GO/TiO2光催化剂的光催化效果最为明显相比TiO2提高了12%,说明加磁、负载对提高TiO2的光降解率有较大作用。

图7 紫外光下不同样品的光催化性能比较Fig.7 Comparison of different sample on photocatalysis degradation rate
3 结论
利用GO 上负电性的含氧基团对金属离子的静电吸引作用,采用水热法在常温常压下成功制备出磁性GO/TiO2复合材料,材料的SEM、XRD、FTIR、UV-Vis 表征分析显示GO 片层上均匀负载着锐钛矿型的球形颗粒TiO2,粒径约10 nm。Fe3O4添加量为8%时磁性GO/TiO2复合材料的光催化活性最好,可达到94%;磁性GO/TiO2相比于相同条件下纯TiO2的降解率提高了12%。此外加磁的复合材料在回收方式上优于未加磁的材料,不仅解决了分散相TiO2在废水处理中的问题,还提高复合材料的利用效率,经济效益十分可观。
[1] Minero C,Vione D.A quantitative evalution of the photocatalytic performance of TiO2slurries[J]. Appl Catal B:Environ,2006,67:257-269.
[2] Bischoff J L,Fyfe W S.Catalysis,inhibition,and the calcitearagonite problem[Part]. The aragonite-calcitet tansformation[J]. American Journal of Science,1968,266(2):65-79.
[3] Yu Jiaguo,Lei Ming,Cheng Bei.Facile preparation of calciumcarbonate particles with unusual morphologies by precipitation reaction[J]. Journal of Crystal Growth,2004,261(4):566-570.
[4] 王松威,徐盛明,陈菘哲. TiO2/SiO2/-γ Fe2O3-SiO2磁性光催化剂的制备与表征[J]. 催化学报,2005,26(11):938-940.
[5] 陈金媛,彭图治.高效二氧化钛/膨润土复合材料的制备及光催化性能研究[J]. 化学学报,2004,62(20):2093-2097.
[6] 付乌有,杨海滨,刘冰冰.锐钛矿型TiO2/MnFe2O4核壳结构复合纳米颗粒的制备及其光催化特性[J]. 复合物材料学报,2007,24(3):136-140.
[7] 许士洪,冯道伦,李登新.磁载纳米TiO2光催化剂的研究进展[J].无机化学学报,2008,24(5):785-790.
[8] Hummers Jr,William S Offeman,Richard E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society,1958,80(6):1339.

