羊草CDPK基因全长cDNA的克隆及原核表达
崔喜艳,秦思余,刘忠野,高 瑜,蒋载阳,郭继勋
(1 吉林农业大学 生命科学学院,吉林 长春130118;2 东北师范大学 草地研究所/植被生态科学教育部重点实验室,吉林 长春130024)
钙依赖蛋白激酶(Calcium-dependent protein kinase,CDPK)属于Ser/Thr 型蛋白激酶[1].外界逆境信号能够引起细胞质中Ca2+浓度发生变化,产生钙信号,激活相应的CDPK 组分,CDPK 催化底物发生磷酸化作用,通过特定的通路调控下游基因表达,从而调控生物生理生化代谢、水分代谢和离子跨膜运输以及激素调控等对信号响应的生物学过程[2-4].目前,已从小麦、玉米、水稻等作物中分离得到CDPKs 基因[5-7],并证实该基因在植物受到外界逆境胁迫下表达量发生变化.研究表明,植物在非生物胁迫过程中,CDPK 在逆境信号转导过程中具有重要的作用[8].
由于一系列人为因素的干扰及过度放牧,使得草地盐碱化、沙漠化面积日益扩大[9].羊草Leymus chinensis 又名碱草,隶属禾本科赖草属,是欧亚大陆东部草甸草原及干旱草原上重要建群种之一[10].在中国主要分布于东北、华北等地区,羊草本身具有较强的耐盐碱、干旱等特性[11].目前,关于羊草CDPK基因相关的研究报道较少,羊草对盐碱的耐受性及适应不同逆境的分子机制还不明确.本试验对羊草CDPK 基因进行克隆及原核表达,不仅可以丰富禾本科植物CDPK 基因的信息,而且为今后探讨羊草适应盐碱生境分子机制提供理论基础.
1 材料与方法
1.1 材料
1.1.1 植物材料及培养 供试材料为羊草,2011年种子取自吉林省长岭县东北师范大学草原生态定位研究站.盆栽砂培,光照培养箱培养,白天(26.0±0.5)℃,夜晚(15.0 ±0.5)℃,照光12 h,每天08:00—08:30浇水50 mL,出苗后每天浇1 次Hoagland 营养液[12],取生长4 周的羊草叶片为试验材料.
菌株和质粒:大肠埃希菌Escherichia coli DH5-α、BL21(DE3)及载体pET30a(+)为吉林农业大学生命科学学院生物化学与分子生物学研究室保存,pMD18-T 购于大连宝生物工程有限公司.
试剂和酶类制剂:RACE 试剂盒购自Clontech 公司;Trizol 购自Gibco 公司;反转录酶AMV、异丙基硫代半乳糖苷(IPTG)均购于Promega 公司,所有限制性内切酶NdeⅠ、XhoⅠ、Ex-Taq 酶、T4 DNA 连接酶和DNA 相对分子质量标准、蛋白质相对分子质量标准均购于大连宝生物工程有限公司,琼脂糖凝胶DNA 回收试剂盒、质粒提取试剂盒为AxyGEN 公司产品.其他试剂均为国产分析纯.
1.1.2 引物设计 应用Primer5.0 软件,根据NCBI中已经发表禾本科的CDPK 基因cDNA 序列,在基因保守区设计1 对简并引物,扩出中间片段,经测序验证后,重新设计引物,通过5'RACE 和3'RACE 分别获得5'和3'端未知序列,重叠序列拼接后重新设计带酶切位点的引物.引物由上海生工生物工程有限公司合成,引物纯度为PAGE 级.本研究所用引物列于表1.
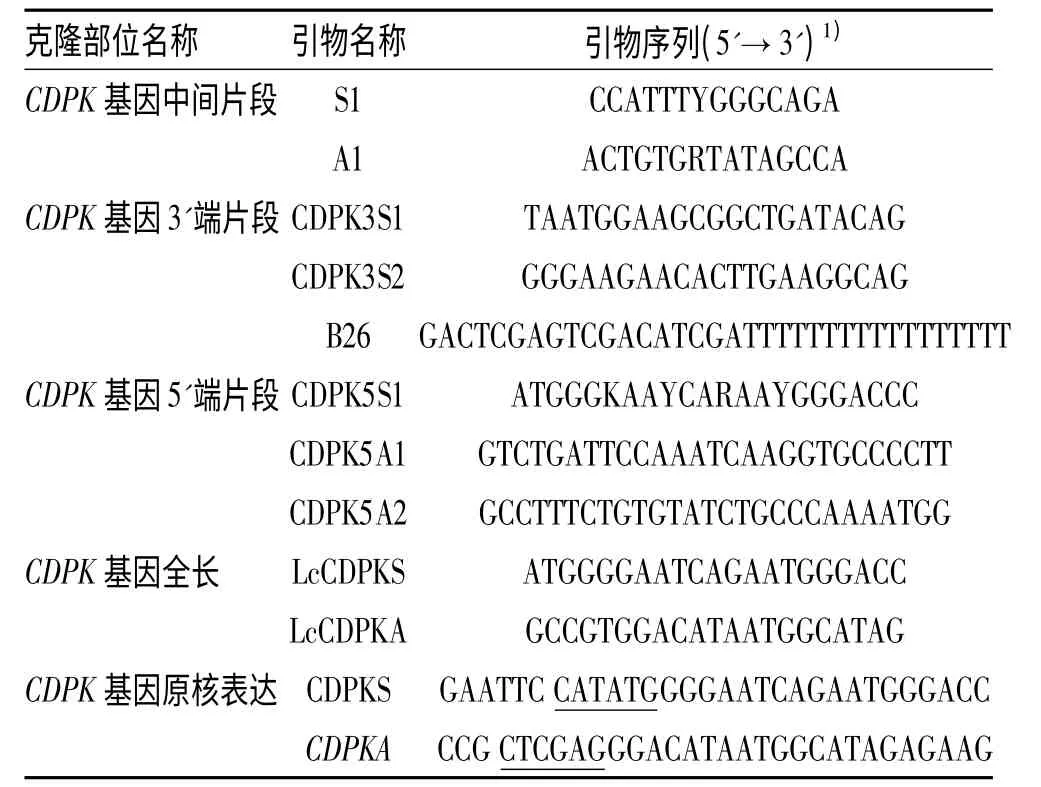
表1 羊草CDPK 基因克隆中所用引物Tab.1 Primers used in cloning of CDPK gene from Leymus chinensis
1.2 方法
1.2.1 羊草叶片总RNA 的提取 取羊草叶片1 g在研钵(加入液氮)中研磨成粉,迅速放入1.5 mL 无RNase 的离心管中,加入1 mL Trizol 混匀,其余步骤按试剂盒说明书操作,-70 ℃条件冰柜保存总RNA.
1.2.2 羊草cDNA 的合成 按Promega 试剂盒操作,取2.5 μL 的羊草总RNA,加入OligdT 2.0 μL,焦碳酸二乙酯(DEPC)处理H2O 5.5 μL,70 ℃5 min后冰浴5 min;再依次加入下列其余成分:5×AMV Buffer 5.0 μL,10 mmol·L-1dNTP 2.5 μL,RNasin 0.5 μL,AMV 0.5 μL,DEPC 处理H2O 6.5 μL,42 ℃条件60 min,95℃条件5 min.反应结束后获得羊草cDNA 液,-20 ℃条件冰柜保存.
1.2.3 羊草CDPK 基因的克隆 中间片段的扩增:以合成的羊草cDNA 液为模板,进行RT-PCR 反应,50 μL 反应体系,94 ℃预变性5 min;94 ℃变性30 s,45 ℃退火40 min,72 ℃延伸2 min,30 次循环;72 ℃延伸10 min.利用凝胶DNA 回收试剂盒将PCR 产物中的目的条带回收纯化,连接到pMD18-T 载体上,转化大肠埃希菌DH5-α 感受态细胞,挑选阳性克隆经PCR 和酶切鉴定后,送至上海生工生物工程有限公司测序.
3'RACE 扩增:以合成cDNA 为模板,用CDPK3S1 和CDPK3S2 分别与B26 为引物,进行嵌套PCR,50 μL 反应体系,第1 次退火温度66 ℃,以第1次PCR 产物为模板,第2 次退火温度58 ℃;回收,连接,转化,鉴定,测序.
5'RACE 扩增:同3'RACE 扩增,利用CDPK5S 分别与CDPK5A1 和CDPK5A2 进行嵌套PCR,50 μL反应体系,第1 次退火温度56 ℃,以第1 次PCR 产物为模板,第2 次退火温度59 ℃;回收,连接,转化,鉴定,测序.
采用生物学软件DNAman 对测定的序列进行分析,发现中间片段测序结果与5'RACE 扩增结果有27 个碱基重叠,与3'RACE 有64 个碱基重叠.电子合并后,获得拼接全长cDNA 序列.在该cDNA 序列开放阅读框两端设计引物LcCDPKS 和LcCDPKA,以cDNA 为模板,扩增出完整的羊草CDPK cDNA 的全长序列,将之命名为:Lc-CDPK;重新设计上、下游分别带NdeⅠ和XhoⅠ酶切位点的引物CDPKS 和CDPKA,用于构建原核表达重组载体.
1.2.4 原核表达载体pET-30a-CDPK 的构建与鉴定试验过程及方法均参照文献[13].
1.2.5 重组质粒在大肠埃希菌中的诱导表达及SDS-PAGE 电泳 试验过程及方法均参照文献[14].
2 结果与分析
2.1 羊草叶片总RNA 的提取
Trizol 法提取羊草叶片总RNA,用10 g·L-1琼脂糖凝胶进行变性电泳,结果(图1)显示,有3 条电泳带,从上到下依次为28S rRNA、18S rRNA 和5S rRNA,条带清晰.表明提取的RNA 完整性较好,浓度比例符合要求;经紫外分光光度计检测,D260nm/D280nm为2.009,说明总RNA 纯度高,可用于反转录等后续试验.
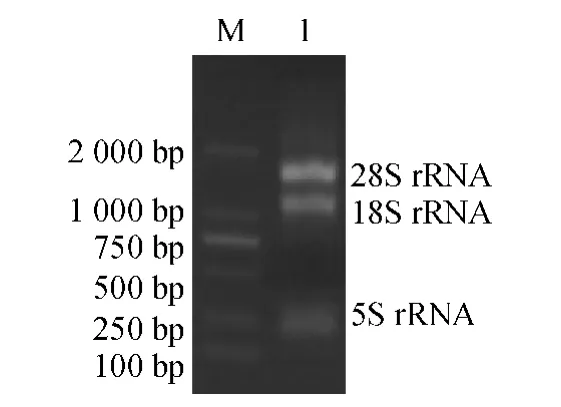
图1 总RNA 的电泳结果Fig.1 The electrophoresis of total RNA
2.2 羊草CDPK 基因的克隆与分析
2.2.1 羊草CDPK 基因的克隆 中间片段的扩增:根据NCBI 中已经发表禾本科的CDPK 基因的氨基酸序列,在基因保守区设计1 对简并引物S1、A1,以羊草叶片总RNA 为模板,以OligdT 为反转录引物,合成单链cDNA,利用简并引物S1、A1 进行RT-PCR反应,获得590 bp 的目的片段(图2).
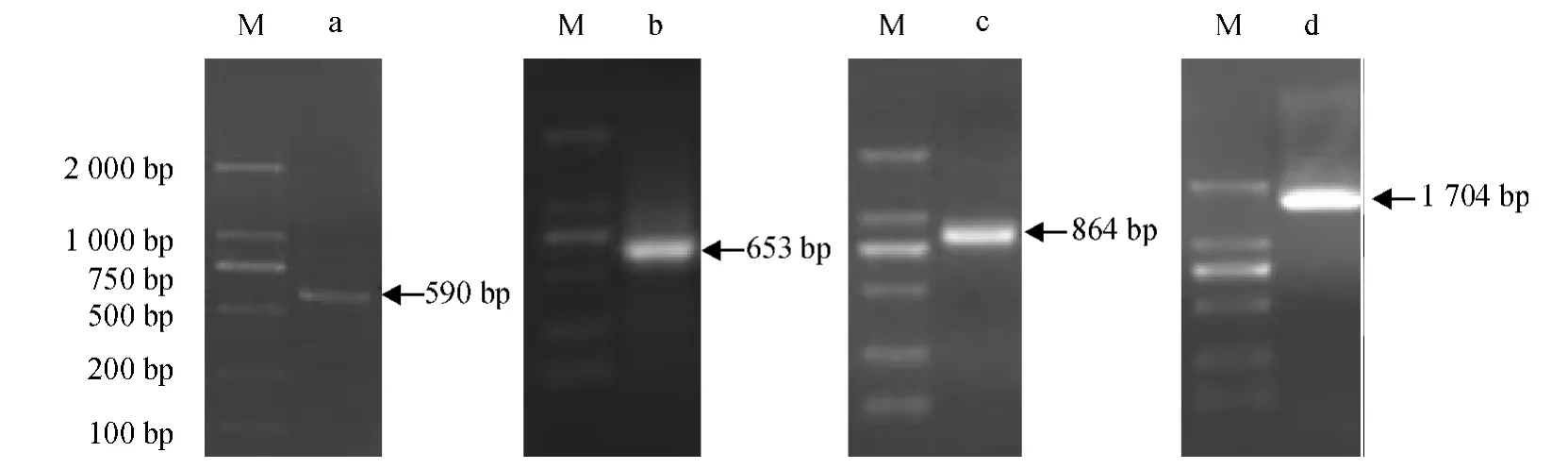
图2 Lc-CDPK 基因PCR 扩增结果Fig.2 The PCR amplification of Lc-CDPK gene
3'RACE 扩增:以合成的单链cDNA 为模板,利用CDPK3S1 和CDPK3S2 分别与B26 进行嵌套PCR,得653 bp 片段;5'RACE 扩增:以合成的单链cDNA 为模板,利用CDPK5S 分别与CDPK5A1 和CDPK5A2 进行嵌套PCR,得864 bp 片段;将3 次测序的片段用软件分析,经重叠序列拼接后,在该cDNA序列开放阅读框两端设计带酶切位点的引物,扩增出羊草CDPK 基因全长cDNA 片段1 704 bp,见图2.
2.2.2 羊草CDPK 基因的生物信息学分析 Prot-Param(http://us.expasy.org/tools/protparam.html)在线分析,对所推演的氨基酸序列进行分析,结果可知:CDPK 基因编码的氨基酸序列氨基酸数548 个,相对分子质量为61349,理论等电点5.34,正、负电荷残基总数分别是65 和83,在组成CDPK 蛋白的20种编码氨基酸中亮氨酸所占比例最高,达到9.9%,而色氨酸所占比例最低,仅为0.9%.
采用SMART(http://smart.embl-heidelberg.de/)分析,结果(图3)得知:第81~339 个氨基酸序列构成具有丝氨酸/苏氨酸蛋白激酶催化活性的S-TKc 结构域,第386~414、422~450、458~486、492~520 这4 段氨基酸序列均为EF 手型结构域.这与其他种类禾本科植物中CDPK 蛋白激酶结构域有相同之处[13].
根据SignalP4.1 server 对所预测的氨基酸序列进行分析,该蛋白无信号肽;多肽链N 端起始氨基酸序列为“MGNQNGT”,该序列是具有豆蔻酰化和棕榈酰化作用所必需的保守序列MGx xC(S/ Q )x xT[15-16],推测其可能定位于膜上,与SignalP4.1 server 预测结果一致.

图3 Lc-CDPK 基因的核苷酸及氨基酸序列Fig.3 The nucleotides sequence and amino acids sequence of Lc-CDPK gene
2.3 不同物种CDPK 基因的相似性比对
使用DNAman 软件对克隆所得到的羊草CDPK基因与NCBI 数据库中的4 种禾本科主要作物CDPK1 基因进行对比,开放阅读框内核苷酸相似性分别为:高粱82%,水稻75%,玉米67%,与小麦CDPK1 基因的相似性最高,相似度为96%(图4).同时将克隆结果与小麦CDPK1 基因家族其他CDPKs 基因进行比对,并构建系统进化树(图5),比对结果仍旧表明与小麦CDPK1 基因相似性最高.由此可知,从羊草中克隆的序列为CDPK1 基因,而非CDPK 基因家族的其他成员.
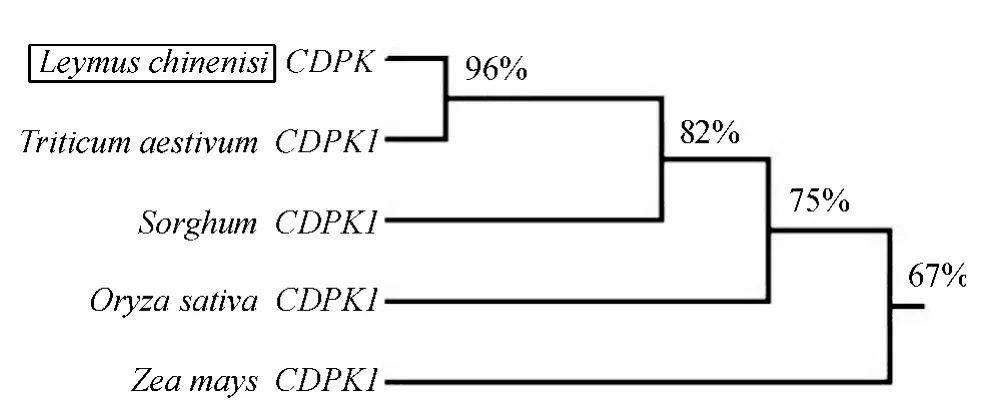
图4 Lc-CDPK 基因与4 种禾本科作物CDPK 基因编码框相似性关系分析Fig.4 Similarity analysis of gene ORF between Lc-CDPK gene and CDPK1 genes of four Graminaceous crops
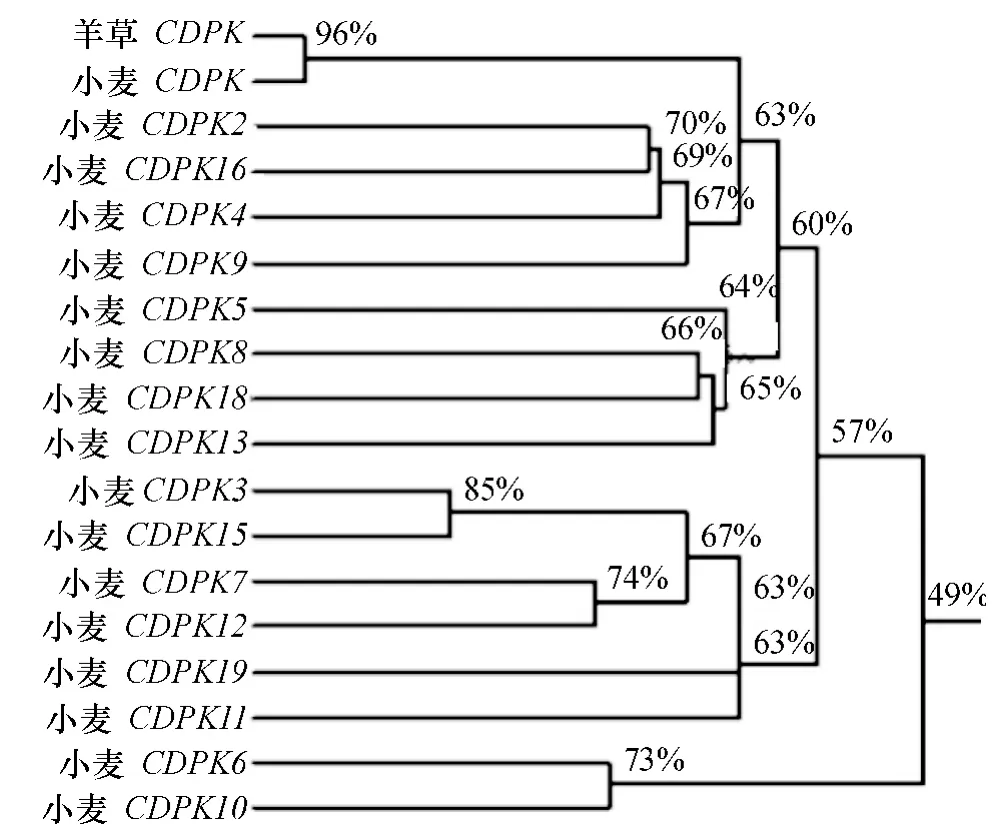
图5 Lc-CDPK 基因与小麦17 个CDPK 基因编码框相似性分析Fig.5 Similarity analysis of gene ORF between Lc-CDPK gene and seventeen CDPK genes of wheat
2.4 原核表达载体的构建
将目的基因Lc-CDPK 和pET-30a(+)分别进行NdeⅠ、XhoⅠ双酶切并切胶回收目的片段,将两者16℃过夜连接,连接产物42 ℃条件下热激转化E.coli BL21 感受态细胞中,通过Kan 进行抗性筛选,获得阳性克隆菌落;挑取单菌落提取质粒并进行PCR 和双酶切验证(图6).结果证明原核重组质粒pET-30a-CDPK 构建成功.将鉴定正确的阳性克隆菌的重组质粒转化E.coli BL21 感受态细胞,用于诱导融合蛋白的表达.
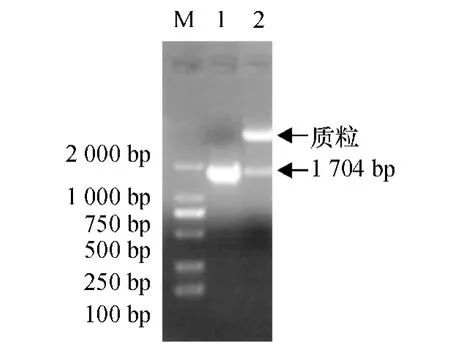
图6 重组质粒pET-30a-CDPK 的PCR 及双酶切验证结果Fig.6 The verification of recombinant plasmid pET-30a-CDPK by PCR and restriction enzyme digestion
2.5 融合蛋白SDS-PAGE 电泳
将含有pET-30a-CDPK 的E.coli BL21 阳性单菌落过夜扩大培养,当菌液D600nm达到0.6 左右时,加IPTG(终浓度为1 mmol·L-1)诱导培养,诱导7 h.每隔1 h 取1 mL 菌液,共取7 次,用123.2 g·L-1分离胶SDS-PAGE 进行电泳分析.从图7 可看出,经IPTG 诱导的细菌可大量表达相对分子质量61 350的特异蛋白,而未经IPTG 诱导的细菌(对照)不表达或表达量很少.表达产物相对分子质量与预计理论值相符.利用BandScan5.0 软件分析后发现,IPTG 诱导7 h 的蛋白含量最高,表达量可占菌体总蛋白的49.1%.证明原核表达载体构建正确,核苷酸序列无移码现象.
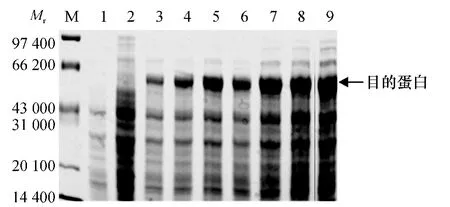
图7 融合蛋白的SDS-PAGE 分析Fig.7 SDS-PAGE analysis of fusion protein
3 讨论
1982年Hetherington 等[17]在豌豆中首先报道了CDPKs,自Harper 等[18]首次克隆了大豆CDPK 基因以后,人们对CDPK 基因的研究日益关注,迄今已在动物、植物及原生生物克隆了近百种CDPK 基因[19].CDPKs 是一个多基因家族,其中拟南芥有34 个CDPKs[20].CDPKs 在植物整个生长发育过程中,几乎参与所有生理生化代谢过程,如调节离子和水分运输[21],调节保卫细胞和气孔运动[22],参与植物碳氮代谢[23],参与对植株生长和发育的调控[24],参与植株激素代谢和激素信号的转导[25],对病原菌侵害的响应与防御[26],以及对环境胁迫的应答和抗逆[27].
本研究从耐盐碱的禾本科牧草——羊草中成功克隆了CDPK 基因,将其命名为Lc-CDPK,对Lc-CDPK 分析后可知:全长cDNA 序列为1 704 bp,包括1个1 647 bp 的开放阅读框,编码548 个氨基酸,第81~339 个氨基酸序列构成具有丝氨酸/苏氨酸激酶催化活性的S-TKc 结构域,有4 个保守的EF 手性结构,EF 手型结构域是钙结合基序;钙离子结合诱导的EF 手基序的构象变化,从而导致靶蛋白的活化或失活[13].核苷酸序列与NCBI 数据库中的4 种禾本科主要作物小麦、高粱、水稻和玉米CDPK1 核苷酸的相似性均较高,与小麦CDPK1 相似性高达96%.说明从羊草中克隆出的CDPK 基因为CDPK1.本试验结果为CDPKs 家族增加了新成员.小麦CDPK1 基因对低磷逆境产生了应答,通过上调表达,参与小麦植株对低磷逆境信号的转导、响应或抵御过程[5];当植物或细胞受到外部信号刺激时,胞质内Ca2+浓度发生变化,经Ca2+的受体蛋白、钙调素(CaM)和CDPK 基因等协同完成特定信号的传递[4];小分子渗透调节物质的大量积累及抗氧化酶系统的调节是羊草群落对不同盐碱化草地适应的重要生理响应[28].说明一定盐碱条件的生境,羊草均能生长,CDPK 基因应答的Ca2+调解机制亦可能是主要原因.
本试验构建了重组质粒pET-30a-CDPK,在原核生物中进行诱导表达,SDS-PAGE 分析看出,经IPTG诱导的细菌可大量表达相对分子质量61 350 的特异蛋白,而未经IPTG 诱导的细菌(对照)不表达或表达量很少.表达产物大小与预计理论值相符,表明从羊草中克隆的CDPK 基因核苷酸序列正确,无移码现象.目前,SDS-PAGE 纯化融合蛋白的结果已作为抗原,正在用于进一步有关羊草CDPK 基因细胞的定位研究.羊草CDPK 基因的克隆及在原核生物中成功的诱导表达,为今后克隆羊草中其他CDPKs 基因提供试验方法,为构建真核表达载体研究羊草CDPK 基因的功能,以及羊草适应盐碱生境分子机制等研究提供理论依据.
[1]CHENG S,WILLMANN M R,CHEN H,et al.Calcium signaling through protein kinases:The Arabidopsis calcium-dependent protein kinase gene family[J].Plant Physiol,2002,129(2):469-485.
[2]倪天华,魏幼璋.钙依赖型蛋白激酶(CDPKs)在植物中的生理功能[J].西北农林科技大学学报:自然科学版,2002,30(6):241-245.
[3]陈莎莎,兰海燕.植物对盐胁迫响应的信号转导途径[J].植物生理学报,2011,47(2):119-128.
[4]刘贯山,陈珈.钙依赖蛋白激酶(CDPKs)在植物钙信号转导中的作用[J].植物学通报,2003,20(2):160-167.
[5]LI A L,ZHU Y F,TAN X M,et al.Evolutionary and functional study of the CDPK gene family in wheat(Triticum aestivum L.)[J].Plant Mol Biol Rep,2008,66(4):429-443.
[6]SIAN R,SIMON G.Calcium-dependent protein phosphorylation may mediate the gibberellic acid response in barley aleurone[J].Plant Physiol,1998,116(2):765-776.
[7]HASHIMOTO J,HIRABAYASHI T,HAYANO Y,et al.Isolation and characterization of cDNA clones encoding cdc2 homologues from Oryza sativa:A functional homologue and cognate variants[J].Mol Gen Genet,1992,233(1/2):10-16.
[8]秘彩莉,郭光艳,齐志广,等.植物盐胁迫的信号传导途径[J].河北师范大学学报:自然科学版,2007,31⑶:375-380.
[9]郭坚,王涛,薛娴,等.松嫩沙地荒漠化现状和原因[J].干旱区资源与环境,2007,21(5):99-103.
[10]杨允菲,刘庚长,张宝田.羊草种群年龄结构及无性繁殖对策的分析[J].植物学报,1995,37(2):147-153.
[11]王萍,殷立娟,李建东.中性盐和碱性盐对羊草幼苗胁迫的研究[J].草业学报,1994,3(2):37-43.
[12]石德成,盛艳敏,赵可夫.不同盐浓度的混合盐对羊草幼苗的胁迫效应[J].植物学报,1998,40(12):1136-1142.
[13]刘忠野.羊草CDPK 基因的克隆及功能分析[D].长春:吉林农业大学,2013.
[14]刘晓庆,崔喜艳,丁志鑫,等.大豆rbcL 基因的克隆、序列分析和原核表达[J].中国油料作物学报,2011,33(3):226-230.
[15]DAMMANN C,ICHIDA A,HONG B,et al.Subcellular targeting of nine calcium-dependent protein kinase isoforms from Arabidopsis[J].Plant Physiol,2003,132(4):1840-1848.
[16]LU S X,HRABAK E M .An Arabidopsis calcium-dependent protein kinase is associated with the endoplasmic reticulum[J].Plant Physiol,2002,128(3):1008-1021.
[17]HETHERINGTON A,TREWAVAS A.Calcium-dependent protein kinase in pea shoot membranes[J].Febs Lett,1982,145(1):67-71.
[18]HAPRER J F,SUSSMAN M R,SCHALLER G E,et al.A calcium-dependent protein kinase with a regulatory domain similar to calmodulin[J].Science,1991,252(5008):951-954.
[19]太帅帅,刘贯山,孙玉合,等.普通烟草CDPK 基因家族的克隆及表达分析[J].中国农业科学,2009,42(10):3600-3608.
[20]ALICE C H.Calcium-regulated protein kinases of plants[J].Grav Space Biol Bull,2003,16(2):83-90.
[21]HUANG J Z,HARDIN S C,HURBER S C.Identification of a novel phosphorylation motif for CDPKs:Phosphorylation of synthetic peptides lacking basic residues at P-3/P-4[J].Arch Biochem Biophys,2001,393(1):61-66.
[22]PEI Z M,WARD J M,HARPER J F,et al.A novel chloride channel in Vicia faba guard cell vacuoles activated by the serine/threonine kinase,CDPKs[J].EMBO J,1996,15(23):6564-6574.
[23]JOHNSON C H,KNIGHT M R,KONDO T,et al.Circadian oscillations of cytosolic and chloroplastic free calcium in plants[J].Science,1995,269(5232):1863-1865.
[24]SANO T,HIGAKI T,HANDA K,et al.Calcium ions are involved in the delay of plant cell cycle progression by abiotic stresses[J].Febs Lett,2006,580(2):597-602.
[25]王喜庆,武维华.植物细胞钙依赖型蛋白激酶参与ABA信号转导过程的实验证据[J].植物学报,1999,41(5):556-559.
[26]ROMEIS T,PIEDRAS P,JONES J D G.Resistance gene dependent activation of a calcium-dependent protein kinase in the plant defense response[J].Plant Cell,2000,12(5):803-815.
[27]ZHANG M,LIANG S,LU Y T.Cloning and functional characterization of NtCpK4,a new tobacco calcium-dependent protein kinase[J].Biochim Biophys Acta,2005,1729(3):174-185.
[28]崔喜艳,刘忠野,胡勇军,等.不同盐碱草地羊草叶片渗透调节物质含量和抗氧化酶活性的比较[J].中国草地学报,2012,34(5):40-46.

