烟草绿原酸合成关键基因NtHQT1的克隆及表达分析
武明珠,许亚龙,李锋,魏攀,王中,罗朝鹏,王燃,张剑锋,林福呈,杨军
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
烟草绿原酸合成关键基因NtHQT1的克隆及表达分析
武明珠,许亚龙,李锋,魏攀,王中,罗朝鹏,王燃,张剑锋,林福呈,杨军*
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
绿原酸(Chlorogenic acid,CGA)是烟叶中含量最高的多酚类物质,羟基肉桂酰辅酶A奎尼羟基肉桂转移酶(Hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase,HQT)是植物绿原酸合成代谢途径中的关键酶。为研究HQT基因在烟草绿原酸合成中的作用机制,通过同源克隆技术从烟草中克隆到一个新的HQT基因,命名为NtHQT1。生物信息学和激素处理后基因表达模式分析结果表明:NtHQT1 cDNA全长1 305 bp,编码435个氨基酸,NtHQT1定位在细胞质中,属于疏水性蛋白,其二级结构主要是螺旋和无规则卷曲;茉莉酸甲酯(Methyl jasmonate,MeJA)、生长素(3-Indoleacetic acid,IAA)、独角金内酯类似物(GR24)、细胞分裂素(6-Benzylaminopurin,6-BA)和赤霉素(Gibberellic acid,GA)能明显上调NtHQT1基因的表达,脱落酸(Abscisic acid,ABA)对基因表达没有明显作用,预示NtHQT1基因在烟草生长发育和抗病等生物学过程中发挥重要作用。
烟草;绿原酸;NtHQT1;克隆;序列分析;表达分析
绿原酸(Chlorogenic acid,CGA),又名咖啡单宁,具有抗炎、抗菌、抗病毒、抗抑郁等药理学作用[1-3]。绿原酸可以被小肠直接吸收,或是经过大肠的菌群水解后变成咖啡酸(Caffeic acid)[4-6],咖啡酸和绿原酸均具有较强的抗氧化能力[7]。有研究发现绿原酸清除自由基的能力明显高于经典的抗氧化剂抗坏血酸[8-9]。绿原酸在一些中药材如金银花、杜仲等中含量较高,也是烟叶中含量最高的多酚类化合物,约占总多酚含量的70%~90%[10]。
绿原酸是植物体在有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物,其合成受多种因素的影响。有研究发现光照强度影响绿原酸在植物叶片中的积累,冬季生长在光照充足条件下的叶片中绿原酸含量较背阴条件下明显增高;夏季叶片中的绿原酸含量则比冬季增高一倍[8]。另外还发现一些病原菌侵染能提高植物绿原酸含量,当烟草遭受根串珠霉菌(Thielaviopsis basicola)侵染时根和叶中的绿原酸含量明显增高[11]。稻瘟病菌丝和培养滤液中的提取物处理水稻和水稻愈伤组织都能诱导绿原酸的生物合成[12],这可能与绿原酸能提高植物的抗病性有关。此外有研究发现植物在缺硼条件下绿原酸的合成显著增加[13]。羟基肉桂酰辅酶A奎尼羟基肉桂转移酶(Hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase,HQT)是绿原酸合成代谢途径的关键酶。敲除HQT基因能够显著降低烟草绿原酸含量,在番茄中HQT基因过表达,则绿原酸含量明显上升[14]。目前对于烟草绿原酸的合成代谢途径研究较少,为此,在普通烟草红花大金元中克隆到了NtHQT1基因,对其进行了相关生物信息学分析,并研究了不同激素处理对基因表达的影响,旨在为揭示烟草绿原酸的合成代谢途径提供依据。
1 材料与方法
1.1 烟草材料
普通烟草(Nicotiana tabacum)红花大金元种植于国家烟草基因研究中心的人工气候温室,采集移栽后4周的烟草幼苗用于HQT1基因克隆。另选取移栽后4周的烟苗分别用10µmol/L脱落酸(Abscisicacid,ABA)、50µmol/L赤霉素(Gibberellic acid,GA)、100µmol/L茉莉酸甲酯(Methyl jasmonate,MeJA)、10µmol/L独角金内酯类似物(GR24)、5µmol/L 3-吲哚乙酸(3-Indoleacetic acid,IAA)和10µmol/L 6-苄氨基腺嘌呤(6-Benzylaminopurin,6-BA)激素溶液对烟苗进行喷雾处理;对照则采用等体积的双蒸水(CK)。均匀喷洒烟草叶片,以叶片均匀附着一层小水珠为准。每处理设置3个独立的重复,每重复为3株长势一致的烟苗;每种激素处理后单独放置,避免激素间产生交叉作用,在激素处理8 h后采样用于基因表达模式分析。
1.2 烟草总RNA提取和cDNA第一链的合成
用EASYspin植物RNA快速提取试剂盒(北京艾德来生物科技有限公司)提取不同处理烟草总RNA,具体方法参照试剂盒说明书。利用DNA酶(DNase I)去除RNA中残留的少量DNA。提取出的烟草不同处理的RNA,采用NanoDrop2000超微量分光光度计(赛默飞世尔科技有限公司)测定OD230、OD260和OD280值并计算浓度,同时用2100生物分析仪(美国安捷伦公司)测定RNA的完整性。选择纯度高、完整性好的总RNA用于cDNA第Ⅰ链的合成,具体步骤参照PrimeScript®Reverse Transcriptase([宝生物工程(大连)有限公司])试剂盒说明书。
1.3 基因全长克隆
以烟草及茄科植物马铃薯和番茄的HQT全长cDNA序列为探针,在NCBI BLAST数据库中进行BLAST分析,对查找到的普通烟草EST序列进行拼接比对。然后再用拼接的基因序列在GeneBank中进行比对,根据与其他同源物种的相似度和一致性确定片段的正确性和编码序列的完整性。并根据拼接序列设计全长引物,上游引物:5′-ATGAGGATCAATATTAAGGAAT-3′,下游引物:5′-AAATTCATACAAGTACTTCTCA-3′,并由北京六合华大基因科技有限公司合成。PCR反应体系25µL,包括ddH2O 9.7 μL、PremixTaq 12.5 μL、上游引物0.4 μL、下游引物0.4 μL和cDNA 2 μL。反应程序:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸60~90 s,30个循环;72℃延伸10 min,4℃保温。
用1.2%琼脂糖凝胶电泳检测PCR扩增产物,琼脂糖凝胶DNA回收试剂盒[宝生物工程(大连)有限公司]回收目的片段;用纯化回收的目的片段连接pMD19-T载体,4℃过夜,并转化感受态细胞DH5α,挑取白色单菌落,37℃控温摇床摇菌12 h左右(200 r/min);以微量菌液为模板进行PCR验证是否为阳性克隆。含有目的片段的重组质粒由北京六合华大基因科技有限公司测序。
1.4 生物信息学分析
对获得的HQT1基因序列用ProtParam软件(http://web.expasy.org/protparam/)分析NtbHLH93蛋白中各种氨基酸含量(质量分数),并预测理论分子量和等电点;TMHMM Server(http://www. cbs.dtu.dk/services/TMHMM-2.0/)分析其跨膜结构域;SingnalP(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白信号肽;PredictNLS(http://www.psort.org/)分析蛋白细胞核定位信息;通过MEME(Multiple Expectation for Motif Elicitation)在线软件(http:// meme.nbcr.net/meme/cgi-bin/meme.cgi)寻找潜在的基序(Motif);采用ProtParam在线分析软件分析烟草NtHQT1蛋白序列;用SMART在线分析软件(http://smart.embl-heidelberg.de/)分析NtbHLH93蛋白的保守结构域;使用NCBI Blast在线工具进行核酸及氨基酸序列的同源性比对,并搜索下载相关序列;用Clustal W软件对烟草、拟南芥、水稻、番茄、土豆等植物的bHLH93序列进行比对,采用MEGA 5.2软件,通过邻接法(Neighbor-joining)构建系统进化树;用PSIPRED软件(http://bioinf.cs. ucl.ac.uk/psipred/)预测NtbHLH93蛋白质的二级结构;用在线软件SWISS-MODEL(http://swissmodel. expasy.org/)分析NtbHLH93蛋白的三级结构。
1.5 荧光定量PCR分析
根据克隆到的基因序列设计qRT-PCR引物:上游引物:5′-TGACAAATTCAGCCAAGA-3′,下游引物:5′-CGATAAATCGGGCAGTAA-3′;采用烟草的L25基因作为内参基因[15],上游引物:5′-CCCCTCACCACAGAGTCTGC-3′,下游引物:5′-AAGGGTGTTGTTGTCCTCAATCTT-3′。定量PCR分析仪器为LightCycler®96(Roche,http://www. roche.com/index.htm),所用试剂均为SYBR Premix Ex TaqTM[宝生物工程(大连)有限公司,http://www.takara-bio.com/],qRT-PCR反应体系:按照说明书的要求在冰上配制20µL反应体系,包括SYBR Premix Ex TaqTM,上、下游引物各0.2 μmol/L,每个反应含约50 ng的cDNA,以不加模板作为阴性对照。PCR反应程序:94℃预变性30 s;94℃变性5 s,60℃退火20 s,72℃延伸20 s,35个循环[16]。反应结束后,根据得到的CT值,用2-△△CT方法计算相对表达量[17]。经L25基因标准化后,以相同处理时间对照的相对表达量为1,基因的相对表达量为该基因与同一时间对照处理组的比值。所有数据是3次独立实验结果的平均值,用Duncan’s法进行差异显著性分析(P<0.05和P<0.01)。
2 结果与分析
2.1 HQT1基因克隆
以移栽后4周烟草幼苗的cDNA为模板,通过设计的特异引物进行PCR扩增,得到1条长度约为1 300 bp(图1)的条带。用PCR产物连接pMD19-T载体并转化感受态细胞,以微量菌液为模板进行PCR验证,含有阳性克隆的菌液由北京华大基因研究中心进行测序,经测序验证无误。

图1 PCR扩增产物的电泳图
2.2 生物信息学分析
对获得的基因序列使用NCBI Blast在线工具进行核酸相似性比对。结果显示:该基因与其他植物HQT序列高度相似。与茄科植物马铃薯(Solanum tuberosum)和番茄(Solanum lycopersicum)HQT基因的相似度高达78%;与咖啡(Coffea canephora)和金银花(Lonicera japonica)HQT基因的相似性分别为71%和67%,与朝鲜蓟(Cynara cardunculus var.scolymus)HQT、HQT1和HQT2的相似性分别为66%、68%和66%。推测克隆的基因属于HQT基因家族,命名为NtHQT1。
NtHQT1基因全长1 305 bp,编码435个氨基酸。对烟草、马铃薯、番茄、咖啡、朝鲜蓟及金银花HQT蛋白序列进行比对,结果(图2)显示:不同植物的HQT编码蛋白N端差异较大,这可能与N端多为物种特异性信号肽有关。通过MEME在线软件寻找潜在的基序,与其他植物的HQT基因中得到的8个保守基序一致,进一步说明克隆到的基因属于HQT基因家族。
烟草NtHQT1蛋白序列预测结果显示:该蛋白的分子量是48.58 kDa,等电点为7.22,富含亮氨酸、异亮氨酸、脯氨酸等非极性氨基酸。有46个带负电荷的氨基酸残基和46个带正电荷的氨基酸残基。蛋白的不稳定指数为65.7%,预测其在哺乳动物体内半衰期为30 h,在酵母中的半衰期大于20 h,表明NtHQT1蛋白不稳定。平均总亲水性系数(Grand average of hydropathicity)为-0.139,预测该蛋白为疏水性蛋白。对NtHQT1蛋白的跨膜区预测结果显示:NtHQT1不存在跨膜结构域,表明不是膜蛋白。该蛋白的核定位信息预测结果显示,NtHQT1蛋白没有细胞核定位信息,推测该蛋白没有定位在细胞核内。NtHQT1的信号肽预测发现,不具有信号肽序列(信号肽序列指跨膜转移的N端的氨基酸序列,一般存在于分泌型的蛋白中),这也说明HQT不是分泌型蛋白。在线软件TargetP 1.0 Server分析表明,此蛋白既不是叶绿体转运蛋白,也不是线粒体定位蛋白。结合跨膜分析和定位分析的结果,推测该蛋白可能在细胞质中发挥作用。
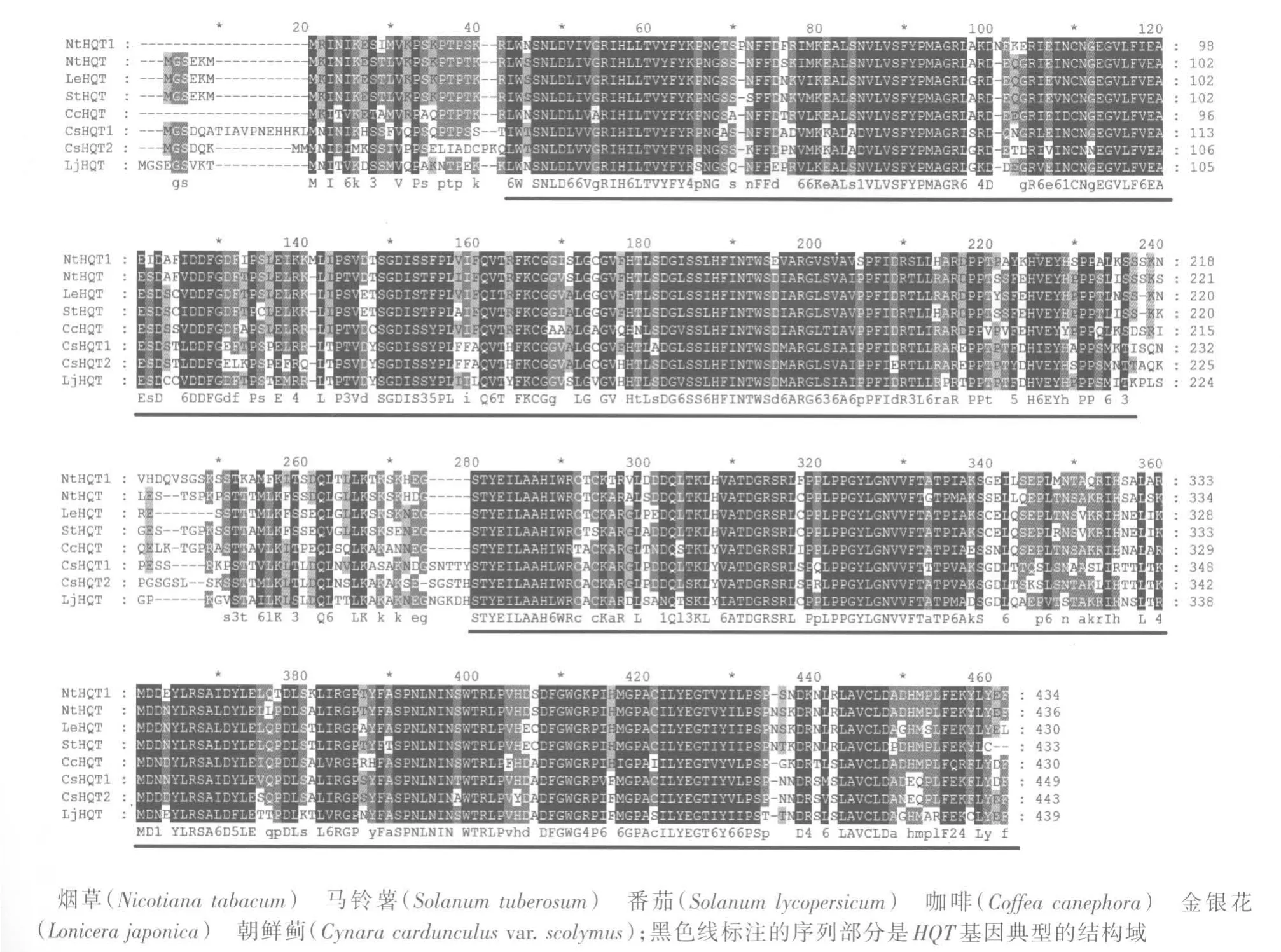
图2 烟草NtHQT1蛋白与其他HQT蛋白多重序列比对
蛋白的二级结构(图3)预测发现:NtHQT1蛋白与烟草HQT蛋白的二级结构类似,主要由螺旋、延伸链以及无规则卷曲组成,其中延伸链主要在螺旋和随机卷曲之间或者两个螺旋之间起连接作用。NtHQT1蛋白质的三级结构预测分析结果显示,NtHQT1与羟基肉桂酰辅酶A莽草酸/奎尼羟基肉桂转移酶(Hydroxycinnamoyl-CoA shikimate/ quinate hydroxycinnamoyl transferase,HCT)同源性最高,达61%。比对发现已经报道的烟草HQT[15]与咖啡HCT氨基酸序列相似程度也较高,达76%,因此以HCT结构为模型构建NtHQT1的三级结构,见图4。
在NCBI数据库中搜索到的不同植物HQT的氨基酸序列,包括烟草、马铃薯、番茄、咖啡、金银花、朝鲜蓟等,用Clustal W进行相似性比对,然后用MEGA5软件构建进化树,结果见图5。从进化树上可以看出NtHQT1与烟草、番茄和马铃薯HQT的亲缘关系较为接近。
2.3 不同植物激素对NtHQT1基因表达的影响
植物生长调节剂对烟草绿原酸的合成及积累有很大影响,萘乙酸(NAA)处理可降低绿原酸含量[18],马来酰肼(MH)处理可使其含量明显升高[19]。经6种植物激素(ABA,GA,MeJA,GR24,IAA和6-BA)分别处理移栽后4周的烟草幼苗的测定结果(图6)显示,MeJA、IAA、GR24、6-BA和GA能明显上调NtHQT1基因的表达,ABA对NtHQT1基因表达没有显著的上调作用。
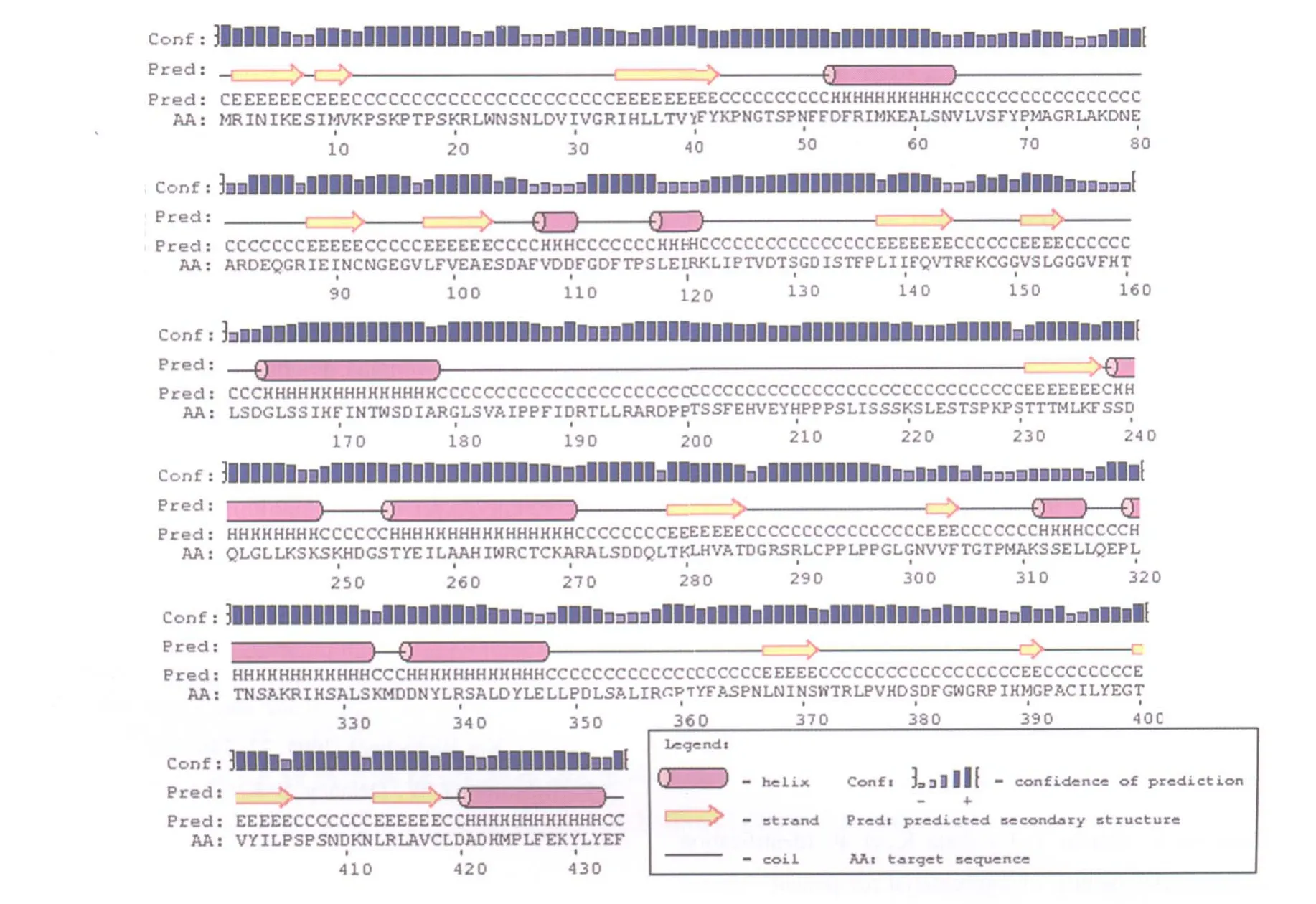
图3 HQT蛋白二级结构预测结果

图4 HQT蛋白三级结构预测结果

图5 植物NtbHLH93氨基酸序列进化树

图6 不同激素处理对NtHQT1基因表达的影响
3 结论与讨论
研究发现HQT属于BAHD乙酰转移酶超家族,该基因家族的酶利用底物酰基辅酶A催化生成不同的植物代谢产物[20]。HQT催化咖啡酰-CoA和奎尼酸生成绿原酸,敲除HQT基因能够显著降低烟草绿原酸的含量[15]。本试验中通过同源克隆技术,成功地从普通烟草中克隆到一个新的HQT基因,命名为NtHQT1,虽然与已经克隆的烟草HQT基因序列的相似性只有78%,但分析表明该基因具有HQT基因保守的结构域,是植物HQT基因家族的成员。在朝鲜蓟中发现3个HQT基因,其相似性在70%左右[21]。根据NtHQT1和烟草中已经克隆到的HQT基因的相似性,推测烟草中的HQT基因是一个基因家族。
NtHQT1基因受MeJA、IAA、GR24、6-BA和
GA的诱导上调表达。ABA对NtHQT1基因表达没有显著的上调作用。在山银花上的研究发现,绿原酸在处于分化阶段的细胞中含量最高,在细胞分化接近成熟时开始急剧减少,而在细胞趋于衰老时绿原酸含量最低[21]。IAA、GR24、6-BA和GA 4种植物生长调节激素都有促进植物生长和细胞分裂的作用,这与在山银花中发现的在分化阶段的细胞中绿原酸含量较高相一致。MeJA处理烟草可使生物碱和酚酸类物质含量增加,以增强对昆虫啃食的抵御[22],这与本试验中发现的MeJA处理烟草可使NtHQT1基因上调表达结果一致。ABA是调节干旱胁迫和盐胁迫的重要激素[23],ABA没有明显上调NtHQT1基因的表达,推测干旱胁迫等可能不会上调绿原酸含量。因此,推测NtHQT1可能在烟草生长发育及抵抗病原菌侵染的过程中具有重要的作用。
[1]Dogasaki C,Shindo T,Furuhata K,et al.Identification of chemical structure of antibacterial components against Legionella pneumophila in a coffee beverage[J].Yakugaku Zasshi:Journal of the Pharmaceutical Society of Japan,2002,122(7):487-494.
[2]Bouayed J,Rammal H,Dicko A,et al.Chlorogenic acid,a polyphenol from Prunus domestica(Mirabelle),with coupled anxiolytic and antioxidant effects[J].J Neurol Sci,2007,262(1/2):77-84.
[3]温红侠,陈一强,朱莲娜,等.绿原酸对铜绿假单胞菌生物膜干预作用的体外研究[J].中华医院感染学杂志,2009,19(12):1478-1481.
[4]Plumb G W,Garcia-Conesa M T,Kroon P A,et al. Metabolism of chlorogenic acid by human plasma,liver,intestine and gut microflora[J].J Sci Food Agric,1999,79(3):390-392.
[5]Nardini M,Cirillo E,Natella F,et al.Absorption of phenolic acids in humans after coffee consumption[J].J Agric Food Chem,2002,50(20):5735-5741.
[6]StalmachA,SteilingH,WilliamsonG,etal. Bioavailabilityofchlorogenicacidsfollowingacute ingestion of coffee by humans with an ileostomy[J]. Arch Biochem Biophys,2010,501(1):98-105.
[7]Rice-Evans C A,Miller N J,Paganga G.Antioxidant properties of phenolic compounds[J].Trends Plant Sci,1997,2(4):152-159.
[8]Grace S C,Logan B A,Adams W W.Seasonal differences in foliar content of chlorogenic acid,a phenylpropanoid antioxidant,inMahoniarepens[J].PlantCell Environment,2002,21(5):513-521.
[9]Pavlica S,Gebhardt R.Protective effects of ellagic and chlorogenic acids against oxidative stress in PC12 cells[J].Free Radical Research,2005,39(12):1377-1390.
[10]周冀衡,朱小平,王彦亭,等.烟草生理与生物化学[M].合肥:中国科技大学出版社,1996.
[11]Gayed S K,Rosa N.Levels of chlorogenic acid in tobacco cultivars,healthy and infected with Thielaviopsis basicola[J].Phytopathology,1975,65(10):1049-1053.
[12]毕咏梅,欧阳光察.稻瘟病菌诱导物对水稻苯丙烷类途径酶系和绿原酸的诱导作用[J].植物生理学通讯,1990,29(3):18-20.
[13]Camacho-Cristóbal J J,Lunar L,Lafont F,et al.Boron deficiency causes accumulation of chlorogenic acid and caffeoyl polyamine conjugates in tobacco leaves[J].J Plant Physiol,2004,161(7):879-881.
[14]Niggeweg R,Michael A J,Martin C.Engineering plants with increased levels of the antioxidant chlorogenic acid[J].Nat Biotechnol,2004,22:746-754.
[15]Schmidt G W,Delaney S K.Stable internal reference genes for normalization of real-time RT-PCR in tobacco(Nicotiana tabacum)during development and abiotic stress[J].Mol Genet Genomics,2010,283(3):233-241.
[16]武明珠,李锋,王燃,等.烟草转录因子bHLH93基因的克隆及表达分析[J].烟草科技,2015,48(3):1-7.
[17]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTMethod[J].Methods,2001,25(4):402-408.
[18]左天觉.烟草的生产、生理、生物化学[M].朱尊权,等译.上海:上海远东出版社,1993.
[19]耿世磊,宁熙平,吴鸿,等.山银花不同发育阶段花结构与绿原酸含量变化关系研究[J].云南植物研究,2005,27(3):279-287.
[20]St-Pierre B,De Luca V.Evolution of acyltransferase genes:originanddiversificationoftheBAHD superfamily of acyltransferases involved in secondary metabolism[J].RecentAdvPhytochem,2000,34:285-315.
[21]SonnanteG,D′AmoreR,BlancoE,etal.Novel hydroxycinnamoyl-coenzyme A quinate transferase genes fromartichokeareinvolvedinthesynthesisof chlorogenic acid[J].Plant Physiol,2010,153(3):1224-1238.
[22]Wasternack C,Parthier B.Jasmonate-signalled plant gene expression[J].Trends Plant Sci,1997,2(8):302-309.
[23]Zhu J K.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Biol,2002,53(1):247-273.
责任编辑 董志坚
Cloning and Expression Analysis of Chlorogenic Acid Biosynthetic GeneNtHQT1 fromNicotiana tabacum
WU Mingzhu,XU Yalong,LI Feng,WEI Pan,WANG Zhong,LUO Zhaopeng,WANG Ran, ZHANG Jianfeng,LIN Fucheng,and YANG Jun*
Zhengzhou Tobacco Research Institute of CNTC,Zhengzhou 450001,China
Chlorogenic acid is the dominant polyphenol in leaf tobacco.Hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase(HQT)is the key enzyme in the metabolic pathway of chlorogenic acid in plant.In order to study the function mechanism of HQT gene in the synthesis of chlorogenic acid in tobacco,a new HQT gene was cloned from Nicotiana tabacum by homologous cloning technology and named as NtHQT1.The results of bioinformatics analysis and expression pattern analysis of genes treated by different hormones showed that NtHQT1 cDNA was 1 305 bp in length and encoded 435 amino acids;it was a hydrophobic protein and located in cytoplasm,its secondary structure was mainly of helix and random coil.The expression of NtHQT1 gene was obviously up-regulated by methyl jasmonate(MeJA), auxin(3-Indoleacetic acid,IAA),strigolactone(GR24),cytokinin(6-BA)and gibberellin acid(GA), while not obviously affected by abscisic acid(ABA).It suggested that NtHQT1 might play an important role in the course of growth,development and disease resistance of tobacco.
Nicotiana tabacum;Chlorogenic acid;NtHQT1;Cloning;Sequence analysis;Expression analysis
S572.01
A
1002-0861(2015)11-0001-06
10.16135/j.issn1002-0861.20151101
2015-02-09
2015-07-28
中国烟草总公司郑州烟草研究院院长科技发展基金项目“烟草甾醇合成相关转录因子NtbHLH93基因功能研究”(902013CA0330)。
武明珠(1983─),博士,工程师,主要从事烟草基因功能研究。E-mail:mingzhuwus@126.com;*
杨军,E-mail:yangjun@ztri.com.cn
武明珠,许亚龙,李锋,等.烟草绿原酸合成关键基因NtHQT1的克隆及表达分析[J].烟草科技,2015,48(11):1-6. WU Mingzhu,XU Yalong,LI Feng,et al.Cloning and expression analysis of chlorogenic acid biosynthetic gene NtHQT1 from Nicotiana tabacum[J].Tobacco Science&Technology,2015,48(11):1-6.

