抑制NBS1表达对三阴性乳腺癌细胞MDA-MB-231增殖和凋亡的影响
华 晶, 王雅杰
(第二军医大学附属长海医院肿瘤科,上海 200433)
·基础研究·
抑制NBS1表达对三阴性乳腺癌细胞MDA-MB-231增殖和凋亡的影响
华 晶, 王雅杰
(第二军医大学附属长海医院肿瘤科,上海 200433)
目的 探讨siRNA抑制NBS1基因表达对三阴性乳腺癌细胞MDA-MB-231增殖和凋亡的影响。方法 通过构建NBS1干扰质粒和阴性空载质粒,并通过腺病毒载体感染MDA-MB-231细胞,Western印迹法明确NBS1基因受干扰情况;CCK-8法检测转染质粒后对MDA-MB-231细胞体外增殖能力的影响;流式细胞法检测感染后实验组和阴性对照组MDA-MB-231细胞的凋亡情况。结果 Western印迹法检测结果表明实验组NBS1蛋白表达水平明显低于阴性对照组和空白对照组(P<0.05);CCK-8实验结果显示,与阴性对照组和空白对照组相比,实验组细胞增殖能力受到抑制(P<0.05);流式细胞仪检测结果显示,实验组较阴性对照组凋亡率上升(P<0.05)。结论 抑制NBS1基因的表达可以抑制三阴性乳腺癌细胞增殖,并促进癌细胞的凋亡。
三阴性乳腺肿瘤; NBS1; 细胞增殖; 细胞凋亡; siRNA
三阴性乳腺癌(triple negative breast cancer, TNBC)好发于绝经前的年轻女性, 肿瘤细胞分化差,侵袭性高,复发、转移早,病死率明显高于非三阴性乳腺癌患者。即使是早期的三阴性乳腺癌患者,其3年内复发风险仍然很高,且多于确诊后的5年内死亡[1]。传统的内分泌治疗以及临床上广泛应用的抗HER-2分子靶向治疗对三阴性乳腺癌无效,因此,常规化疗仍是其主要的全身治疗手段。然而,三阴性乳腺癌对化疗的早期有效率较高,但很快即产生耐药致使其后治疗失败。所以,探索更多的治疗手段来攻克三阴性乳腺癌治疗的耐药成为目前研究的重点。
NBS1基因位于8号染色体长臂2区1带,具有调控细胞周期检查点和修复DNA双链断裂的作用。有研究显示,NBS1异常可导致DNA双链修复减弱及基因组不稳定,从而使乳腺癌危险性增高[2]。在研究白芦藜醇抗肿瘤机制时,有学者发现其是通过下调乳腺癌细胞中DNA修复基因的表达来起作用的[3],而其中最主要的就是MRN复合体中的NBS1以及MRE11。因此,其在化疗耐药中的作用有待于进一步研究。本研究前期的实验发现,NBS1基因在三阴性乳腺癌中高表达,而在正常癌旁组织中低表达,且其表达与三阴性乳腺癌的预后相关。本实验将通过研究下调NBS1基因表达对三阴性乳腺癌MDA-MB-231细胞增殖和凋亡的影响,为进一步探寻抑制三阴性乳腺癌细胞活性的途径,以其找到提高TNBC治疗疗效的方法。
1 材料与方法
1.1 主要材料
人MDA-MB-231细胞为复旦大学肿瘤医院邵志敏教授所馈赠;胎牛血清购自美国Gibco公司;DMEM培养液、PBS购自Thermo公司;细胞裂解液、BCA蛋白浓度测定试剂盒购自全式金公司;NBS1兔单克隆抗体、抗兔二抗购自Abcam公司;GAPDH购自Abmart公司;CCK-8购自日本DOJINDO公司;流式细胞Annexin-v和7-AAD双染试剂盒购自BD公司;NBS1基因干扰靶点设计及腺病毒载体构建委托上海和元生物技术有限公司完成。
1.2 细胞培养和实验分组
人MDA-MB-231细胞使用含10%胎牛血清、100μg/ml链霉素和100U/ml青霉素的DMEM培养液,置于37℃、5%CO2的细胞培养箱中培养。细胞复苏后传代2次,取对数生长期细胞进行实验。实验分空白对照组(无处理因素)、阴性对照组(感染含空载质粒腺病毒)和实验组(感染含NBS1干扰质粒腺病毒)。
1.3 腺病毒感染细胞
消化收集对数生长期的MDA-MB-231细胞,使用无双抗DMEM培养基,接种于6孔板中(密度为2×105/孔),24h后细胞密度为70%~80%。换无血清培养基后,按MOI值100加入腺病毒,37℃培养2~3h后,更换为含10%血清培养基继续培养过夜,24h后感染细胞即可用于后续实验。
1.4 蛋白质印迹法检测质粒转染对MDA-MB-231细胞NBS1表达的影响
细胞转染72h后,4℃预冷的1×PBS轻柔吹洗2次后,彻底吸净PBS,每孔加入RIPA裂解液,冰上静置15min后,使用细胞刮片刮净细胞,然后将细胞碎片和裂解液移至1.5ml离心管中。 4℃,离心半径6cm,12000r/min,离心5min。将离心后的上清液分装转移到0.5ml的离心管中放于-20℃保存。使用BCA试剂盒测定细胞总蛋白浓度,按20μg/孔蛋白进行10%SDS-PAGE电泳,将电泳分离后的蛋白电转移至聚偏二氟乙烯膜上,用含5%脱脂奶粉的封闭液室温封闭1h;加入1∶1000稀释的兔抗人NBS1单克隆抗体和1∶2000稀释的兔抗人GAPDH单克隆抗体,低速摇床4℃孵育过夜;加入稀释的二抗,室温反应2h,之后洗膜3次,最后行扫膜,使用ImageJ软件分析条带结果。
1.5 CCK-8法检测转染质粒后对MDA-MB-231细胞体外增殖能力的影响
取对数生长期的各转染组细胞,制备单细胞悬液,调整密度为3×104/ml,按每孔100μl接种至96孔板中,每组设3个平行孔;于0(种板4h后细胞贴壁)、24、48、72h分别加入CCK-8试剂10μl/孔,37℃ 培养2h后于多功能酶标仪上波长450nm处测量各孔的吸光度值(D450),作出细胞增殖曲线。
1.6 流式细胞法检测细胞凋亡
消化离心收集悬浮细胞,微量离心机离心半径6cm,1200r/min,离心5min,弃培养基;PBS洗细胞1遍, 1×Binding Buffer洗细胞1遍;用100μl 1×Binding Buffer重悬细胞,使细胞密度为1×106~5×106/ml;加入 5μl荧光染料结合的AnnexinV至100μl 细胞悬液,室温孵育10~15min;1×Binding Buffer洗细胞1遍,200μl 1×Binding Buffer重悬,加入 5μl 7-AAD染色液,1h内用流式细胞仪检测。实验重复3次。
1.7 统计学处理
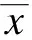
2 结 果
2.1 腺病毒感染效率比较
使用腺病毒感染MDA-MB-231细胞48h后,使用荧光显微镜观察各组细胞。发现干扰组和空载对照组的转染效果相近,荧光效果较好,转染效率为70%~80%,见图1。
2.2 干扰NBS1基因后蛋白表达
蛋白质印迹法检测结果显示特异性条带出现于相应位置(图2),使用ImageJ软件分析,提示实验组NBS1蛋白表达水平明显低于阴性对照组和空白对照组,差异有统计学意义(P<0.05);而阴性对照组和空白对照组间的差异无统计学意义(P>0.05)。

图1 荧光显微镜下观察腺病毒感染48h后实验组和阴性 对照组的MDA-MB-231细胞Fig.1 The expression of green fluorescence in MDA-MB-231 cells after transfection for 48h under a fluorescence microscope

图2 Western印迹法检测NBS1蛋白表达Fig.2 The expression of NBS1 protein by Western blotting
2.3 流式细胞检测细胞凋亡
分别使用NBS1-siRNA和空载质粒RNA转染MDA-MB-231细胞后继续培养48h,使用流式细胞仪检测,结果显示实验组较阴性对照组凋亡率上升,差异有统计学意义(P<0.05),见图3。

图3 流式细胞法检测细胞凋亡率Fig.3 The apoptosis rates of MDA-MB-231 cells detected by flow cytometryA: 空白对照组;B: 阴性对照组;C: 实验组
2.4 下调NBS1的表达对乳腺癌MDA-MB-231细胞增殖的影响
根据CCK-8实验结果绘制的细胞增殖曲线提示,与阴性对照组和空白对照组相比,实验组细胞增殖能力受到抑制(P<0.05);而阴性对照组和空白对照组间的差异无统计学意义(P>0.05),见图4。
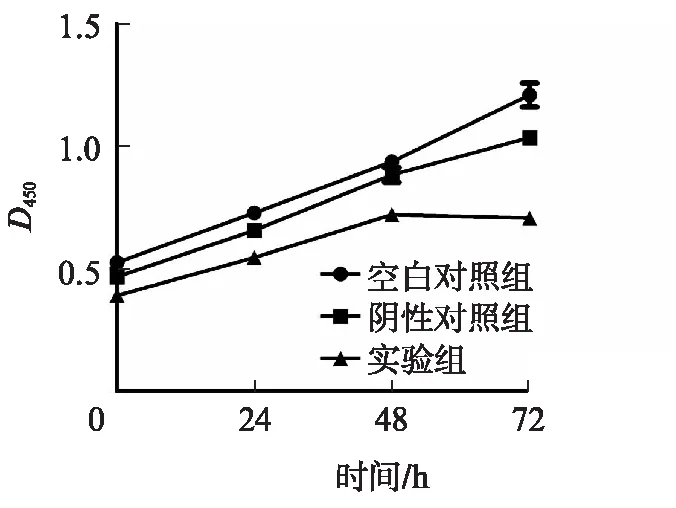
图4 实验组、空白对照组和阴性对照组的细胞增殖曲线Fig.4 The proliferative curves of MDA-MB-231 cells detected by CCK-8 assay
3 讨 论
DNA双链断裂(double strand breaks, DSB)是致命性的DNA损伤。细胞可通过两种途径来修复DNA双链断裂: 非同源末端连接修复和同源重组修复。非同源末端连接修复可在任何细胞周期进行,但由于细胞周期依赖激酶促使双链断裂末端切除的重要作用,同源重组修复主要在细胞进入S期时被激活[4]。非同源末端连接修复易于出错,而同源重组修复由于其需要完全相同的姐妹染色单体作为复制模板,因此异常精确地保留遗传信息。NBS1以及RAD50和MRE11基因的蛋白产物就是所谓的MRN复合体,它与DNA双链断裂修复的识别相关[5],是DSB修复的关键组分[6]。
NBS1基因突变可导致Nijmegen断裂综合征(Nijmegen breakage syndrome, NBS),还有研究显示NBS1基因变异与乳腺癌的高发风险存在潜在的相关性[8-10]。NBS1的高表达被明确认为是人头颈部肿瘤侵袭性高低的预测因素[11],但在乳腺癌当中,NBS1的意义仍有争议[12-13]。通常来说NBS1突变所致疾病的发病率比较低,尽管在乳腺癌中也类似[12,14],但是仍被认为是中危的乳腺癌易感基因[15]。
三阴性乳腺癌中约15%~20%的患者伴有BRCA1基因的突变,BRCA基因及蛋白产物通过同源重组(HR)修复断裂的双链DNA,BRCA基因功能的缺失将导致DNA损失修复缺陷,对致DNA损伤药物如顺铂以及聚ADP-核糖聚合酶(PARP)抑制剂等更敏感。NBS1作为DNA双链损伤的修复基因,其功能减低,同样可能使DNA双链修复减弱及基因组不稳定,增加化疗的敏感性。
本实验成功构建了经腺病毒载体感染后的NBS1基因低表达质粒,CCK-8实验发现经NBS1-siRNA干扰的实验组在24h后,三阴性乳腺癌细胞的生长明显受到抑制,而空白对照组和阴性对照组经检验差异无统计学意义,表明NBS1的缺失将抑制三阴性乳腺癌细胞的生长,其存在可能会促进乳腺癌细胞的生长和发展。分析其原因,可能是细胞在生长过程中时刻会出现DNA损伤,而由于NBS1基因受到抑制,因此在肿瘤细胞中DNA双链断裂修复的功能丧失,以致无法修复而导致细胞生长停滞。另外,Wang等[16]研究发现NBS1可与mTOR/Rictor/SIN1复合体交互,进一步激活Akt。Akt是PI3K-Akt通路的下游元件,是肿瘤发生过程的重要因素[17],其激活后调控一系列负责细胞增殖的蛋白[18]。而Shirode等[19]通过研究石榴提取物的抗肿瘤作用时发现,其抗乳腺癌细胞增殖是与减少修复基因表达和诱导双链断裂相关的,这些修复基因包括: NBS1、RAD50、RAD51、MRE11、BRCA1、BRCA2和BRCC3。这些均提示了NBS1与肿瘤细胞增殖的相关性。流式细胞仪检测结果显示,NBS1-siRNA干扰的肿瘤细胞凋亡率上升,提示NBS1与细胞的凋亡存在相关性。Difilippantonio等[20]也曾报道NBS1的特定结构域调节细胞周期检测点和辐射所致的凋亡,而比较明确的是凋亡是由NBS1蛋白C端的特定结构调节的。抑制肿瘤细胞增殖和促进其凋亡是癌症治疗的关键所在,因此,NBS1可以被认为是一个理想的靶向位点,为今后的药物开发提供理论基础。随着RNAi技术和纳米技术的融合和成熟,可期待NBS1-siRNA能够成为有效治疗三阴性乳腺癌的新手段。
[1] Dent R, Trudeau M, Pritchard KI, et al. Triple negative breast cancer: clinical features and patterns of recurrence[J]. Clin Cancer Res, 2007,13(15Pt1): 4429-4434.
[2] Yamamoto Y, Miyamoto M, Tatsuda D, et al. A rare polymorphic variant of NBS1 reduces DNA repair activity and elevates chromosomal instability[J]. Cancer Res, 2014,74(14): 3707-3715.
[3] Leon-Galicia I, Diaz-Chavez J, Garcia-Villa E, et al. Resveratrol induces downregulation of DNA repair genes in MCF-7 human breast cancer cells[J]. Eur J Cancer Prev, 2013,22(1): 11-20.
[4] Symington LS, Gautier J. Double-strand break end resection and repair pathway choice[J]. Annu Rev Genet, 2011,45: 247-271.
[5] Lavin M. ATM and the Mre11 complex combine to recognize and signal DNA double-strand breaks[J]. Oncogene, 2007,26(56): 7749-7758.
[6] Takeda S, Nakamura K, Taniguchi Y, et al. Ctp1/ctip and the mrn complex collaborate in the initial steps of homologous recombination[J]. Mol Cell, 2007,28(3): 351-352.
[7] Baumann P, West SC. Role of the human RAD51 protein in homologous recombination and double-stranded-break repair[J]. Trends Biochem Sci, 1998,23(7): 247-251.
[8] Desjardins S, Beauparlant JC, Labrie Y, et al. Variations in the NBN/NBS1 gene and the risk of breast cancer in non-BRCA1/2 French Canadian families with high risk of breast cancer[J]. BMC Cancer, 2009,9: 181.
[9] Cai Z, Thomas A, Teerlink C, et al. Pairwise shared genomic segment analysis in three Utah high-risk breast cancer pedigrees[J]. BMC Genomics, 2012,13: 676.
[10] Roznowski K, Januszkiewicz-Lewandowska D, Mosor M, et al. I171V germline mutation in the NBS1 gene significantly increases risk of breast cancer[J]. Breast Cancer Res Treat, 2008,110(2): 343-348.
[11] Yang M, Chiang W, Chang S, et al. Increased NBS1 expression is a marker of aggressive head and neck cancer and overexpression of NBS1 promotes transformation[J]. Clin Cancer Res, 2006,12(2): 507-515.
[12] Huzarski T, Cybulski C, Jakubowska A, et al. Clinical characteristics of breast cancer in patients with an NBS1 mutation[J]. Breast Cancer Res Treat, 2013,141(3): 471-476.
[13] Wan R, Crowe DL. Haploinsufficiency of the Nijmegen breakage syndrome 1 gene increases mammary tumor latency and metastasis[J]. Int J Oncol, 2012,41(1): 345-352.
[14] Bogdanova N, Schurmann R, Waltes S, et al. NBS1 variant I171V and breast cancer risk[J]. Breast Cancer Res Treat, 2008,112(1): 75-79.
[15] van der Groep P, van der Wall E, van Diest P, et al. Pathology of hereditary breast cancer[J]. Cell Oncol, 2011,34(2): 71-88.
[16] Wang JQ, Chen JH, Chen YC,et al. Interaction between NBS1 and the mTOR/Rictor/SIN1 complex through specific domains[J]. PLoS One, 2013,8(6): e65586.
[17] Bellacosa A, Chan TO, Ahmed NN, et al. Akt activation by growth factors is a multiple-step process: the role of the PH domain[J]. Oncogene, 1998,17(3): 313-325.
[18] Vivanco I, Sawyers CL. The phosphatidylinositol 3-kinase-Akt pathway in human cancer[J]. Nature Rev Cancer, 2002,2(7): 489-501.
[19] Shirode AB, Kovvuru P, Chittur SV, et al. Antiproliferative effects of pomegranate extract in MCF-7 breast cancer cells are associated with reduced DNA repair gene expression and induction of double strand breaks[J]. Mol Carcinog, 2014,53(6): 458- 470.
[20] Difilippantonio S, Celeste A, Kruhlak MJ, et al. Distinct domains in Nbs1 regulate irradiation-induced checkpoints and apoptosis[J]. J Exp Med, 2007,204(5): 1003-1011.
NBS1 gene knockdown suppresses proliferation and promotes apoptosis ofhuman triple-negative breast cancer MDA-MB-231 cells
HUAJing,WANGYa-jie
(Dept. of Oncology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China)
Objective To investigate the effect of NBS1 knockdown on proliferation and apoptosis of human triple-negative breast cancer MDA-MB-231 cells. Methods MDA-MB-231 cells were infected with adenovirus vector containing NBS1-siRNA plasmid. The expression of NBS1 was determined by Western blotting. Cell proliferation was detected by CCK-8 assay, and cell apoptosis was analyzed by using FCM. Results Western blotting showed that the expression of NBS1 was decreased in NBS1-siRNAi transfected MDA-MB-231 cells (P<0.05). CCK-8 assay demonstrated that of the proliferation of MDA-MB-231 cells in NBS1-siRNA group was lower than that in negative and blank control groups (P<0.05). FCM revealed that the apoptosis rate of NBS1-siRNA group was higher than that of negative and blank control groups (P<0.05). Conclusion Inhibition of NBS1 gene expression can suppress the proliferation and promote apoptosis of human triple-negative breast cancer MDA-MB-231 cells.
triple negative breast tumour; NBS1; cell proliferation; cell apoptosis; siRNA
10.16118/j.1008-0392.2015.02.001
2014-12-23
上海市科委基础研究重点项目(13NM1401504);上海市自然科学基金(14ZR1408800);第二军医大学长海医院1255学科建设计划特色培育项目(CH12553044)
华 晶(1982—),男,主治医师,硕士研究生.E-mail: schwarz.hua@gmail.com
王雅杰.E-mail: yajiewa0459@163.com
R 737.9
A
1008-0392(2015)02-0001-05

