血小板膜受体P2Y12基因多态性与冠心病患者氯吡格雷抵抗的相关性研究
王 涛
血小板膜受体P2Y12基因多态性与冠心病患者氯吡格雷抵抗的相关性研究
王 涛
目的研究血小板膜受体P2Y12(C34T、G52T、i744TC)基因的遗传多态性与冠心病患者氯吡格雷抵抗间的关系。方法选取50例2012年1月—2013年8月就诊于我院的冠状动脉粥样硬化性心脏病患者为病例组,其中15例患者接受完整氯吡格雷治疗,将其设为治疗组;另选取健康人群16名为对照组。应用多聚酶链-限制性片段长度多态性(PCR-RFLP)对所有参与者检测P2Y12受体基因(C34T、G52T、i744TC)的多态性分布频率进行检测,比较治疗组基因型与氯吡格雷抵抗之间的关系。结果所有参与者血小板膜受体P2Y12基因的突变位点C34T、G52T及i744TC等位基因分布符合Hardy-Weinberg遗传平衡法则(P>0.05),样本人群具有代表性。对于15例接受完整氯吡格雷治疗的患者分析结果显示:治疗后血小板聚集率降低幅度为(15.37± 10.41)%,对治疗组全部成员进行C34T、G52T、iT744C基因分型,其中C34T中CC型6例、CT型4例、TT型5例,氯吡格雷抵抗发生率由低到高为:CC型33.33%(2/6)、CT型50%(2/4)、TT型60%(3/5);G52T不同基因分型患者血小板聚集率在治疗后下降幅度和氯吡格雷抵抗发生率之间差别无统计学意义;iT744C基因型中CC型患者其治疗后血小板聚集率降低程度、实验室氯吡格雷抵抗发生率均有统计学意义(P<0.05)。结论冠心病患者发生氯吡格雷抵抗可能与C34T C>T的突变有关;G52T的基因突变与氯吡格雷抵抗的发生无关;iT744C CC型基因可能与实验室氯吡格雷抵抗有关。
冠心病;血小板膜受体P2Y12;基因多态性;氯吡格雷抵抗
由于冠状动脉介入治疗在急性冠脉综合征(ACS)中的广泛应用,抗凝及抗血小板药物在治疗变异性心绞痛和急性心肌梗死中的作用也日益显著[1,2]。氯吡格雷是一种新型噻吩吡啶类药物,它作为血小板膜ADP受体拮抗剂,通过阻碍ADP与血小板膜受体结合,达到抑制血小板聚集的目的,同时还可以阻断激活后的级联放大效应[3]。既往研究表明[4],长期使用氯吡格雷可显著降低患者经皮冠状动脉介入治疗(PCI)后血栓形成的发生率。但是近年来的研究发现, PCI术后患者对氯吡格雷的临床反应存在个体性差异,即使接受完整的氯吡格雷治疗,不良心血管事件仍有发生。这种现象的具体原因尚不清楚。由于血小板膜受体P2Y12在氯吡格雷药理过程中发挥重要作用,所以有研究认为P2Y12基因多态性可能与氯吡格雷抵抗有关[5]。本研究拟通过对中国人血小板膜受体P2Y12基因C34T、G52T、i744TC多态性位点进行分析,以进一步了解P2Y12基因与氯吡格雷抵抗之间的关系。
1 资料与方法
1.1 研究对象 选取2012年1月—2013年8月就诊于我院心血管内科的50例冠状动脉粥样硬化性心脏病(CHD)患者为病例组,男27例,女23例,年龄(62.37±13.59)岁。其中15例患者接受完整氯吡格雷治疗,设为治疗组。病例入选标准:中国汉族人,18岁以上,冠状动脉造影检查确诊为CHD;排除严重心功能不全、患有严重肝脏疾病和或凝血功能障碍者;半年内有卒中或内脏出血性疾病病史者。治疗组患者口服氯吡格雷75 mg,每日一次维持治疗至少12个月。另随机选择同期参加本地区CHD疾病筛查的健康人群1 6名为对照组,汉族,男9名,女7名,年龄(57.24±11.35)岁。实验室氯吡格雷抵抗试验:服用氯吡格雷前及服用10 d后监测血小板聚集率,即用5 μmol/L和20μmol/L的ADP作为聚集诱导剂来诱导血小板聚集时,受试者服用氯吡格雷后达到最大血小板抑制率与基线相比<10%为抵抗,10%~29%为半抵抗。
1.2 研究方法 对所有研究对象告知研究相关事宜,并自愿签署知情同意书。取所有参与者外周静脉血5 mL,经EDTA抗凝处理并保存,用于基因组DNA的提取。使用氯仿抽提法提取白细胞基因组DNA,置于-20℃环境中保存。采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)法对样本基因C34T、G52T及iT744C进行分型分析。
1.3 统计学处理 样本群体代表性采用Hardy-Weinberg遗传法则检验。计量资料以均数±标准差(±s)表示,两组间数据比较采用t检验,基因型和等位基因频率的比较用百分比表示,率的比较使用χ2检验。所有数据结果均采用SPSS17.0统计软件处理,以P<0.05为有统计学意义。
2 结 果
全部参试人员P2Y12基因三种基因型分布符合Hardy-Weinberg遗传平衡(P>0.05),说明样本来自一个较大的且处于随机平衡状态的群体,具有一定代表性。
2.1 病例组基本资料(见表1~3)
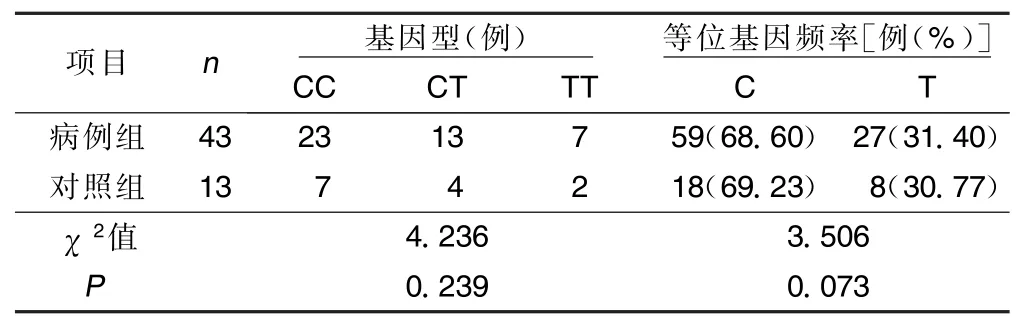
表1 P2Y12基因C34T多态性位点基因型和等位基因频率比较
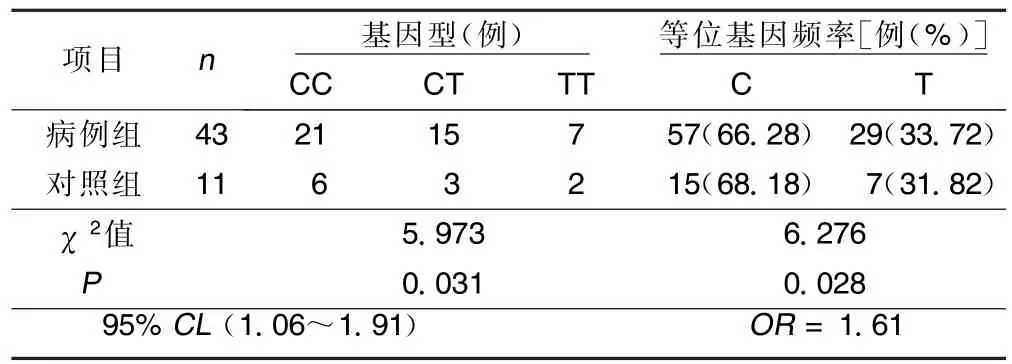
表3 两组P2Y12基因i744TC多态性位点的比较
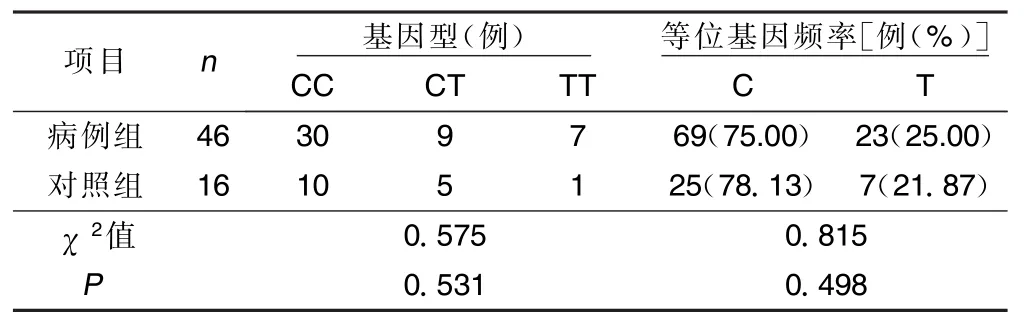
表2 两组P2Y12基因G52T多态性位点比较
2.2 治疗组15例口服氯吡格雷患者资料 ①使用PCR-RFLP技术对C34T成功分型15例,CC型8例、CT型5例、TT型2例,各基因分型间服用氯吡格雷前后比较,最大血小板聚集率差异无统计学意义(P>0.05),服用氯吡格雷10 d后最大血小板聚集率下降显著(P<0.05);C34T各基因型间实验室抵抗发生率分别为:CC型62.5%(5/8),CT型60.0% (3/5),TT型50.0%(1/2),差异有统计学意义(P< 0.05)(详见表4、表5)。
表4 治疗组患者C34T各基因型间最大血小板聚集率的比较(±s)%
指标CC(8/15)CT(5/15)TT(2/15)F值P服药前最大血小板聚集率55.73±13.4162.11±13.9757.65±10.381.1070.471服药后最大血小板聚集率42.64±12.1947.18±10.7753.27±11.544.5930.051血小板聚集率降低幅度14.78±11.1313.74±10.954.51±3.475.0370.011

表5 治疗组患者实验室氯吡格雷抵抗情况在C34T各基因型间的比较
②使用PCR-RFLP技术对G52T成功分型15例,GG型9例、GT型3例、TT型3例,各基因分型间服用氯吡格雷前后比较,最大血小板聚集率差异无统计学意义(P>0.05),服用氯吡格雷10 d后最大血小板聚集率无明显变化(P>0.05);G52T各基因型间实验室抵抗发生率分别为:GG型44.44%(4/9),GT型33.33%(1/3),TT型66.67%(2/3),差异无统计学意义(P>0.05)。详见表6、表7。
表6 治疗组患者G52T各基因型间最大血小板聚集率的比较(±s)%
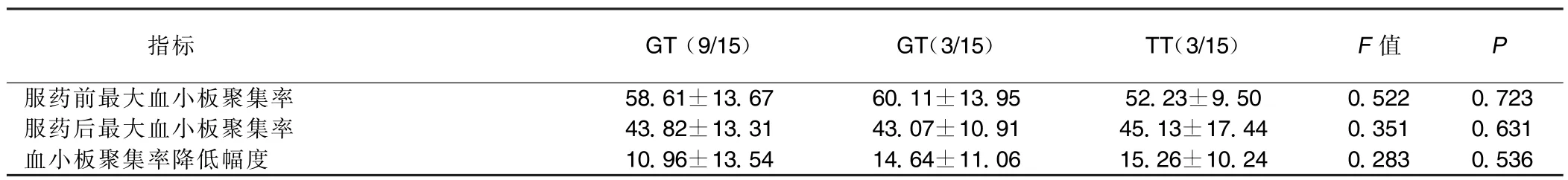
表6 治疗组患者G52T各基因型间最大血小板聚集率的比较(±s)%
指标GT(9/15)GT(3/15)TT(3/15)F值P服药前最大血小板聚集率58.61±13.6760.11±13.9552.23±9.500.5220.723服药后最大血小板聚集率43.82±13.3143.07±10.9145.13±17.440.3510.631血小板聚集率降低幅度10.96±13.5414.64±11.0615.26±10.240.2830.536
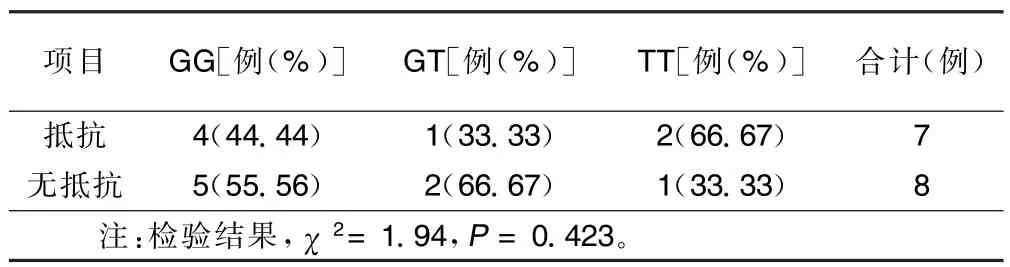
表7 治疗组患者实验室氯吡格雷抵抗情况在G52T各基因型间的比较
③使用PCR-RFLP技术对iT744C成功分型15例,TT型7例、TC型6例、CC型2例,各基因型间服用氯吡格雷前最大血小板聚集率、服用氯吡格雷10 d后最大血小板聚集率、服药前后血小板聚集率降低幅度在各基因型间差异有统计学意义(P<0.05); iT744C不同基因型患者治疗后基因型与实验室氯吡格雷抵抗发生率之间的差别有统计学意义(P< 0.05)。详见表8、9。
表7 治疗组患者iT744C各基因型间最大血小板聚集率的比较(±s)%
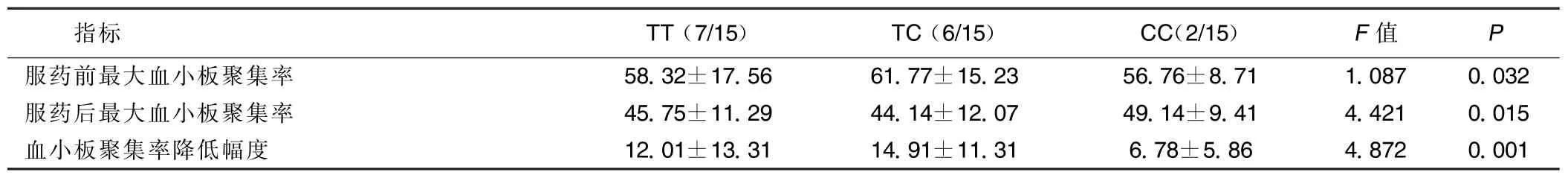
表7 治疗组患者iT744C各基因型间最大血小板聚集率的比较(±s)%
指标TT(7/15)TC(6/15)CC(2/15)F值P服药前最大血小板聚集率58.32±17.5661.77±15.2356.76±8.711.0870.032服药后最大血小板聚集率45.75±11.2944.14±12.0749.14±9.414.4210.015血小板聚集率降低幅度12.01±13.3114.91±11.316.78±5.864.8720.001
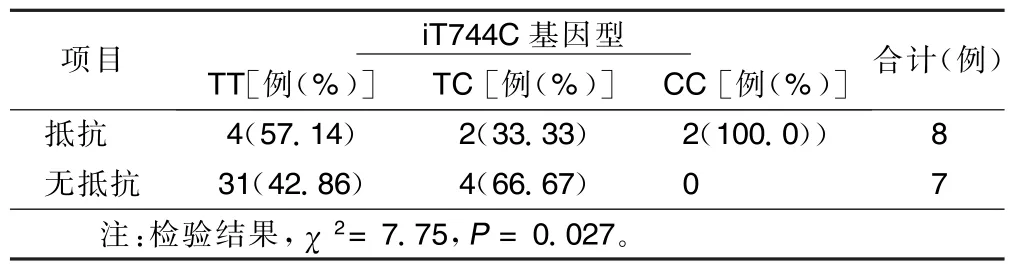
表8 治疗组患者实验室氯吡格雷抵抗情况在iT744C各基因型间的比较
3 讨 论
氯吡格雷作为一种新型噻吩吡啶药物,通过抑制ADP与血小板膜上的ADP受体结合发挥抗血小板聚集作用。氯吡格雷是一个前体药物,本身无生物活性,进入肝脏后通过细胞色素P450酶系统(CYP450)中的CYP3A4和CYP3A5代谢,通过2次氧化形成一个含有二硫键的有生物活性代谢产物,这个代谢产物可不可逆的阻碍血小板膜上ADP受体与ADP结合。大量临床实验证明[3],常用剂量的氯吡格雷可使血小板聚集率降低50%,且其抗血小板聚集作用与药物时间和剂量相关。但氯吡格雷抵抗现象从最初应用氯吡格雷治疗CHD就存在,一些患者在使用氯吡格雷后仍有血栓栓塞事件发生[6]。关于氯吡格雷抵抗产生机制,目前认为与血小板膜受体基因P2Y12多态性有关[7-9]。P2Y12基因位于人类3号染色体q24-25上,现有研究已证实[1014],P2Y12基因位点的突变可引起P2Y12受体蛋白氨基酸AMPD的改变,从而改变P2Y12受体结构进而影响P2Y12受体的激活。P2Y12受体属于G蛋白偶联受体,它作为噻吩吡啶类药物的作用位点,有(P2Y1、P2Y12)2种亚型。P2Y12受体激活后,不仅引发ADP诱导的血小板构象改变从而发生血小板聚集,再经由腺苷酸环化酶抑制蛋白旁路,放大Gq效应;而且使ADP介导的血小板膜GP1b/Ⅲ复合物活化进一步引起血小板聚集。由此可知,P2Y12受体基因的改变,可导致氯吡格雷的抗血小板聚集作用下降,产生氯吡格雷抵抗。目前国际上普遍较为认可的氯吡格雷抵抗标准是:使用百分比计算血小板聚集率,用5μmol/L ADP作诱导剂,测定口服氯吡格雷前后10 d的血小板聚集率最大值的差值≤10%,视为存在实验室氯吡格雷抵抗[15,16]。
本研究对CHD组及对照组进行氯吡格雷抵抗试验,以及对C34T、G52T、iT744C基因多态性的研究发现:C34T成功分为CC型、CT和TT型,各基因分型间服用氯吡格雷前后最大血小板聚集率差异无统计学意义,CC型个体氯吡格雷治疗后血小板聚集率降低幅度最大(14.78±11.13)%,并且CC型实验室抵抗发生率最高为62.5%。所以认为C34T C>T的突变可能是导致实验室氯吡格雷抵抗的危险因素。G52T成功分型为GG、GT和TT型,各基因分型间服用氯吡格雷前后比较,最大血小板聚集率差异无统计学意义,服用氯吡格雷治疗后血小板聚集率降低幅度无统计学意义,并且各基因型间实验室抵抗发生率差异无统计学意义。说明G52T G>T的突变与发生实验室氯吡格雷抵抗没有相关性。
本研究对iT744C成功分型TT、TC和CC型,各基因型间服用氯吡格雷前最大血小板聚集率、服用氯吡格雷10 d后最大血小板聚集率、服药前后血小板聚集率降低幅度在各基因型间差异均有统计学意义, iT744C TT、iT744C TC个体治疗后血小板聚集率下降幅度分别为(12.01±13.31)%、(14.91±11.31)%, iT744C CC个体最低为(6.78±5.86)%。认为iT744C T>C的突变可能会引起实验室氯吡格雷抵抗的发生。
血小板膜P2Y12受体基因C34T C>T及iT744C T>C基因突变可能与冠心病患者发生氯吡格雷抵抗相关。但鉴于样本量太小,需进一步扩大样本量进行定性定量的研究。
[1] Yusuf S,Bijstervld NR,Moons AH.Effects of clopidogrel in add-i tion to aspirincin patients with acute coronary syndromes without ST-segment elevation[J].N Engl J Med,2001,345(7):494-502.
[2] Selwyn AP.Prothrombotic and antithrombotic pathways in acute coronary syndromes[J].Am Cardiol,2003,91(12):3-11.
[3] 黄振华.氯吡格雷抵抗[J].中国新药与临床杂志,2007,26(9): 695-698.
[4] 王白鸽.氯吡格雷治疗冠心病的疗效及安全性[J].中国保健营养,2013,23(3):1435.
[5] 郝盼盼,陈玉国,张运,等.氯吡格雷抵抗相关因素的研究进展[J].心血管病学进展,2009,30(6):991-994.
[6] Wiviott SD,Antman EM.Clopidogrel resistance a new chapter in a fast-moving story[J].Circulation,2004,109(25):3064-3067.
[7] Morel O,Ohlmann P,Jesel L,et al.Variable extent of platelet responsiveness to clopidogrel inhibition:“clopidogrel resistance”
[8] Matetzky S,Shenkman B,Guetta V,et al.Clopidogrel resistance is associated with increased risk of recurrent atherothrombotic events in patients with acute myocardial infarction[J].Circulation,2004,109(25):3171-3175.
[9] Wenaweser P,Dörffler-Melly J,Imboden K,et al.Stent thrombosis is associated with an impaired response to antiplatelet therapy[J].Am College Cardiology,2005,45(11):1748-1752.
[10] Mobley JE,Bresee SJ,Wortham DC,et al.Frequency of nonresponse antiplatelet activity of clopidogrel during pretreatment for cardiac catheterization[J].Am J Cardiol,2004,93(4):456-458.
[11] 白艳艳,王长谦,黄红漫,等.氯吡格雷抵抗和冠心病患者PCI术后心血管事件的关系[J].心血管康复医学杂志,2008,17(2):45-48.
[12] Fontana P,Dupont A,Gandrille S,et al.Adenosine diphosphateinduced platelet aggregation is associated with P2Y12 gene sequence variations in healthy subjects[J].Circulation,2003,108 (8):989-995.
[13] Angiolillo DJ,Fernández-Ortiz A,Bernardo E,et al.High clop-i dogrel loading dose during coronary stenting:Effects on drug response and interindividual variability[J].Eur Heart J,2004,25 (21):1903-1910.
[14] Von Beckerath N,Taubert D,Pogatsa-Murray G,et al.Absorption,Metabolization,and Antiplatelet Effects of 300-,600-,and 900-mg Loading Doses of Clopidogrel Results of the ISARCHOICE(Intracoronary Stenting and Antithrombotic Regimen: Choose Between 3 High Oral Doses for Immediate Clopidogrel Effect)Trial[J].Circulation,2005,112(19):2946-2950.
[15] 孟晓冬,王燕慧.氯吡格雷抵抗研究的新分歧[J].国际检验医学杂志,2013,34(15):1990-1992.
[16] 张永珍,高炜.氯吡格雷抵抗的机制与对策[J].中华内科杂志, 2006,45(3):250-252.
R541 R256
:Bdoi:10.3969/j.issn.1672-1349.2015.03.031
:1672-1349(2015)03-0353-04
2014-07-25)
(本文编辑王雅洁)
广州医科大学附属第一医院(广州510120)

