钼对小鼠睾丸组织中MAPK信号通路的影响及其对雄性生殖系统的毒性机制研究
黎煜枫,毕聪明,王,肖银霞,陈强,刘英姿
(辽宁医学院研究生学院 畜牧兽医系,辽宁 锦州 121001)
钼对小鼠睾丸组织中MAPK信号通路的影响及其对雄性生殖系统的毒性机制研究
黎煜枫,毕聪明Δ,王,肖银霞,陈强,刘英姿
(辽宁医学院研究生学院 畜牧兽医系,辽宁 锦州 121001)
目的 探讨钼对小鼠睾丸组织中MAPK信号通路的影响,分析其对雄性生殖系统的毒性机制。方法 取雄性昆明系小鼠60只,随机分为4组,每组15只,分别为生理盐水对照组、低剂量组(钼酸钠,300 mg/kg)、中剂量组(钼酸钠,600 mg/kg)、高剂量组(钼酸钠,1200 mg/kg)。每日进行灌胃染毒,连续30 d,取出睾丸。采用荧光定量PCR检测小鼠睾丸ERK1、ERK2、JNK1、JNK2、p38基因mRNA表达。结果 低、中、高剂量组ERK2、JNK2、p38 mRNA表达显著低于对照组(P<0.05);低、中、高剂量组ERK1、JNK1 mRNA表达显著高于对照组(P<0.05);且呈剂量依赖性,随着剂量的增加,ERK2、JNK2、p38 mRNA表达显著降低,ERK1、JNK1 mRNA表达显著升高(P<0.05)。结论 钼在ERK、JNK、p38信号通路mRNA水平上对小鼠睾丸组织产生影响,钼对雄性生殖系统损伤是通过激活ERK、JNK、p38通路的活性来调控的,且呈剂量依赖性。不同浓度钼酸钠中毒可损伤小鼠睾丸组织的MAPK信号通路。
钼;小鼠睾丸组织;MAPK信号通路;雄性生殖系统
钼是黄嘌呤氧化酶的组成成分,在动物机体生长发育过程中是必需微量元素,过量的钼会对生长性能产生抑制作用[1-2]。它作为代谢酶的辅助因子发挥其活性作用[3]。睾酮是一种类固醇激素,具有广泛的生理功能,其主要作用是维持生精[4]。丝裂原活化蛋白激酶(MAPK)是一类细胞内的丝氨酸/苏氨酸蛋白激酶,能够于多种不同信号转导途径中充当信号转导因子[5]。研究报道显示,MAPR信号通路在生殖细胞的功能、发育、成熟以及凋亡中具有重要作用,并且参与了生殖细胞发育的多个过程,其中包括生殖细胞周期进程、生殖细胞凋亡以及精子发生、精子获能、顶体反应。在哺乳动物细胞内已发现了经典的3条MAPK通路,分别为细胞外信号调节激酶(ERK)、C-Jun氨基末端激酶(JNK)以及p38MAPK[6]。目前,关于钼对小鼠睾丸组织中MAPK信号通路的影响及其对雄性生殖系统毒性机制的研究尚无报道。本文旨在通过研究钼对小鼠睾丸组织中ERK、JNK、p38MAPK基因的mRNA表达,探讨其对MAPK信号通路的影响,进而分析钼对雄性生殖系统的可能作用机制。
1 材料与方法
1.1 试验动物 4周龄雄性健康昆明系小鼠60只,体质量(25±2)g,健康状况良好,购自北京市实验动物研究中心[合格证号:Scxk(京)-2002-0003]。本实验遵循《实验动物保护条例》。
1.2 试验主要试剂及主要仪器 钼酸钠,粉末状固体,饲料级,用生理盐水溶解。D-3752高速冷冻离心机(美国Sigma公司);DNA Engine PCR 仪(Stratagene公司);Trizol试剂(北京瑞达恒瑞科技发展有限公司)、核酸蛋白测定仪(德国Eppendorf公司);DYC-31D型电泳槽(北京市六一仪器厂);DYY-7型转移电泳仪(北京市六一仪器厂公司);Mx3000P实时荧光定量PCR仪(Stratagene公司)。
1.3 试验动物的饲养、分组及处理 60只小鼠适应性饲养1周后随机分为4组,每组15只分别为生理盐水对照组;低剂量组(钼酸钠300 mg/kg);中剂量组(钼酸钠600 mg/kg);高剂量组(钼酸钠1200 mg/kg),每日进行灌胃染毒,每只0.5 mL,连续30 d。每周记录体质量,每天模拟日光12 h,保证饲喂条件卫生。第30天摘眼球取血后,分离血清;颈椎脱臼处死小鼠,取出睾丸,置于液氮中过夜后,转入-80 ℃保存。
1.4 方法
1.4.1 HE染色观察睾丸组织形态学:取试验小鼠睾丸剥离被膜,睾丸组织重量与预冷0.9%生理盐水1:9倍稀释,匀浆液于低温离心机(4 ℃)离心10 min、3000 r/min,取上清液加入9倍生理盐水稀释成1%的组织匀浆。置于4%中性甲醛液固定。弃去福尔马林液后,睾丸依次用蒸馏水冲洗、乙醇不同浓度逐步脱水、二甲苯浸染、浸蜡、包埋、修块、切片、捞片、烤片,最后进行HE染色后固定。
1.4.2 睾丸组织中总RNA提取:抽取生理盐水组、低剂量组、中剂量组和高剂量组各组小鼠睾丸组织,采取Trizol法提取小鼠睾丸组织中的总RNA。具体操作如下:取60个5 mL EP管,加入1 mL Trizol试剂于每管中,给予标号后放于冰盒中,取出在-80 ℃下保存的睾丸组织,每份取50~100 mg,将所取睾丸组织根据标号放入对应的Trizol的EP管中,于冰浴下采用匀浆机匀浆,然后将匀浆液分别转移至1.5 mL EP管中,于室温条件下静置5 min;再于各管中分别加入0.2 mL氯仿,用力摇动15 s,于室温条件下静置5 min,再于4 ℃条件下离心15 min,转速为12000 r/min,取上清液,使用移液枪吸入1.5 mL置于新的EP管中,然后再加入冰预冷的75%乙醇1 mL,洗涤后沉淀,于4 ℃离心10 min,转速为12000 r/min,弃上清液,空气干燥5~10 min,但不能完全干燥,溶于50 μL的0.1%DEPC水中,置于4 ℃过夜助溶,再将每个样品各分装2管,每管4 μL,以备测定RNA浓度及反转录使用,将剩余RNA于-80 ℃冰箱保存。
1.4.3 荧光定量PCR检测:提取的总RNA采用DEPC水将其调整为100 ng/μL,取2 ng,加1 μL逆转录引物与12 μL DEPC水混匀,置于65 ℃条件下5 min,冰上2 min,再分别加入4 μL 5×反应缓冲液,1 μL RNA酶抑制剂并且加2 μL 10mmol/L dNTP混合物,1 μL Revert Aid M-MuLV逆转录酶,混匀,然后在PCR仪上通过42 ℃条件下60 min,70 ℃条件下5 min,完成逆转录。然后于PCR中每个标本均设立检测管与对照管,温度设置为94 ℃条件下2 min,94 ℃条件下15s,60 ℃条件下1 min,共30个循环,再应用40 g/L琼脂糖凝胶电泳观察结果。小鼠睾丸ERK1、ERK2、JNK1、JNK2、p38 mRNA表达:按照美国国立生物技术信息中心公布的有关小鼠ERK1、ERK2、JNK1、JNK2、p38基因序列,采取Primer Premier 3.0软件进行引物的设计。引物序列见表1,其中F代表上游引物,R代表下游引物。

表1 荧光定量PCR的引物Tab.1 Real-time PCR primer
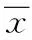
2 结果
2.1 不同组睾丸HE染色切片 由图1结果可知,与对照组相比较,低、中剂量组生精上皮明显变薄,生精细胞层数明显减少,间隙增大,排列疏松,生精细胞核减少消失。高剂量组中,曲精小管的生精细胞大量坏死,脱落,曲细精管管腔基本消失,生精细胞间隙增大,出现大面积空泡,脱落的生精细胞分布于曲精小管管腔中。
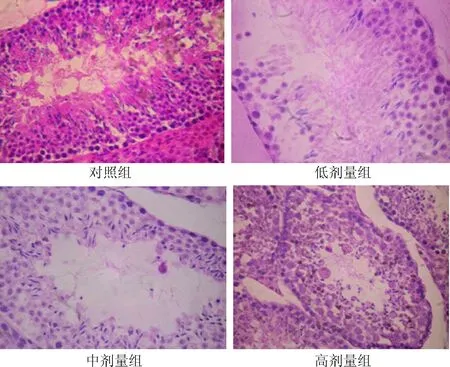
图1 不同组睾丸HE染色切片Fig.1 HE staining result in each group
2.2 目的基因扩增产物的鉴定 小鼠睾丸DNA模板进行Real-time PCR扩增后,每个基因分别随机选取1个样品进行琼脂糖凝胶电泳。电泳结果如图2所示。图中可视:每个泳道分别只有1条亮带,无非特异性条带产生。

图2 目的基因扩增产物的鉴定M:marker;1.ERK1基因;2.ERK2基因;3.JNK1基因;4.JNK2基因;5.p38基因;6.阴性对照Fig.2 The identification of amplification products of target geneM:marker;1.ERK1gene;2.ERK2gene;3.JNK1gene;4.JNK2gene;5.p38gene;6.negative control
2.3 不同组小鼠睾丸ERK1和ERK2基因mRNA表达比较 由表2结果可知,低剂量组、中剂量组、高剂量组ERK1基因mRNA表达显著高于对照组(P<0.05);中剂量组和高剂量组ERK1基因mRNA表达显著高于低剂量组(P<0.05);高剂量组ERK1基因mRNA表达显著高于中剂量组(P<0.05)。低剂量组、中剂量组、高剂量组ERK2基因mRNA表达显著低于对照组(P<0.05);中剂量组、高剂量组ERK2基因mRNA表达显著低于低剂量组(P<0.05);高剂量组ERK2基因mRNA表达显著低于中剂量组(P<0.05)。
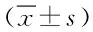
表2 不同组小鼠睾丸ERK1和ERK2基因mRNA表达比较Tab.2 Comparison of ERK1 and ERK2 mRNA expression in each ±s)
*P<0.05,与对照组比较,compared with control group;#P<0.05,与低剂量组比较,compared with low dose group;ΔP<0.05,与中剂量组比较,compared with middle dose group
2.4 不同组小鼠睾丸JNK1和JNK2基因mRNA表达比较 由表3结果可知,低剂量组、中剂量组、高剂量组JNK1基因mRNA表达显著高于对照组(P<0.05);中剂量组、高剂量组JNK1基因mRNA表达显著高于低剂量组(P<0.05);高剂量组JNK1基因mRNA表达显著高于中剂量组(P<0.05)。低剂量组、中剂量组、高剂量组JNK2基因mRNA表达显著低于对照组(P<0.05);中剂量组和高剂量组JNK2基因mRNA表达显著低于低剂量组(P<0.05);高剂量组JNK2基因mRNA表达显著低于中剂量组(P<0.05)。
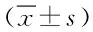
表3 不同组小鼠睾丸JNK1和JNK2基因mRNA表达比较Tab.3 Comparison of JNK1 and JNK2 mRNA expression in each ±s)
*P<0.05,与对照组比较,compared with control group;#P<0.05,与低剂量组比较,compared with low dose group;ΔP<0.05,与中剂量组比较,compared with middle dose group
2.4 不同组对小鼠睾丸P38基因mRNA表达比较 由表4结果可知,低剂量组、中剂量组、高剂量组p38基因mRNA表达显著低于对照组(P<0.05);中剂量组和高剂量组p38基因mRNA表达显著低于低剂量组(P<0.05);高剂量组p38基因mRNA表达显著低于中剂量组(P<0.05)。
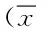
表4 不同组对小鼠睾丸p38基因mRNA表达比较±s)Tab.4 Comparison of p38 mRNA expression in each ±s)
*P<0.05,与对照组比较,compared with control group;#P<0.05,与低剂量组比较,compared with low dose group;ΔP<0.05,与中剂量组比较,compared with middle dose group
3 讨论
雄性激素有很多种,包括睾酮、雄二酮、雄酮等,其中以睾酮的活性最高。雄激素在进入细胞后,可与胞浆内的受体相结合形成复合物,进而发生变构透过核膜入核。进入细胞核的复合物会与染色质上的DNA特异位点相结合,促进或抑制特定基因mRNA的表达,起到调节作用[7]。雄激素在促进雄性器官发育和雄性第二性征的维持,以及促进蛋白质合成等方面都有重要作用。钼是黄嘌呤氧化酶的组成成分,在动物机体生长发育过程中是必需微量元素,过量与缺乏钼都会对生长性能产生抑制作用,所以钼既是有毒物又是生物活性元素[8-9]。病理切片显示,低、中剂量组生精上皮明显变薄,生精细胞层数明显减少,间隙增大,生精细胞核减少消失。高剂量组中,曲精小管的生精细胞大量坏死,脱落,曲细精管管腔基本消失,出现大面积空泡,脱落的生精细胞分布于曲精小管管腔中,严重破坏了睾丸的生理功能。
MAPK信号转导通路是在各种动物体广泛存在的一类真核细胞将信号转导至胞内发生细胞反应的重要信号系统。其中ERK是第一个发现的MAPK信号转导途径,同时也是哺乳动物中目前研究最透彻的一种MAPK信号通路。ERK主要参与调控细胞增殖、分化以及凋亡等,主要经信号的反馈调控,然后与支架蛋白的相互作用及改变亚细胞定位实现[10]。而ERK1和ERK2是在所有命名为ERK的MAPK中研究最为透彻的。研究报道显示,在大鼠睾丸支持细胞及小鼠生殖细胞的各个阶段均存在ERK1和ERK2。精子的发生主要由最初的生殖细胞通过一系列系统的、复杂的变化,从而分化形成一类高度特异性的细胞,它是一种依赖于分泌调节的发育过程,而在这个过程中一些基因发挥着重要作用,若这些基因发生改变或缺失会致使精子出现阻断或异形精子的生成,故而致使不育或生殖能力明显减弱[11]。而ERK1和ERK2均参与了小鼠精子生成的各个环节。本文研究表明,低、中、高剂量组ERK1基因mRNA表达较对照组显著增加(P<0.05),提示钼能够影响小鼠睾丸生殖细胞的增殖与分化,并且机体保护机制可使这种影响弱化,故而保护生殖系统的健康。低、中、高剂量组ERK2基因mRNA表达较对照组显著降低(P<0.05),提示ERK2可能在钼致雄性生殖损伤中发挥了作用。JNK又为应激活化蛋白激酶,其异构体均由JNK1、JNK2、JNK3编码,JNK1/2可广泛地在各种组织细胞中表达[12]。各种细胞因子、生长因子及应激刺激均能激活JNK信号通路。JNK信号通路支架蛋白被称为c-Jun氨基末端激酶相关亮氨酸拉链蛋白(JLP)。研究报道显示,JLP在小鼠睾丸中表达,并且缺乏JLP的小鼠生育率显著下降,故而说明JNK间接参与了正常功能精子的产生[13]。本文研究结果表明,低、中、高剂量组JNK1基因mRNA表达较对照组显著增加(P<0.05),提示钼可能通过激活JNK1通路介导细胞凋亡;低、中、高剂量组JNK2基因mRNA表达较对照组显著降低(P<0.05),提示钼对小鼠生殖系统的毒性可能是经激活JNK2信号通路,从而促进睾丸支持细胞的凋亡,故进一步影响正常精子的生长。p38是由360个氨基酸组成的一种38 kD的蛋白[14]。研究报道显示,当睾丸受到刺激,如促卵泡激素、雌激素、睾丸的改变将通过激活p38信号通路,从而加快细胞凋亡。细胞因子与睾丸破坏血睾屏障的完整性是通过p38途径途径实现的[15]。本文研究报道显示,低、中、高剂量组p38基因mRNA表达较对照组显著降低(P<0.05),提示钼可能抑制了p38的磷酸化,故而降低细胞凋亡的持续发生,从而发挥保护性机制。综上所述,钼在ERK、JNK、p38信号通路mRNA水平上对小鼠睾丸组织产生影响,钼对雄性生殖系统损伤时通过激活ERK、JNK、p38通路的活性来调控的,不同浓度钼酸钠中毒可损伤小鼠睾丸组织的MAPK信号通路。
[1] 易超,赵信义.钼在生物体中的代谢[J].国外医学(医学地理分册),2000,4(7):166-167.
[2] 郭书周,杨自军,张才,等.高钼低铜对小鼠睾丸组织脂质过氧化作用的影响[J].河南农业科学,2011,40(11):145-147,151.
[3] Pytlakowska K,Feist B.Spectrophotometric determination of molybdenum in the presence of tungsten using gallein and benzyldodecyldimethylammonium bromide[J].Journal of analytical chemistry,2013,68(1):39-44.
[4] Nichols RC,Morris CG,Hoppe BS,et al.Proton radiotherapy for prostate cancer is not associated with post-treatment testosterone suppression[J].International Journal of Radiation Oncology,Biology,Physics,2012,82(3):1222-1226.
[5] 程欢.丝裂原活化蛋白激酶信号传导通路对精子功能的影响[J].国际泌尿系统杂志,2010,30(4):477-479.
[6] Sheikh AQ,T Taghian T,Hemingway B,et al.Regulation of endothelial MAPK/ERK signalling and capillary morphogenesis by low-amplitude electric field[J].Journal of the Royal Society Interface,2013,10(78):1-13.
[7] Guo F,Liu Q,Qu GB,et al.Simultaneous determination of five estrogens and four androgens in water samples by online solid-phase extraction coupled with high-performance liquid chromatography-tandem mass spectrometry[J].Journal of chromatography A,2013,1281:9-18.
[8] 张才,郝贵增,王亚垒,等.钼对小鼠生殖毒性研究[J].河南科技大学学报(自然科学版),2012,33(3):54-57.
[9] Belaidi AA,Schwarz G.Metal insertion into the molybdenum cofactor:product-substrate channelling demonstrates the functional origin of domain fusion in gephyrin[J].The Biochemical Journal,2013,450(1):149-157.
[10] 赵明哲,刘靖华,李玉花,等.ERK信号通路的信号转导调控机制[J].国际病理科学与临床杂志,2009,29(1):15-19.
[11] Liu J,Leung C,Lu Z,et al.Quantitative Analysis of Locomotive Behavior of Human Sperm Head and Tail[J].IEEE Transactions on Biomedical Engineering,2013,60(2):390-396.
[12] Ngoei KR,Catimel B,Church N,et al.Characterization of a novel JNK (c-Jun N-terminal kinase) inhibitory peptide[J].The Biochemical Journal,2011,434(3):399-413.
[13] Lysiak JJ,Nguyen QAT,Kirby JL,et al.Ischemia-reperfusion of the murine testis stimulates the expression of proinflammatory cytokines and activation of c-jun N-terminal kinase in a pathway to E-selectin expression[J].Biology of Reproduction,2003,69(1):202-210.
[14] Ren L,Yang Z,Song J,et al.Involvement of p38 MAPK pathway in low intensity pulsed ultrasound induced osteogenic differentiation of human periodontal ligament cells[J].Ultrasonics,2013,53(3):686-690.
[15] Warr N,Carre GA,Siggers P,et al.Gadd45γ and Map3k4 Interactions Regulate Mouse Testis Determination via p38 MAPK-Mediated Control of Sry Expression[J].Developmental cell,2012,23(5):1020-1031.
(编校:王俨俨,吴茜)
Effect of molybdenum on MAPK signaling pathways in mouse testis and its mechanism of male reproductive toxicity
LI Yu-feng,BI Cong-mingΔ,WANG Kun,XIAO Yin-xia,CHEN Qiang,LIU Ying-zi
(Department of Animal Science, Graduate School of Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo investigate the effect of molybdenum on MAPK signaling pathway in mouse testis, and analyze the mechanisms of male reproductive system toxicity.Methods60 male Kunming mice were randomly divided into four groups, control group, low-dose group(molybdenum 300 mg/kg), middle-dose group(molybdenum 600 mg/kg), high-dose group(molybdenum 1200 mg/kg), 15 mice in each group.The mice were gavaged daily, continuous 30d, then removed the testicles.The mRNA expression of ERK1, ERK2, JNK1, JNK2, p38 gene in mice testis were detected by Real-time PCR.ResultsThe ERK2, JNK2, p38 mRNA expression in low-dose group, middle-dose group and high-dose group were significantly lower than those in control group(P<0.05); the ERK1,JNK1 mRNA expression in low-dose group, middle-dose group and high-dose group were significantly higher than those of control group(P<0.05); and dose-dependent manner with increasing dose, ERK2, JNK2, P38 mRNA expression significantly decreased, ERK1, JNK1 mRNA expression significantly increased(P<0.05). ConclusionThe molybdenum could affect mouse testis by regulating ERK, JNK, P38 mRNA levels of signaling pathway, while molybdenum on male reproductive system damage by activating the ERK, JNK, P38 in MAPK signaling pathway.
molybdenum; mouse testis; MAPK signaling pathway; male reproductive system
2013年辽宁省自然基金(2013022036)
黎煜枫,女,硕士,研究方向:遗传学,E-mail:liyufeng00282@163.com;毕聪明,通讯作者,男,博士,教授,研究方向:动物胚胎工程与生殖毒理,E-mail:bicongming747@163.com。
R781.42
A
1005-1678(2015)02-0010-04

