抗菌肽的研究进展及应用前景
尹昆仑,王嘉榕,孙红宾
(中国科学院合肥物质科学研究院 强磁场科学中心,安徽 合肥 230031)
抗菌肽的研究进展及应用前景
尹昆仑,王嘉榕,孙红宾Δ
(中国科学院合肥物质科学研究院 强磁场科学中心,安徽 合肥 230031)
抗菌肽(antimicrobial peptides, AMPs)是自然界生物体内非常重要的防御体系,能够对抗细菌、真菌、病毒甚至肿瘤细胞。抗菌肽具有广谱抗菌活性,且不易产生耐药性,这使得抗菌肽成为应用前景非常广阔的抑菌剂。本文综述了抗菌肽的来源、功能及其作用机制,并对其应用前景进行展望。
抗菌肽;来源;功能;机制;应用前景
近年来,由于抗生素等药物的滥用,药物残留、细菌耐药性等问题日益突出,已经引起了社会的广泛关注,越来越多的国家和地区开始严格控制抗生素等药物的使用。“超级细菌”的出现和蔓延, 如新德里金属β-内酰胺酶1(New Delhi metallo-β-lactamase-1,NDM-1), 更是对人类敲响了警钟。因此,寻找抗生素的替代物成为许多国家的研究重点。抗菌肽(antimicrobial peptides, AMPs)是由机体特定基因编码并经过外界诱导产生的,普遍存在于动物、植物和微生物中,是自然界生物体内非常重要的防御体系。它们是一类具有生物学活性的小分子多肽,一般由12~100个氨基酸残基组成,富含赖氨酸、精氨酸等碱性氨基酸,并且含有高于30%的疏水性氨基酸。抗菌肽大多为两亲性且带有一定量的正电荷(通常是+2~+9),为阳离子多肽。
抗菌肽能够对抗细菌、真菌、病毒甚至肿瘤细胞,并且具有分子量小,水溶性好,耐热性强,无免疫原性,杀菌速度快,不易被蛋白酶水解等特点。这使得抗菌肽成为应用前景非常广阔的抑菌剂。
20世纪80年代,瑞典科学家Boman等在惜古比天蚕中发现并命名了第一个抗菌肽——天蚕素[1]。至今,人们已经从细菌、真菌、动植物中发现并分离得到了2000多种有抗菌活性的多肽。
1 抗菌肽来源
1.1 昆虫抗菌肽 到目前为止,一共发现了200多种昆虫抗菌肽,根据它们的氨基酸序列和抗菌活性,这些抗菌肽可以被分为5大类:天蚕素类,动物防御素,富含脯氨酸的多肽,富含甘氨酸的多肽和溶菌酶[2]。见表1,表2[3]。

表1 昆虫中的一些抗菌肽Tab.1 Recent AMPs from insects

表2 从其他动物中得到的抗菌肽Tab.2 Recent AMPs from other animals
1.2 植物抗菌肽 植物自身可以合成能够防御微生物侵袭的一类多肽,其结构与昆虫、哺乳动物防御素相似,称为植物防御素,不同的植物可以产生不同的抗菌肽。Thionins是第一类从植物中分离出来的抗菌肽[4]。植物抗菌肽对真菌具有很好的杀灭活性。
1.3 微生物抗菌肽 昂贵的生产成本是抗菌肽在实际应用中存在的一大问题,利用基因工程可以实现大规模、异源表达抗菌肽的目的,现已有多种AMPs的表达系统,如大肠杆菌、酵母、昆虫细胞、转基因动植物等[5-17],具有良好的表达效果[3](见表3)。

表3 来源于微生物工程菌的抗菌肽Tab.3 Recent AMPs from engineered microorganism
1.4 人工合成抗菌肽 近年来,随着人们对抗菌肽的不断深入的研究,人们已经可以合成一些抗菌肽,如蛙皮素已经进入Ⅲ期临床实验。因此,合成具有高活性的抗菌肽是发展新型抗生素的一条有效途径[3](见表4)。

表4 一些合成的抗菌肽Tab.4 Recent AMPs from synthesis
2 抗菌肽结构
尽管抗菌肽具有相似的理化性质,但是这些抗菌肽序列的同源性却很低,它们的二级结构通常分为4类:α螺旋结构,β折叠结构,loop结构和线性延展结构[18-20](见表5,图1)。

表5 关于抗菌肽不同一级序列的实例Tab.5 Some examples of the diverse primary sequence compositions of antimicrobial peptides
*氨基酸序列用单字母表示,用数字表示半胱氨酸二硫键的配对情况,粗体表示碱性氨基酸残基
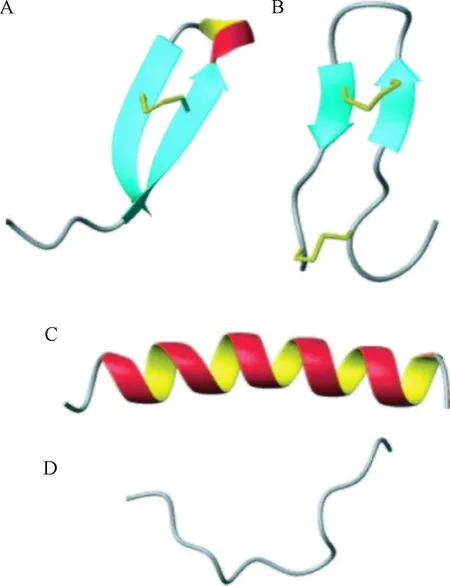
A表示loop结构的thanatin, B表示β折叠结构的polyphemusin, C表示α螺旋结构的magainin-2, D表示延展性结构的lidolicidin图1 抗菌肽的结构类别Fig.1 Structural classes of antimicrobial peptides
3 抗菌肽功能
3.1 抗菌肽对细菌的杀伤作用 抗菌肽的主要生物学功能就是具有抗菌活性[21-22],其抗菌作用主要包括抑制革兰氏阴性细菌、革兰氏阳性细菌。抗菌肽不但具有广谱的抗菌性,而且杀菌速度很快。
3.2 抗菌肽对真菌的杀伤作用 目前已经发现超过7万种真菌,其中一些会对人类的健康产生严重威胁,许多抗菌肽除了具有杀灭细菌功能外还具有抗真菌的功能[23],如Baek和Lee等[24]从毒液中分离出3种多肽(OdVP1, OdVP2, OdVP3),这3种多肽尤其是OdVP2具有强烈的抗真菌活性,但是抗细菌的活性却很低[3]。
3.3 抗菌肽对寄生虫的杀伤作用 寄生虫引起的热带疾病已经对人类社会的经济造成了巨大的损失,由于寄生虫对药物产生了耐药性并且药物的毒副作用也很严重,因此寻找新的方法来控制这些问题已经成为当务之急[25]。例如,BMAP-18具有对多种寄生虫很高的杀伤活性,但同时又对哺乳动物细胞和昆虫细胞具有很低的毒性[26]。
3.4 抗菌肽对病毒和癌症细胞的杀伤作用 抗菌肽具有杀伤病毒和肿瘤细胞的作用[27],它们能够抑制某些肿瘤细胞,但是不会对正常细胞产生影响。据已有报道,抗菌肽对宫颈癌[28]、膀胱癌[29]等具有杀伤作用。
3.5 抗菌肽的免疫调节作用(见图2)[30]已经证实,抗菌肽在宿主细胞的免疫调节方面也起着重要作用。如图(a)~(c),溶解细菌细胞壁释放炎症刺激信号;刺激肥大细胞脱粒促使组织胺的释放和血管的扩张;引起嗜中性粒细胞和辅助性T细胞的趋化作用,导致白细胞富集到感染部位;促进非调理性吞噬作用;通过组织纤维蛋白原激活剂抑制纤维蛋白的溶解,进而减少细菌的扩散;通过促进成纤维细胞的趋化和生长来加速组织和伤口的愈合;通过抑制特定的蛋白酶来减少组织的损伤。如果急性炎症反应不能清除细菌,那么慢性炎症反应就会被激活,作为单核细胞的趋化因子;招募T细胞;提高趋化因子产量和辅助性T细胞的增殖反应,进而导致免疫球蛋白(IgG)的增加,抑制细胞因子产量和巨噬细胞对脂多糖(lipopolysaccharides, LPS)的反应;刺激巨噬细胞的凋亡和淋巴细胞的活化,最终消灭被感染的细胞。
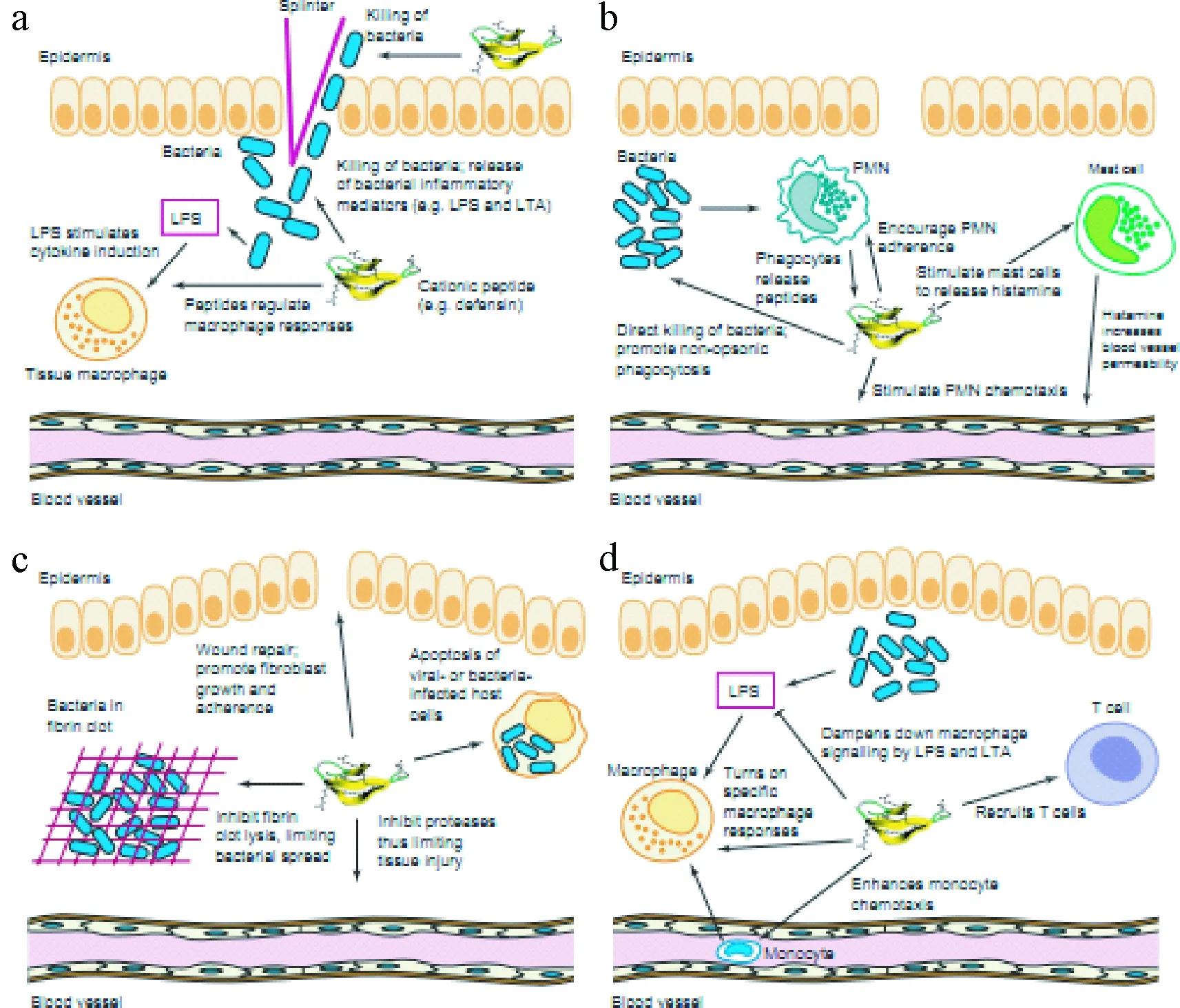
图2 抗菌肽在急性和慢性炎症反应中的作用Fig.2 Proposed role of antimicrobial peptide in acute (a-c) andchronic (d) inflammation
4 抗菌肽作用机制
见图3[20]所示,通常有4种模型来解释抗菌肽作用机制。
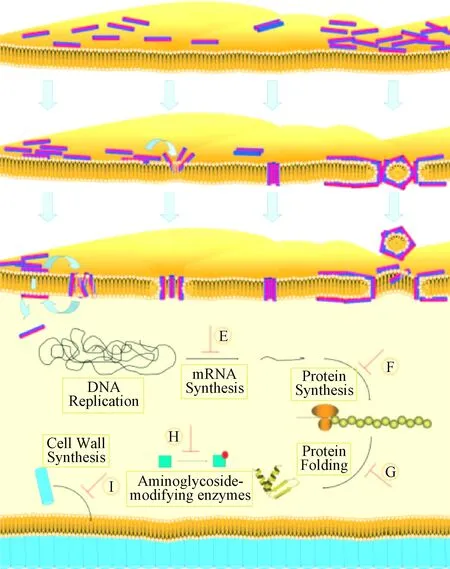
图3 抗菌肽作用机制Fig.3 Mechanisms of action of antimicrobial peptides
A为“聚集通道”模型,抗菌肽插入细胞膜后,与磷脂分子形成胶束状复合物[31-32],以聚集物的形式跨越细胞膜,进而形成了一个动态的通道,抗菌肽通过这种机制可以进入细胞内部。在此模型中,抗菌肽没有特定的取向。
B为“环孔”模型,抗菌肽结合到细胞膜上之后,其亲水区和疏水区分别与磷脂分子的极性头部和非极性尾部相互结合,并且造成细胞膜向内弯曲,破坏膜的完整性,当抗菌肽与脂类的比例达到临界值之后,抗菌肽开始垂直定向于细胞膜,形成肽-脂类超分子复合物。
C为“桶板”模型[33],抗菌肽垂直插入到细胞膜内部,形成一个木桶状的聚集物,多肽的疏水侧朝向细胞膜的酰基链,亲水侧形成一个孔,最终形成横跨细胞膜的通道。通道一旦形成之后,细胞即可与外界进行物质与能量的交换,最终致使细胞膜崩解而导致细胞死亡。
D为“地毯”模型,通过静电相互作用,抗菌肽平行地排列在细胞膜的表面,形成“地毯”式结构,当抗菌肽在单位面积上的数量达到一定的阈值之后,将会导致类似去垢剂的活性,形成胶束状物质,进而破坏细胞膜导致细胞的死亡。在此模型中,抗菌肽的疏水端并不插入到细胞膜,也没有形成孔道。
抗菌肽不仅可以和细胞膜相互作用,也可以和细胞内的生物大分子相互作用,抑制细胞生物大分子的合成和表达,E表示抗菌肽会抑制DNA的复制、RNA的合成,F表示抗菌肽会抑制蛋白质的合成,G表示抗菌肽会抑制蛋白的折叠,H表示抗菌肽会抑制酶的糖基化修饰,I表示抗菌肽会抑制细菌结构组分的形成,如抑制细胞壁的形成[34]。
5 类抗菌肽药物研发[35]
由于抗菌肽高效、低毒和特异性强等特点,它们已经在生物医药领域引起的极大关注。美国食品药品监督管理局(Food and Drug Administration, FDA)在过去的十年间批准了十余种抗菌肽药物(见表6)。

表6 2004~2013年间FDA批准的抗菌肽药物[35]Tab.6 Approved peptide-based drugs by the FDA 2004-2013[35]
6 抗菌肽应用前景及展望
抗菌肽具有高效、广谱的抗菌活性,对革兰氏阳性细菌、革兰氏阴性细菌、真菌、病毒和肿瘤细胞具有较高的活性。与传统抗生素的抗菌机制不同,抗菌肽对正常的细胞无害,且对机体不产生毒副作用,无残留等特点。这使得抗菌肽成为在临床医学、动植物转基因等领域具有广阔开发及应用前景的抗微生物制剂,不仅能够有效解决传统抗生素日益严重的耐药性问题,更以其独特的免疫调节功能,为抗感染治疗提供新方法。相信随着研究的不断深入,抗菌肽将会极大地造福人类。
致谢
这项工作由国家自然科学基金面上项目(核磁共振研究抗菌肽与细胞膜相互作用的分子机制,No.21372222)资助,在此表示感谢!
[1] Boman HG, Nilsson I, Rasmuson B.Inducible antibacterial defence system in Drosophila[J].Nature,1972,237(5352):232-235.
[2] Hwang JS, Lee J, Bang HS, et al.Isolation and characterization of a defensing-like (Coprisin) from the drug beetle, Copris tripartitus[J].International Journal of Peptides,2009,136-284.
[3] Li Y,Xiang Q,Zhang Q, et al. Overview on the recent study of antimicrobial peptides: origins, functions, relative mechanisms and application[J].Peptides,2012,37(2):207-215.
[4] Stec B. Plant thionins—the structural perspective[J].Cell Mol Life Sci,2006,63(12):1370-1385.
[5] Cipáková I,Hostinová E,Gasperík J,et al. High-level expression and purification of a recombinant hBD-1 fused to LMM protein in Escherichia coli[J].Protein Expr Purif,2004,37(1):207-212.
[6] Hwang SW,Lee JH, Park HB,et al. A simple method for the purification of an antimicrobial peptide in recombinant Escherichia coli[J].Mol Biotechnol,2001,18(3):193-198.
[7] Lee JH,Kim JH,Hwang SW,et al. High- level expression of antimicrobial peptide mediated by a fusion partner reinforcing formation of inclusion bodies[J].Biochem Biophys Res Commun,2000,277(3):575-580.
[8] Miller KW,Schamber R,Chen Y,et al. Production of active chimeric pediocin AcH in Escherichia coli in the absence of processing and secretion genes from the Pediococcus pap operon[J].Appl Environ Microbiol,1998,64(1):14-20.
[9] Pang SZ,Oberhaus SM,Rasmussen JL,et al. Expression of a gene encoding a scorpion insectotoxin peptide in yeast, bacteria and plants[J].Gene,1992,116(2):165-172.
[10] Pyo SH, Lee JH, Park HB, et al. Expression and purification of a recombinant buforin derivative from Escherichia coli[J].Process Biochem,2004,39:1731-1736.
[11] Rao XC,Li S,Hu JC,et al. A novel carrier molecule for high-level expression of peptide antibiotics in Escherichia coli[J].Protein Expr Purif,2004,36(1):11-18.
[12] Zhang L,Falla T,Wu M,et al. Determinants of recombinant production of antimicrobial cationic peptides and creation of peptide variants in bacteria[J].Biochem Biophys Res Commun,1998,247(3):674-680.
[13] Rachhart JM, Petit I, Legrain M, et al. Expression and secretion in yeast of active insect defensin, an inducible antibacterial peptide from the fleshfly Phormia terranovae[J].Invertebrate Reproduction and Development,1992,280:219-224.
[14] Andersons D,Engström A,Josephson S,et al. Biologically active and amidated cecropin produced in a baculovirus expression system from a fusion construct containing the antibody-binding part of protein A[J].Biochem J,1991,280 (1):219-224.
[15] Yarus S,Rosen JM,Cole AM,et al. Production of active bovine tracheal antimicrobial peptide in milk of transgenic mice[J].Proc Natl Acad Sci USA,1996,93(24):14118-14121.
[16] Osusky M,Zhou G,Osuska L,et al. Transgenic plants expressing cationic peptide chimeras exhibit broad-spectrum resistance to phytopathogens[J].Nat Biotechnol,2000,18(11):1162-1166.
[17] Company N,Nadal A,Ruiz C,et al. Production of phytotoxic cationic α-helical antimicrobial peptides in plant cells using inducible promoters[J].PLoS One,2014,9(11):e109990.
[18] Boman HG. Peptide antibiotics and their role in innate immunity[J].Annu Rev Immunol,1995,13:61-92.
[19] Hancock RE. Peptide antibiotics[J].Lancet,1997,349(9049):418-422.
[20] Jenssen H,Hamill P,Hancock RE. Peptide antimicrobial agents[J].Clin Microbiol Rev,2006,19(3):491-511.
[21] Vizioli J,Salzet M. Antimicrobial peptides from animals: focus on invertebrates[J].Trends Pharmacol Sci,2002,23(11):494-496.
[22] Koczulla AR, Bals R. Antimicrobial peptides:current status and therapeutic potential[J].Drugs,2003,63(4):389-406.
[23] Iijima R,Kurata S,Natori S. Purification, characterization, and cDNA cloning of an antifungal protein from the hemolymph of Sarcophaga peregrina (flesh fly) larvae[J].J Biol Chem,1993,268(16):12055-12061.
[24] Baek JH,Lee SH. Isolation and molecular cloning of venom peptides from Orancistrocerus drewseni (Hymenoptera: Eumenidae)[J].Toxicon,2010,55(4):711-718.
[25] Li Y,Xiang Q,Zhang Q,et al. Overview on the recent study of antimicrobial peptides: origins, functions, relative mechanisms and application[J].Peptides,2012,37(2):207-215.
[26] Haines LR,Thomas JM,Jackson AM,et al. Killing of trypanosomatid parasites by a modified bovine host defense peptide[J].BMAP-18. PLoS Negl Trop Dis,2009,3(2):e373.
[27] Winder D,Günzburg WH,Erfle V,et al. Expression of antimicrobial peptides has an antitumour effect in human cells[J].Biochem Biophys Res Commun,1998,242(3):608-612.
[28] Mineshiba J,Myokai F,Mineshiba F,et al. Transcriptional regulation of beta-defensin-2 by lipopolysaccharide in cultured human cervical carcinoma (HeLa) cells[J].FEMS Immunol Med Microbiol,2005,45(1):37-44.
[29] Suttmann H,Retz M,Paulsen F,et al. Antimicrobial peptides of the Cecropin-family show potent antitumor activity against bladder cancer cells[J].BMC Urol,2008,8:5.
[30] Hancock RE,Diamond G. The role of cationic antimicrobial peptides in innate host defences[J]. Trends Microbiol,2000,8(9):402-410.
[31] Matsuzaki K. Magainins as paradigm for the mode of action of pore forming polypeptides[J].Biochim Biophys Acta,1998,1376(3):391-400.
[32] Matsuzaki K,Murase O,Fujii N,et al. An antimicrobial peptide, magainin 2, induced rapid flip-flop of phospholipids coupled with pore formation and peptide translocation[J].Biochemistry,1996,35(35):11361-11368.
[33] Ehrenstein G,Lecar H. Electrically gated ionic channels in lipid bilayers[J].Q Rev Biophys,1977,10(1):1-34.
[34] Brogden KA. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria?[J].Nat Rev Microbiol,2005,3(3):238-250.
[35] da Costa JP,Cova M,Ferreira R,et al. Antimicrobial peptides: an alternative for innovative medicines?[J].Appl Microbiol Biotechnol,2015,99(5):2023-2040.
(编校:谭玲)
《当代介入医学电子杂志》征稿函
《当代介入医学电子杂志》是由国家卫生计划生育委员会主管,中国医师协会和人民军医出版社主办,人民军医电子出版社出版的多媒体医学学术电子期刊;由“医视界”承办,《当代介入医学电子杂志》编辑部编辑发行。其国内统一刊号为:CN11-9353/R;国际标准刊号为:ISSN 2095-834X。本刊于2015年4月创刊,官网同时上线。
办刊方针:以“大介入、大融合”为方向,整合介入医学在多学科领域应用的基础理论、临床实践、技术研发;促进中国介入医学整体水平的快速、健康发展。
办刊特色:以现代化多媒体技术为依托,充分借助图、文、声、像手段——实现介入医学理论与技术信息的立体化、交互式的传播;最终促进并实现多学科的交叉与融合。
栏目设置:刊首语、前沿、综述、基础研究、临床研究(血管介入、神经介入、肿瘤及非血管介入、心脏介入)、病例报告、述评、专题、介入新技术、介入护理、国外译文、名家讲堂、手术演示、会议通讯、介入圈等。
读者对象:①介入医学研究人员、介入医学临床医护人员、介入医药器械企业的从业人员等——涉及血管、肿瘤、神经、心脏、消化、放射、超声、护理等多个学科;②全国各医学专业相关图书馆、医疗卫生行政管理机构、医药器械企事业单位等机构。
一、文稿要求
稿件内容应具有科学性、实用性、创新性。论著、综述类文章不宜超过7200字,科研简报不宜超过3600字,病例报告不宜超过1800字。所有稿件的伦理道德问题、发表论文相关的出版和编辑问题等需要遵循国际医学期刊编辑委员会制定的《生物医学期刊投稿的统一要求》的基本原则。临床研究必须遵循《世界医学协会郝尔辛基宣言》的原则,对任何涉及人体的研究均应注明得到受试者知情同意,并获得伦理委员会的批准;任何动物实验研究均应声明遵循《实验动物保护条例》。
二、多媒体素材要求
音频:①人声发音准确,吐字清晰,标准普通话,语速150~200字/min;②生理音声音清晰,能体现生理性问题;③效果音清晰,主体明确;④格式以MP3为主。
视频:①内容真实,逻辑清楚,主题突出;②名家讲堂可采用课堂直录,授课教授以标准普通话讲解,发音清晰响亮;③手术视频需反映手术关键步骤和重要技巧;④操作视频应步骤清晰,重点突出,表述准确;⑤画面清晰,稳定,无抖动、扭曲、模糊等现象;⑥视频高清1920×1080,不低于720×560,不低于1500码流;⑦支持手机拍摄,不低于600万像素拍摄;⑧音频信号不失真,音量电平比例适当,音画同步;⑨字幕字体统一采用微软亚黑,字号40号,颜色黑、白,画面下端居中布局;⑩格式以MP4为主。
动画:①平面或空间效果展示,表述准确,重点突出;②视频高清1920×1080,不低于720×560,不低于1500码流;③音频信号不失真,音量电平比例适当,音画同步;④字幕字体统一采用微软亚黑,字号40号,颜色黑、白,画面下端居中布局;格式以MP4为主。
编辑部地址: 北京市朝阳区芍药居38号楼3层8302室(100029)
联系电话:010-84280076-8720;传真:010-84662099
投稿邮箱:intervmed@cyberzone.cn
官网网址:www.intervmed.com
Progress of antimicrobial peptides research and application
YIN Kun-lun, WANG Jia-rong, SUN Hong-binΔ
(High Magnetic Field Laboratory, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei 230031, China)
Antimicrobial peptides (AMPs) are critical component of the innate immune system of organisms, and have been demonstrated with the activity against a variety of microorganisms including bacteria, yeast, fungi, viruses and even tumor cells.Broad-spectrum activity and low propensity for resistance development make the AMPs as a kind of great potential for development of new anti-infective agents.In this paper, the origins, the action, the mechanism, the application prospects are reviewed.
antimicrobial peptides; origins; action; mechanism; application prospects
国家自然科学基金面上项目(核磁共振研究抗菌肽与细胞膜相互作用的分子机制,No.21372222)
尹昆仑,男,硕士,研究方向:生物大分子结构生物学研究,E-mail: yinkunlun@hmfl.cas.cn;孙红宾,通讯作者,男,博士,研究员,研究方向:生物大分子结构生物学研究,E-mail:hbsun@hmfl.ac.cn。
S816.7
A
1005-1678(2015)05-0181-05

