汉防己甲素对小鼠血管内皮瘤细胞的影响及其分子机制研究
刘畅,赵宝祥
(1.河南省肿瘤医院 重症医学科,河南 郑州 450008;2.山东省医学科学院 肿瘤科,山东 济南 250100)
汉防己甲素对小鼠血管内皮瘤细胞的影响及其分子机制研究
刘畅1,赵宝祥2
(1.河南省肿瘤医院 重症医学科,河南 郑州 450008;2.山东省医学科学院 肿瘤科,山东 济南 250100)
目的 探求汉防己甲素对小鼠内皮瘤细胞系EOMA 细胞的影响及其分子机制。方法 采用 MTT方法考察汉防己甲素在时间和浓度上对EOMA细胞的影响;使用流式细胞术检测汉防己甲素处理后的EOMA细胞内各个不同细胞周期内的含量,推测汉防己甲素对EOMA细胞的G1/S期检验点的影响;Western blot方法分析汉防己甲素引起EOMA细胞阻滞的分子机制,并用流式细胞术检测细胞内活性氧水平,用活性氧清除剂NAC预处理细胞后再进行药物孵育测定。结果 汉防己甲素能够有效抑制此细胞的增殖,随着浓度增加时间延长,细胞增殖率下降;在汉防己甲素20 μM 时作用48 h后便有显著的抑制作用。汉防己甲素对EOMA细胞周期中G1/S期的细胞阻滞和升高细胞内活性氧(reactive oxygen species,ROS)水平、上调AKT, GSK-3β以及p53等上游蛋白水平,从而使细胞周期阻滞,使周期蛋白的表达发生变化。而ROS的抑制剂NAC可以明显地抑制EOMA细胞周期因子的调控。结论 汉防己甲素可以抑制肿瘤血管新生,为后续研究将汉防己甲素作为临床抗癌药物提供了理论依据。
汉防己甲素;小鼠血管内皮瘤细胞;血管新生;细胞周期阻滞;活性氧
肿瘤组织四周伴有血管与之连接的现象在一百年前就被发现,而肿瘤血管新生的理论却是由美国的Folkman[1]在上世纪七十年代提出的,这个理论的核心在于研究血管新生于肿瘤生长之间的关系,提出肿瘤生长到一定体积后便刺激周围的血管新生,已保证肿瘤组织在进一步生长的过程中能够获取足够的营养物质,并且对于肿瘤细胞的转移有着十分密切的联系,所以认为抗肿瘤组织周围的血管新生能够有效抑制肿瘤的额生长和转移从而使肿瘤的生长停滞在初期。汉防己甲素(tetrandrine,Tet)其抗肿瘤作用显著,当前研究显示抗肿瘤机制包括直接细胞毒作用、诱导凋亡作用、放化疗减毒增敏、逆转耐药、正常组织的放射保护作用、抗远处转移及抗血管新生等[2]。本文通过初步观察汉防己甲素在体外能够抑制小鼠内皮瘤细胞系EOMA 细胞的增殖这一现象,探求其作用本质和分子机理,从而为汉防己甲素在抗血管新生上的分子机理和作为抗肿瘤药物提供理论依据。
1 材料及方法
1.1 材料
1.1.1 细胞株:小鼠内皮瘤细胞株:EOMA,购自美国细胞典藏中心(ATCC)。胎牛血清和DMEM-高糖培养基购自HyClone 公司。青霉素和链霉素(AR)均购自sigma 公司。
1.1.2 抗体:CD31购自美国BD 公司;β-tubulin购自Santa Cruz公司;二抗羊抗鼠Ig-HRP、二抗羊抗兔Ig-HRP、CDK-2、Cyclin-E1、AKT 和GAPDH 抗体购自碧云天公司;Cyclin-D2、Cyclin-D3、Cyclin-E2、CDK-4 和CDK-6 购自武汉三鹰公司;Cyclin-D1、p-AKT(Ser473),P53、P27KIP1、GKS-3β、LC-III-β 和PARP 抗体购自Cell signaling technology 公司。
1.1.3 药品与试剂:汉防己甲素(TET,粉末状,DMSO 溶解,配制成20 mM储存液,于-80 ℃保存)购自上海融禾医药科技有限公司;3-(4,5-dimethylthylthiazol-2-yl)-2,5-diphenyltetra-zolium bromide(MTT)粉末购自美国Amresco公司;荧光ROS探针试剂DCFH-DA购自Invitrogen公司;ROS清除剂N-乙酰-L-半胱氨酸(NAC)购自Sigma公司;PI3K 抑制剂LY-294002购自碧云天公司;羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC)为本实验室保存;碘化丙啶(PI,粉末状)购自美国MP 生物医药公司。
1.1.4 实验动物:10只,SPF级4周龄BALB/c 雄性裸鼠均购于湖北省疾病预防中心,实验动物均在SPF环境中、12 h昼夜交替饲养。实验严格遵循《实验动物保护条例》。
1.2 实验方法
1.2.1 MTT实验检测汉防己甲素在时间和浓度上对EOMA 细胞的影响:检测TET对EOMA细胞的生长抑制作用;在96孔板的每孔中加入1×104个细胞,次日加入不同剂量(0~200 μmol/L)的TET重复3孔。作用24 h后,每孔加入MTT(5 g /L)20 μL,继续培养3 h,弃上清后,每孔加入100 μL的DMSO,490 nm波长测定各孔的光密度值(opti-cal density,OD), 按公式计算细胞增殖抑制率:抑制率=(对照组A值-实验组A 值) /(对照组A 值-空白组A值)×100%。
1.2.2 Western blot检测EOMA 细胞内周期调控蛋白的水平:将30~60 μg样品放在SDS聚丙烯酰胺凝胶上进行电泳,当溴酚蓝(示踪染料)到达距分离胶底部0.5 cm时,关闭电源,将浸泡好硝酸纤维素膜和吸附滤纸按照支持垫、张吸水纸、凝胶、膜、张吸水纸和支持垫进行组合转印,4 ℃条件下转印过夜。转印完成后,将硝酸纤维素膜封闭液封闭,室温轻摇1h。一抗反应:加入用封闭液稀释的一抗10 mL(抗P-gp 、actin特异抗体,1:1000稀释),4 ℃轻摇过夜或者室温2 h。漂洗滤膜3次,每次10 min。二抗反应:将膜用封闭液稀释的辣根过氧化物酶标记的相应抗体(稀释浓度为1:2000),室温轻摇1 h。漂洗滤膜3次。ECL法显色 :将等体积ECL试剂A液、B液,混合均匀加到转印膜上,反应5 min。暗室曝光,曝光1~2 min不等,显影、定影,自来水充分冲洗。蛋白质定量分析: X光片用Mixrotek ScanWizard5扫描软件进行电脑扫描、Quantity one 7.0图像分析软件做灰度分析。
1.2.3 流式细胞仪检测细胞凋亡:收集各组细胞,调整细胞浓度为1×106/mL,按照美国BD公司凋亡试剂盒说明书,分别加入10 μL PI 和5 μL Annexin-V,待反应结束后,采用流式细胞仪检测细胞凋亡比。

2 结果
2.1 MTT方法检测Tet在时间和浓度上对EOMA细胞的影响 不同的处理时间8、12、24、48 h对EOMA 细胞的增殖抑制结果有着较大差别,结果显示浓度小于10 μM的汉防己甲素对于EOMA细胞的抑制效果不明显,然而随着浓度的加大,在大于20 μM 时便会对EOMA细胞有较为明显的抑制作用,药物的作用效果表现在作用48 h之后。高浓度组160 μM 甚至在孵育12 h 后便对EOMA细胞有着较为明显的抑制效果,见图1。

图1 Tet对EOMA 细胞增值影响实验Fig.1 The experimental Tet value effect on EOMA cells
2.2 Tet对EOMA细胞周期的影响 G1期的细胞有不同程度上增加,而S期的细胞随着浓度的加大而逐渐减少,并且细胞凋亡量很少,和对照组相比差异没有统计学意义,见图2。
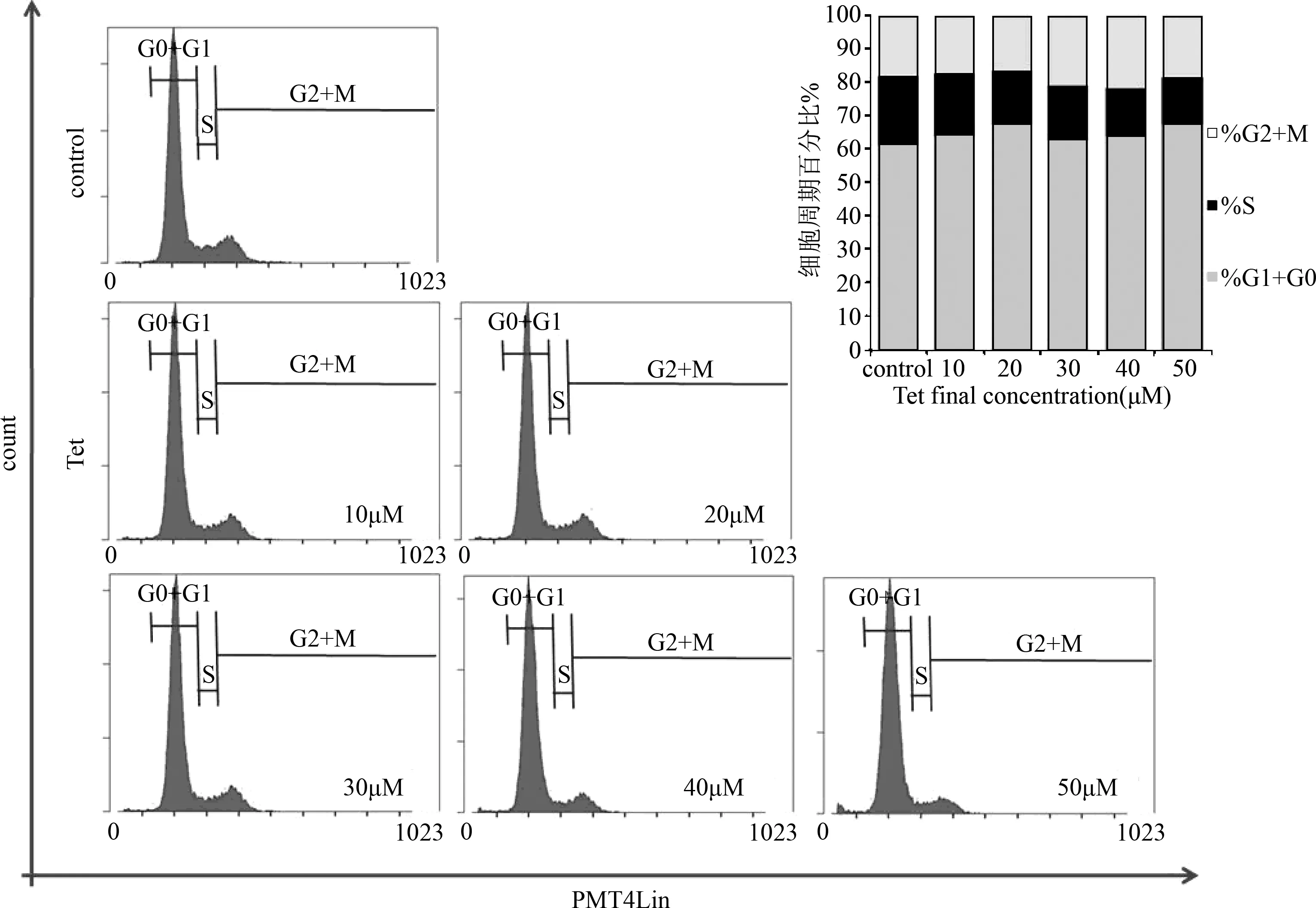
图2 Tet对EOMA细胞周期的影响Fig.2 Effect of Tet on cell cycle of EOMA
2.3 Tet影响EOMA 细胞内周期调控蛋白的水平 蛋白在经Tet处理后的EOMA细胞中的表达水平与β-actin相比均出现了不同程度的降低,其中Cyclin-D1,E1以及CDK-2,4的表达量降低地最为明显,见图3。

图3 48 h后Tet处理前后的EOMA细胞中蛋白表达情况Fig.3 The protein expression of EOMA cell before and after Tet treatment at 48 h later
2.4 Tet 对EOMA细胞内ROS水平的影响 EOMA细胞内部的活性氧水平在汉防己甲素的作用下有了很大提升。通过流式细胞术进行了验证,所示结果显示无论是30 μM还是50 μM组都能够引起EOMA细胞内活性氧水平的提升,其中50 μM能够大幅度提高ROS 在EOMA细胞内的水平,是对照组的2.01倍。证实汉防己甲素的确能引起EOMA细胞内的ROS 含量大幅提升,见图4。

图4 Tet对EOMA细胞内ROS水平的影响Fig.4 Effect of Tet on the level of ROS in EOMA cells
2.5 汉防己甲素引起的EOMA细胞周期阻滞依赖于ROS 的上调 NAC能够有效降低因Tet 引起的EOMA 细胞内ROS 水平的升高,见图5。
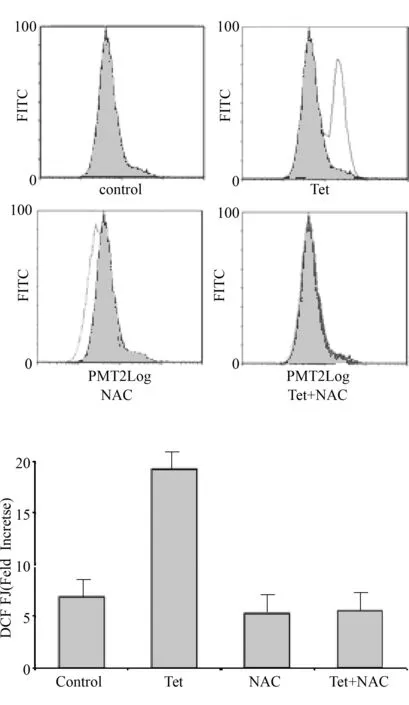
图5 NAC逆转Tet引起的EOMA 细胞内ROS 水平的上调Fig.5 The ROS level of NAC reversed Tet induced upregulation of EOMA cells
2.6 AKT抑制剂LY对Tet引起的EOMA细胞内ROS的影响 Tet处理后EOMA细胞内的AKT总量并不发生显著变化,然而磷酸化水平会明显降低,并且能够被ROS清除剂NAC所清除,这表明在Tet引起的EOMA细胞周期阻滞中,ROS能够调节细胞内的AKT磷酸化水平。
通过 AKT 的抑制剂LY294002(LY)与Tet共同作用下并不改变细胞内的ROS 水平,且其作用效果具有协同效应,见图6。从而得出AKT 位于ROS 的下游,推测其水平的改变最终作用与细胞内周期相关蛋白的改变,从而引起了细胞周期阻滞。

图6 AKT抑制剂LY 对Tet 引起的EOMA 细胞内ROS 的影响Fig.6 Effects of AKT inhibitor LY on ROS in Tet induced EOMA cells
3 讨论
汉防己甲素是防己科植物粉防己的块根中提取分离的一种生物碱,在抑制人实体瘤细胞以及白血病细胞及其耐药细胞株的增殖,诱导肿瘤细胞凋亡方面的研究及其作用机制已经被陆续报道[3]。Wu JM等[4]指出汉防己甲素抑制 BALB/C裸鼠体表结肠癌肿瘤的生长并且诱导其发生凋亡,这种凋亡机制很可能是通过激活MAPK信号通路实现的。而本研究证实,Tet处理后EOMA细胞内的AKT总量并不发生显著变化,然而磷酸化水平会明显降低,显然是启动激活了MAPK信号通路,而引起细胞凋亡。
研究发现,汉防己甲素能够有效抑制此细胞的生殖,并呈现出浓度和时间相关性,在汉防己甲素20 μM 时作用48 h后便有明显的抑制作用[5-6]。汉防己甲素主要是通过引起EOMA细胞周期中G1/S期的细胞阻滞,从而达到抑制细胞增殖的作用[7-10]。这与报道的研究结果类似,汉防己甲素能抑制人胃癌BGC-823细胞具有生长抑制作用,且随着药物浓度的增加和作用时间的延长,具有明显的时间-剂量依赖性[11-12]。而本研究证实汉防己甲素是通过升高细胞内活性氧(ROS)水平的升高达到的细胞周期的阻滞作用,并调节了AKT, GSK-3β以及p53等细胞周期上游蛋白水平,最终使得周期蛋白的表达发生变化。进一步研究证明,汉防己甲素引起细胞内ROS水平的上调从而诱发了EOMA细胞的周期阻滞[13-14]。并且,使用ROS的抑制剂NAC可以明显地抑制EOMA细胞周期因子的调控[15]。
综上所述,汉防己甲素是抑制细胞周期的变化新生,从而最终抑制肿瘤生长上的化合物,为后续研究将汉防己甲素作为临床抗癌药物提供了理论依据。
[1] Carmeliet P.Angiogenesis in life,disease and medicine[J].Nature,2005,438(23): 932-936.
[2] Risau W and Flamme I.Vasculogenesis[J].Annu Rev Cell Dev Biol,1995,11:73-91.
[3] Risau W.Mechanisms of angiogenesis[J].Nature,1997,386(6626): 671-674.
[4] Wu JM,ChenY,Chen JC,et al.Tetrandrine induces apoptosis and growth suppresion of colon cancer cells in mice[J].Cancer Let,2010,287(2):187-195.
[5] Mikkola HK and Orkin SH.The search for the hemangioblast[J].J Hematother Stem Cell Res,2002,11(1):9-17.
[6] Luttun A,Carmeliet G,Carmeliet P.Vascular progenitors: from biology to treatment[J].Trends Cardiovasc Med,2002,12(15):88-96.
[7] Reyes M,Dudek A,Jahagirdar B,et al.Origin of endothelial progenitors in human postnatal bone marrow[J].Clin Invest,2002,109(17): 337-346.
[8] Rehman J,Li J,Orschell CM,et al.Peripheral blood "endothelial progenitor cells" are derived from monocyte/macrophages and secrete angiogenic growth factors[J]Circulation,2003,107(13): 1164-1169.
[9] Takakura N,Watanabe T,Suenobu S,et al.A role for hematopoietic stem cells in promoting angiogenesis[J]Cell,2000,102(15):199-209.
[10] Grant MB,May WS,Caballero S,et al.Adult hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization[J].Nat Med,2002,8(6):607-612.
[11] Gerber HP,Malik AK,Solar GP,et al.VEGF regulates haematopoietic stem cell survival by an internal autocrine loop mechanism[J].Nature,2002,417(17): 954-958.
[12] Hattori K,Heissig B,Wu Y,et al.Placental growth factor reconstitutes hematopoiesis by recruiting VEGFR1(+) stem cells from bone-marrow microenvironment[J].Nat Med,2002,8(15):841-849.
[13] Lyden D,Hattori K,Dias S,et al.Impaired recruitment of bone-marrow-derived endothelial and hematopoietic precursor cells blocks tumor angiogenesis and growth[J].Nat Med,2001,7(11): 1194-1201.
[14] Luttun A,Tjwa M,Moons L,et al.Revascularization of ischemic tissues by PlGF treatment,and inhibition of tumor angiogenesis,arthritis and atherosclerosis by anti-Flt1[J].Nat Med,2002,8(2):831-840.
[15] Folkman J and D'Amore PA.Blood vessel formation: what is its molecular basis?[J].Cell,1996,87(22):1153-1155.
(编校:王冬梅)
Effect of tetrandrine on murine hemangioendothelioma cell and its molecular mechanisms
LIU Chang1,ZHAO Bao-xiang2
(1.Department of Intensive Medicine, Henan Tumor Hospital, Zhengzhou 450008, China; 2.Department of Oncology, Shandong Province Academy of Medical Sciences, Jinan 250100, China)
ObjectiveTo explore tetrandrine on murine hemangioendothelioma cell and its mechanisms.MethodsExplore the effect of tetrandrine on EOMA cells in time and concentration MTT experiment, the content of tetrandrine treated EOMA cells in different cell cycle detected by flow cytometry, speculated effect of tetrandrine on G1/S phase checkpoint for EOMA cells blocking.Western blot analyzed the molecular mechanism of tetrandrine induced EOMA cell block, and intracellular reactive oxygen species level were detected byflow cytometry.Then used the active oxygen scavenger NAC pretreated cells after drug incubation.ResultsTetrandrine could inhibit the cell reproduction, and showed a concentration and time dependence, role in tetrandrine 20 μM was significantly inhibited after 48 h.Tetrandrine caused mainly by EOMA cells during the cell cycle of G1/S phase cell block, so as to achieve the effect of inhibiting cell proliferation.Tetrandrine increased intracellular reactive oxygen species (ROS) blockade effect of elevated levels of cell cycle to achieve, and the regulation of AKT, GSK-3 β and p53 cell cycle upstream protein level, finally maked the expression changes.Further research proved that, tetrandrine induced up-regulation of ROS level in cells to induce EOMA cell cycle arrest.Moreover, regulated by the ROS inhibitor NAC could significantly inhibit EOMA cell cycle factor.ConclusionTetrandrine can inhibit tumor angiogenesis, which provides theory basis for clinical anti-cancer drugs in inhibiting tumor growth.
tetrandrine;vascular endothelial cells in mice tumor cells;angiogenesis;cell cycle arrest;reactive oxygen species
山东省自然科学基金项目(Z2008B10)
刘畅,男,硕士,医师,研究方向:肿瘤,E-mail:qch1821460120@163.com。
R735.1
A
1005-1678(2015)03-0054-04

