拉米夫定治疗B/C基因型乙肝病毒疗效及其相关性的Meta分析
吴思思,朱珊珊,史艳秋,3Δ
(1.山东大学 药学院,山东 济南 250100;2.山东省医学影像学研究所,山东 济南 250100;3.山东大学新药评价中心,山东 济南 250100)
拉米夫定治疗B/C基因型乙肝病毒疗效及其相关性的Meta分析
吴思思1,2,朱珊珊1,史艳秋1,3Δ
(1.山东大学 药学院,山东 济南 250100;2.山东省医学影像学研究所,山东 济南 250100;3.山东大学新药评价中心,山东 济南 250100)
目的 采用Meta分析评价拉米夫定治疗B/C基因型乙肝病毒的疗效及其相关性。方法 检索CNKI(1966~2013); Medline(1966~2013)、Pubmed(1966~2013)、Web of Science (1966~2013)中的RCT论文,按照方案设计的标准对文献进行筛选。最终所得文献使用Revman 5.0等软件进行Meta分析。结果 得19篇RCT研究文献,共涉及被试者3148人。其中,10篇文献(n=1860)为HBV DNA转阴研究;9篇文献(n=1288)为HBeAg清除研究。应用拉米夫定后,HBV DNA转阴研究的总体RR为1.07(95%CI:0.98~1.17);HBeAg清除可见于B基因型组,总体RR为1.27(95%CI:0.94~1.71)结论 拉米夫定治疗HBV的疗效与HBV属于B或C基因型无关。需要通过进一步研究证明其中的作用机制。有必要进行大规模、多中心试验研究,评估不同基因型HBV对病程和抗病毒治疗疗效的影响。
乙型肝炎;拉米夫定;Meta分析;B基因型乙肝病毒;C基因型乙肝病毒
乙型肝炎病毒(hepatitis B virus,HBV)是临床中肝硬化和肝细胞癌的主要诱因之一[1]。已有研究表明,抗病毒疗法应用于不同基因型的HBV,疗效也有着很大差异[2-3]。当使用干扰素治疗时,疗效差异最为显著。拉米夫定是一种强效的HBV逆转录抑制剂,能够降低血清中HBV脱氧核苷酸(HBV-DNA)的含量,提高乙肝患者的乙肝e抗原(HBeAg)血清转换率。就该药治疗B基因型HBV与C基因型HBV的疗效差异而言,多篇文献报道,观察服用拉米夫定治疗HBeAg阳性肝炎的患者(100mg/d)1年后,发现其针对2种基因型的HBV无疗效差异[4-7]。这些结果并非是结论性的,且尚未纳入最近一个时期的相关报道。目前关于拉米夫定治疗不同基因型HBV的疗效数据并不十分明晰。因此,本文拟整合相关文章,进行Meta分析,以期发现拉米夫定治疗B基因型HBV与C基因型HBV的疗效差异及相关性。
1 资料与方法
1.1 文献检索策略 检索拉米夫定治疗B基因型HBV与C基因型HBV的疗效的相关文献。文献的来源包括:CNKI(1966~2013); Medline(1966~2013)、Pubmed(1966~2013)、Web of Science(1966~2013)。中文库检索词为:“B基因型”或“C基因型”和“拉米夫定”和“HbeAg清除”和“DNA转阴”。英文库检索词为:“genotype B”或“genotype”“LAM”和“HBeAg clearance”和“DNA conversion of negative”。并根据检索到的文献的参考文献,进一步进行检索。
1.2 方法
1.2.1 文献纳入、排除标准:中、英文文献纳入标准如下:①上述4个数据库中提供全文下载文献;②随机对照试验(RCT);③受试者为慢性乙型肝炎患者,且接受的干预为拉米夫定100 mg/d,持续48周,期间未接受其他干预措施;④报道的数据足够用于估计95%置信区间(CI)的相对危险度(RR)。
1.2.2 中、英文文献的排除标准:①受试者为急性肝炎患者;②受试者为同一作者较大规模研究中的受试对象的子集;③研究数据不明确、研究数据自相矛盾的情况;④受试者接受拉米夫定治疗<48周。
最终纳入研究19项(报道16篇),其中9项研究设计B基因型乙肝病毒、C基因型HBV与HBeAg清除的关系[8-16];10篇涉及B基因型乙肝病毒、C基因型HBV的DNA转阴情况[17-26]。
1.2.3 评价标准:治疗24周结束,对评价疗效的主要终点指标进行评估,包括HBeAg血清转换(即HBeAg的下降与抗Hbe抗体的出现);HBV DNA拷贝数是否被控制在100 000/mL以下。治疗24周结束,对评价疗效的次要终点指标进行评估,包括综合疗效(HBeAg血清转换、丙氨酸转氨酶水平、HBV DNA拷贝数是否被控制在100 000/mL以下)、HBeAg血清转换、组织学应答(Knodell肝组织学活性积分较治疗前下降至少2分)。
1.2.4 数据整理:提取、整理文献中的如下数据:作者姓名、出版时间、期刊名称、样本量、HBeAG情况(阴性/阳性)、血清HBVDNA含量(拷贝数/mL)、HBV基因型。HBV DNA拷贝数的数值均转换为对数形式表达。
1.3 统计学方法 使用Revman 5.0及Stata 9进行Meta分析。用固定效应模型或随机相应模型分析拉米夫定对B基因型HBV和C基因型HBV的疗效的关联强度。I2用以衡量多个研究结果间异质程度的大小[24]。若研究结果无异质性,则采用固定效应模型(fixed effect model)进行Meta分析;若研究结果有异质性,则采用随机效应模型(random effect model)进行Meta分析。采用Begg漏斗图对小规模研究效应进行分析。采用Begg-Mazumdar法计算秩相关和加权回归分析的P值[26]。本文中,对于HBeAg清除(t=0.18,P=0.861)和DNA转阴(t=2.28,P=0.052)相关数据,双侧P<0.05则判断研究结果有统计学意义。
2 结果
2.1 纳入研究结果 共检索到相关文献332篇,用纳入、排除标准筛选后,最终得19篇RCT研究文献。共涉及被试者3148人(列入本研究的拉米夫定治疗组)(见图1)。19篇文献(2篇为中文文献[11-12],17篇为英文文献[8-10,13-26])均记录了明确的纳入、排除标准。其中,10篇文献(n=1860)为HBV DNA转阴研究;9篇文献(n=1288)为HBeAg清除研究。见表1、表2。
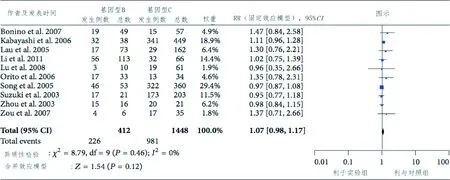
图1 HBV DNA 转阴与基因型B/C乙肝病毒的关联Fig.1 Forest plot for the associations of genotype B/C and HBV DNA conversion of negativeto lamivudine therapy 表1 Meta分析中纳入的HBV DNA文献特征描述Tab.1 Characteristics of HBV DNA included in meta-analysis
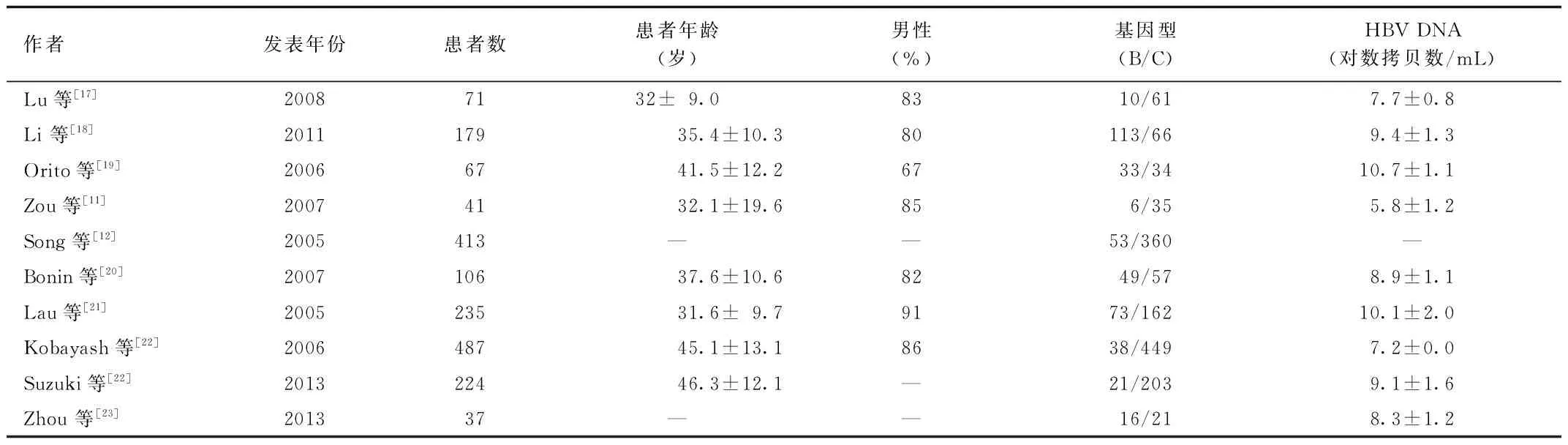
作者发表年份患者数患者年龄(岁)男性(%)基因型(B/C)HBVDNA(对数拷贝数/mL)Lu等[17]20087132±9.08310/617.7±0.8Li等[18]201117935.4±10.380113/669.4±1.3Orito等[19]20066741.5±12.26733/3410.7±1.1Zou等[11]20074132.1±19.6856/355.8±1.2Song等[12]2005413——53/360—Bonin等[20]200710637.6±10.68249/578.9±1.1Lau等[21]200523531.6±9.79173/16210.1±2.0Kobayash等[22]200648745.1±13.18638/4497.2±0.0Suzuki等[22]201322446.3±12.1—21/2039.1±1.6Zhou等[23]201337——16/218.3±1.2

表2 Meta分析中纳入的HBeAg清除文献特征描述
2.2 HBV DNA转阴研究 通过χ2和I2检验,检验所有纳入分析的文献的异质性,结果表明各研究间异质性差异无统计学意义。HBV DNA转阴研究的总体RR为1.07(95%CI:0.98~1.17),见图1。HBV DNA转阴与B、C基因型病毒的关联的Begg漏斗图见图2,其中RR为横坐标,标准误(SE)为纵坐标。加权回归分析结果未发现发表偏倚(P=0.052)。总体分析未见异质性(I2=0,P=0.46)。
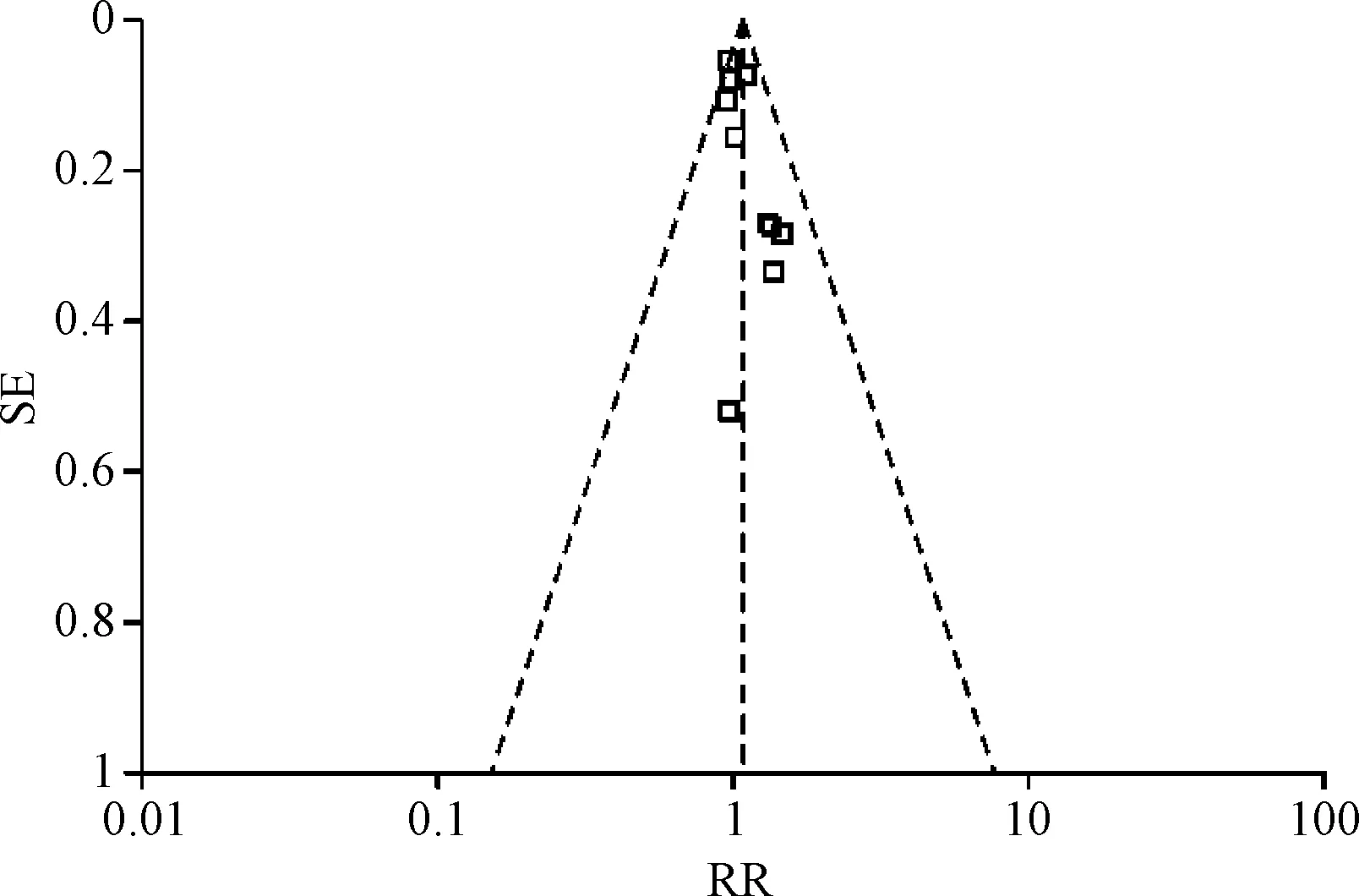
图2 HBV DNA转阴与B/C基因型病毒的关联的Begg漏斗图Fig.2 Begg’s funnel plots for the associations of genotype B/C and HBV DNA conversion of negative to observational therapy
2.3 肝炎HBeAg抗原清除研究 通过χ2和I2检验,检验所有纳入分析的文献的异质性,结果表明各研究间异质性差异有一定统计学意义(I2=54%,P=3)。9篇纳入分析的文献中,HBeAg清除可见于B基因型组,总体RR为1.27(95%CI:0.94~1.71),见图3。HBeAg清除与B、C基因型病毒的关联的Begg漏斗图见图4,其中RR为横坐标,SE为纵坐标。加权回归分析结果未发现发表偏倚(P=0.861)。
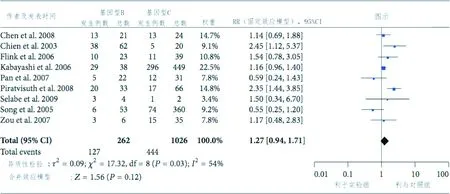
图3 HBeAg转换与基因型B/C乙肝病毒的关联Fig. 3 Forest plot for the associations of genotype B/C and HBeAg clearance to lamivudine therapy
图4 HBeAg清除与B/C基因型病毒的关联的Begg漏斗图Fig.4 Begg’s funnel plots for the associations of genotype B/C and HBeAg clearance to observational therapy
3 讨论
慢性HBV感染是肝炎病毒、肝细胞、免疫应答3者之间的动态过程[27-29]。研究表明,HBV共有8种基因型(A~H),不同地区和不同民族基因型分布不同,而且不同基因型其HBV的传播方式、临床疾病谱、预后判断、疫苗预防及抗病毒治疗选择等都有差异,甚至同一HBV基因型的不同亚型在毒力和临床表现上也有区别。因此,近年来国内外掀起了HBV基因型分型研究的热潮[2-3]。其中,B、C是亚裔人口最常见的基因型。现阶段研究表明,C基因型病毒最常见于严重肝病、肝细胞癌;B基因型病毒往往在急性肝炎中有着更快的HBeAg血清转换率[30-32]。目前已经正式,病毒基因型可以作为慢性丙型肝炎的疗效预测指标,但其是否能用以预测HBV的疗效,尚不明确。目前尚无关于拉米夫定对B、C基因型肝炎病毒疗效的系统综述发表。
本次Meta分析纳入的文献中,慢性HBV患者全部接受拉米夫定100 mg/d治疗,持续48周,期间不接受任何其他治疗。各研究中,治疗前ALT水平在正常范围(≤50 IU/L)内的患者均予以剔除。所有患者均有6个月以上的HBsAg阳性史,且丙型肝炎、抗艾滋病病毒阴性。所有患者均接受过超声或CT扫描,以明确排除代偿性肝硬化或肝细胞癌的可能。
根据意向治疗(intent-to-treat,ITT)原则对患者的有效率进行评估。评估纳入分析的1288名慢性HBV患者在接受拉米夫定治疗后的HBeAg清除情况,以观察拉米夫定对基因型B和基因型C肝炎病毒的疗效区别。本次Meta分析结果显示,基因型B组的患者出现了HBeAg清除,总体RR为1.27(95%CI:0.94-1.71)。
另外,本次Meta分析结果显示,经过52周治疗,基因型B与基因型C乙肝病毒的HBV DNA转阴情况无统计学差异,总体RR为1.07(95%CI:0.98~11.7)。这一结果与以往其他研究的结果相同[19-23,35-37]。研究并未发现拉米夫定治疗后的HBV DNA转阴与B或C基因型病毒有相关性。
综上所述,Meta分析表明,拉米夫定治疗HBV的疗效与HBV属于B或C基因型无关(疗效评价指标:HBeAg血清转换、HBVDNA转阴)。需要通过进一步研究证明其中的作用机制。有必要进行大规模、多中心试验研究,评估不同基因型HBV对病程和抗病毒疗效的影响。
[1] Dienstag JL.Drug therapy: hepatitis B virus infection[J]. N Engl J Med,2008,359(14): 1486-1500.
[2] Schaefer S.Hepatitis B virus taxonomy and hepatitis B virus genotypes[J].World J Gastroenterol, 2007,13(1): 14-21.
[3] Bartholomeusz A,Schaefer S. Hepatitis B virus genotypes: comparison of genotyping methods[J]. Rev Med Virol, 2004,14(1): 3-16.
[4] Zeng A, Deng H, Yang C,et al. Hepatitis B virus genotype-associated variability in antiviral response to adefovirdipivoxil therapy in Chinese han population[J].Tohoku J Experi Med,2008,216(3): 205-211.
[5] Zeng G, Wang Z, Wen S, et al.Geographic distribution, viro-logic and clinical characteristics of hepatitis B virus genotypes in China[J]. J Viral Hepat, 2005,12(6): 609-617.
[6] Carey I,Harrison PM.Monotherapyversuscombination therapy for the treatment of chronic hepatitis B[J]. Expert Opin Investig Drugs, 2009,18(11): 1655-1666.
[7] Palumbo E. Hepatitis B genotypes and response to antiviral therapy: a review[J].Am J Ther,2007, 14(3): 306-309.
[8] Flink HJ, van Zonneveld M, Hansen BE, et al. Treatment with Peg-interferon α-2b for HBeAg-positive chronic hepatitis B: HBsAg loss is associated with HBV genotype[J].Am J Gastroenterol, 2006,101(2): 297-303.
[9] Pan XP, Li LJ, Du WB, et al. Differences of YMDD mutational patterns, pre-core/core promoter mutations, serum HBV DNA levels in lamivudine-resistant hepatitis B genotypes B and C[J].J Viral Hepat, 2007,14(11): 767-774.
[10] Piratvisuth T, Lau G, Chao Y, et al. Sustained response to peginterferon alfa-2a (40 kD) with or without lamivudine in Asian patients with HBeAg-positive and HBeAg-negative chronic hepatitis B[J]. Hepatol Int,2008, 2(1): 2-110.
[11] 周怀宾,朱理民,赵桂鸣,等.e抗原阳性慢性乙型肝炎患者感染病毒的基因型与抗病毒治疗疗效的关系[J].中华肝脏病杂志,2007,15(6):425-427.
[12] 宋淑静,庄辉,闫杰,等.拉米夫定早期疗效与乙型肝炎病毒基因型的关系[J]. 中华预防医学杂志,2005,39(3):203-205.
[13] Chen J, Wang Z, Ma S, et al. Changes of serum HBsAg in HBeAg positive chronic hepatitis patients with sustained viral response to long-term lamivudine treatment[J].ZhonghuaGanZang Bing ZaZhi, 2008,16(6): 416-420.
[14] Selabe SG, Song E, Burnett RJ, et al.Frequent detection of hepatitis B virus variants associated with lamivudine resistance in treated South African patients infected chronically with different HBV genotypes[J].J Med Virol, 2009,81(6): 996-1001.
[15] Kobayashi M, Suzuki F, Akuta N,et al. Response to long-term lamivudine treatment in patients infected with hepatitis B virus genotypes A, B, and C[J].J Med Virol,2006, 78(10): 1276-1283.
[16] Chien R, Yeh C, Tsai S,et al.Determinantsfor sustained HBeAg response to lamivudine therapy[J]. Hepatol, 2003,38(5): 1267-1273.
[17] Lu H, Zhuang L, Yu Y, et al. Effects of antiviral agents on intrahepatic ccc DNA in HBeAg-positive chronic hepatitis B patients[J].ZhonghuaGanZang Bing ZaZhi, 2008,16(3): 198-202.
[18] Li S, Qin L, Zhang L,et al. Molecular epidemical character istics of Lamivudine resistance mutations of HBV in southern China[J].Med Sci Monit,2011,17(10): PH75-80.
[19] Orito E, Fujiwara K, Tanaka Y, et al. A case-control study of response to lamivudine therapy for 2 years in Japanese and Chinese patients chronically infected with hepatitis B virus of genotypes Bj, Ba and C[J].Hepatol Res, 2006, 35(2): 127-134.
[20] Egger M,Smith GD,Schneider M,et al. Bias in meta-analysis detected by a simple, graphical test[J].BMJ, 1997,315(7109): 629-634.
[21] Lau GK,Piratvisuth T, Kang XL, et al. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B[J]. N Engl J Med, 2005,352(26): 2682-2695.
[22] Suzuki F, Tsubota A, Arase Y, et al. Efficacy of lamivudine therapy and factors associated with emergence of resistance in chronic hepatitis B virus infection in Japan[J].Intervirology,2003, 46(3): 182-189.
[23] Zhou D, Lin L, Wang H, et al. The relationship between HBV lamivudine resistance and HBV genotypes or basic core promoter mutations[J]. Hepatobiliary Pancreat Dis Int, 2003, 2(1): 85-89.
[24] Higgins JP, Thompson SG, Deeks JJ, et al. Measuring inconsistency in meta-analyses[J]. BMJ,2003,327(7414): 557-560.
[25] Begg CB and Mazumdar M. Operating characteristics of a rank correlation test for publication bias[J]. Biometrics,1994, 50(4):1088-1101.
[26] Egger M, Smith GD, Schneider M, et al. Bias in meta-analysis detected by a simple, graphical test[J].BMJ,1997, 315(7109): 629-634.
[27] Pawlotsky J, Dusheiko G, Hatzakis A,et al. Virologicmoni-toring of hepatitis B virus therapy in clinical trials and practice: recommendations for a standardized approach[J].Gastroenterol,2008,134(2):405-415.
[28] Sumi H, Yokosuka O, Seki N, et al.Influence of hepatitis B virus genotypes on the progression of chronic type B liver disease[J].Hepatol,2003, 37(1):19-26.
[29] Liu C, Huang W, Chen P, et al.End-of-treatment virologic response does not predict relapse after lamivudine treatment for chronic hepatitis B[J].World J Gastroenterol,2004,10(24): 3574-3578.
[30] Merican I, Guan R, Amarapuka D,et al. Chronic hepatitis B virus infection in Asian countries[J]. J Gastroenterol Hepatol, 2000,15(12):1356-1361.
[31] Yuen MF, Yuan HJ, Yuang KH, et al.Prognostic determinants for chronic hepatitis B in Asians: therapeuticimplications[J]. Gut,2005,54(11),1610-1614.
[32] Leung N.Treatment of chronic hepatitis B: case selection and duration of therapy[J]. J Gastroenterol and Hepatol,2002,17(4): 409-414.
[33] Villet S, Pichoud C, Billioud G, et al. Impact of hepatitisB virus rtA181V/T mutants on hepatitis B treatment failure[J].J Hepatol, 2008,48(5):747-755.
[34] Sung JJ, Lai JY, Zeuzem S, et al. Lamivudinecomparedwith lamivudine and adefovirdipivoxil for the treatment of HBeAg-positive chronic hepatitis B[J].J Hepatol,2008, 48(5):728-735.
[35] Economou M, Manolakopoulos S, Trikalinos TA,et al.Interferon-α plus lamivudine vs lamivudine reduces break throughs, but does not affect sustained response in HBeAg negative chronic hepatitis B[J].World J Gastroenterol, 2005,11(37): 5882-5887.
[36] Sheu M, Kuo H, Lin C,et al. Lamivudine monotherapy for chronic hepatitis B infection with acute exacerbation revisited[J].Eur J Gastroenterol Hepatol, 2009,21(4): 447-451.
[37] Buti M,Elefsiniotis I, Jardi R,et al. Viral genotype and baseline load predict the response to adefovir treatment in lamivudine-resistant chronic hepatitis B patients[J].J Hepatol,2007,47(3): 366-372.
(编校:王冬梅)
HBV genotype B/C and response to lamivudine therapy: a systematic review
WU Si-si1,2, ZHU Shan-shan1, SHI Yan-qiu1,3Δ
(1.College of Pharmacy, Shandong University, Jinnan 250100, China; 2.Shandong Medical Imaging Researching Institute, Jinan250100,China; 3.Center for New Drug Evaluation of Shandong University, Jinan250100, China)
ObjectiveTo perform a meta-analysis on the association of of genotype B/C and HBV DNA conversion of negative or HBeAg clearance to lamivudine therapy.MethodsSeveral databases (PubMed, Web of Science, Science Direct, and CNKI Database) were searched from 1966 to 2012 for all publications on the association between genotype B/C and response to LAM therapy.The articles were selected according to the protocol previously designed. Meta analysis using Revman 5 software.ResultsFinally, 19 RCTs were retrieved involving 3148 patients for the subsequent meta-analysis. Among them, 10 articles (n=1860) look at HBV DNA and 9 (n=1288) at HbeAg clearance.For HBV DNA conversion of negative, the overall RR (95% CI) associated with genotype B/C was 1.07(0.98-1.17)。Of the nine analyzed trials, HBeAg clearance was observed in genotype B group as compared with that genotype C group, the overall RR (95% CI) was 1.27 (0.94-1.71).ConclusionMeta-analysis indicates that genotype B/C is not associated with response to LAM therapy. Further mechanism researches are required to clarify. Large-scale population studies in multicountries are also necessary to evaluate the influence of HBV genotypes in hepatitis B progression and antiviral treatment.
hepatitis B; lamivudine; meta-analysis; genotype B virus; genotype C virus
吴思思,女,硕士在读,主管药师,研究方向:药理学及医院药学,E-mail:1544002@qq.com; 史艳秋,通信作者,女,博士,副教授,研究方向:药理学,E-mail:shiyq@sdu.edu.cn。
R575.1
A
1005-1678(2015)10-0178-05

